Bmp/Smad 信号通路及其在哺乳动物卵巢发育中的作用
2019-08-12文禹粱赵生国储明星
文禹粱,马 琳,赵生国,储明星*
(1.中国农业科学院北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.甘肃农业大学动物科学技术学院,甘肃兰州 730070)
骨形态发生蛋白(Bone Morphogenetic Proteins,BMPs)作为转化生长因子-β(Transforming Growth Factor-β,TGF-β)超家族最大的一个亚家族[1],于1979 年由Urist 等发现,它们可以使未分化的间充质细胞定向分化为骨细胞,并钙化成骨组织,由此得名为骨形态发生蛋白[2]。BMPs 在动物体内广泛分布,依靠卵巢功能性的旁分泌/自分泌调节体系,对哺乳动物早期胚胎发育、卵巢颗粒细胞增殖、生殖激素的合成和分泌以及卵母细胞成熟起重要调节作用,而BMPs 主要依赖于经典的Bmp/Smad 信号通路来发挥生物学效应[3-5]。本文对Bmp/Smad 信号通路的成员的表达以及在哺乳动物卵巢发育中发挥的功能进行总结,以期为今后更加深入地研究其调控机制提供参考。
1 Bmp/Smad 信号通路
Bmp/Smad 信号通路由细胞外配体、细胞表面特异受体以及细胞内SMAD 信号分子三大部分共同构成。在Bmp/Smad 信号通路中,在细胞内合成的配体成熟蛋白,以旁分泌/自分泌形式胞吐,再形成同源/异源二聚体,陆续激活BMPR Ⅱ型、Ⅰ型受体。活化的Ⅰ型受体将细胞质内R-SMADs 磷酸化,与Co-SMAD 即SMAD4 结合形成SMAD 蛋白异聚体复合物,进入细胞核与靶基因结合,发挥转录调控作用[6]。转导过程见图1。
1.1 Bmp/Smad 信号通路中的配体 Bmp/Smad 信号通路中的配体由许多结构高度保守且功能不同的分泌肽组成,截至目前发现的有BMP1(mTLD)、BMP2(BMP2A)、BMP3(Osteogenin)、BMP3B(GDF10)、BMP4(BMP2B)、BMP5、BMP6(Vgr1)、BMP7(OP1)、BMP8a(OP2)、BMP8b、BMP9、BMP10、BMP11(GDF11)、BMP12(GDF7,CDMP3)、BMP13(GDF6,CDMP2)、BMP14(GDF5,CDMP1)、BMP15(GDF9B)、BMP16、GDF3(Vgr2)、GDF15(PLAB,PDF) 以及MIS(AMH)等超过25 种成员,除了BMP1,其他成员均属于TGF-β 超家族[3](表1)。BMPs 具有广泛的生物学效应,在哺乳动物早期胚胎发育、细胞外基质的合成以及调控绵羊排卵数以及产羔数等方面发挥着重要作用[8-10]。
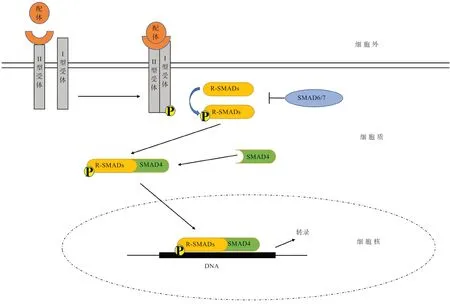
图1 Bmp/Smad 信号通路[7]
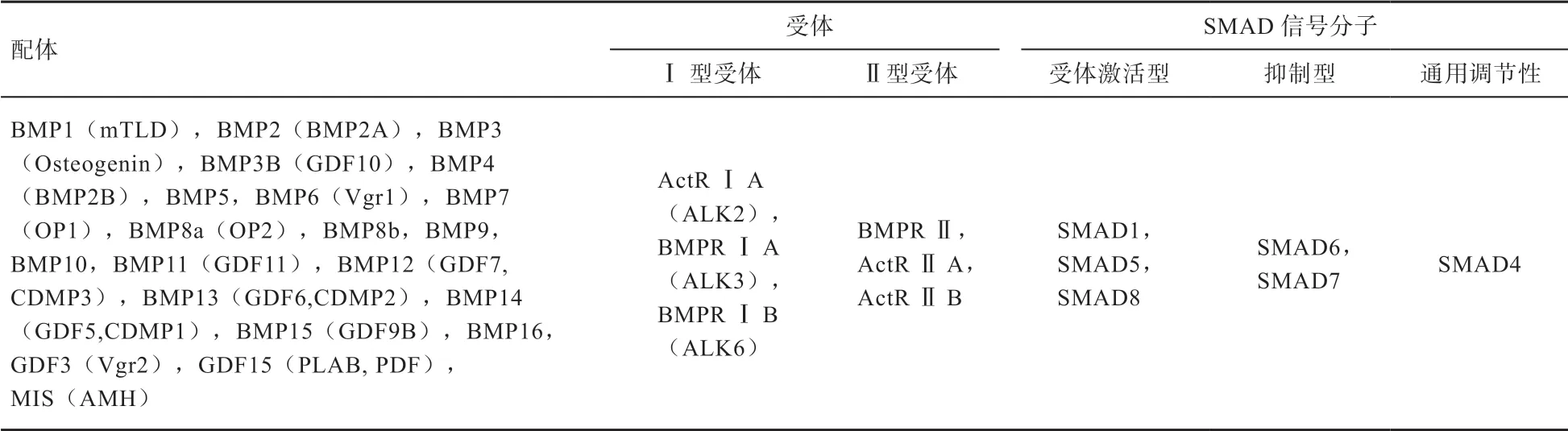
表1 Bmp/Smad 信号转导通路中的配体、受体以及SMAD 信号分子[11-14]
1.2 Bmp/Smad 信号通路中的受体 BMP 受体(Bone Morphogenetic Protein Receptor,BMPR)为膜蛋白受体,具有丝氨酸/苏氨酸蛋白激酶活性,属于TGF-β 超家族成员。截至目前为止共发现I 型和II 型2 种BMP 受体。I 型受体包括ActR I A(ALK2)、BMPR I A(ALK3)以及BMPR I B(ALK6),II 型受体包括BMPR II、ActR II A 以及ActR II B(表1)。I 型和II 型受体分别为55 ku 和70 ku 的糖蛋白,它们的胞外区域含有约150 个氨基酸,I 型受体具有独特的GS(富含甘氨酸和丝氨酸的序列)结构域,该结构域含有序列SGSGS,位于激酶结构域之前30 个氨基酸的细胞内区域。在Bmp/Smad 信号转导过程中,BMPs 特异性配体和II 型受体结合形成配体-II 型受体复合物,再与I 型受体结合形成异型低聚体复合物。这时I 型受体高度保守的N端富含丝氨酸/苏氨酸的激酶区被II 型受体的激酶作用发生磷酸化后被活化[15]。
1.3 Bmp/Smad 信号通路中的Smad 信号分子 在I 型受体活化后可捕获R-SMADs,使R-SMADs C 末端磷酸化,导致R-SMADs 被SMAD4 上袋状结构识别并进入细胞核与DNA 结合而识别目的基因发挥生物活性[16]。SMADs 蛋白在Bmp/Smad 信号通路起着重要衔接作用,由约500 个氨基酸残基组成[17]。1995年,在果蝇中首次发现BMP 同源物(dpp)的信号转导因子,Raftery 和Sekelsky 将它们分别命名为Mad和Medea[18-19]。1996 年,线虫II 型受体Daf-4 所识别的SMA/2/3/4 被Savage 等[20]克隆出来。由 于Mad、Sma 以及其他随后发现的具有独特的N 和C 端结构域同源物均为TGF-β 超家族信号转导所必需,所以SMA 和MAD 2 个单词被Derynck 等[21]结合命名为SMAD。迄今为止已发现9 种脊椎动物SMAD 蛋白,根据结构和功能特点分为3 类:①受体激活型SMAD蛋白(Receptor Activated Smads,R-SMADs),包括SMAD1/2/3/5/8/9,它们是I 型受体激酶的底物,具有通路特异性,其中SMAD1/5/8 受BMP I 型受体的激活;SMAD2/3 受TGF-β 和activin II 型受体的激活。②通用调节性SMAD 蛋白(Common Mediator Smad,Co-SMAD),它通过与R-SMADs 的结合形成异源复合物,随后移位入核参与信号传递,在哺乳动物中Co-SMAD只有1 种,即SMAD4[22]。③抑制型SMAD 蛋白(Inhibitory Smads,I-SMADs),包括SMAD6 和SMAD7。它们以不同方式抑制Smads 的信号传导功能[23]。
2 Bmp/Smad 信号通路配体、受体以及SMAD 信号分子的表达及其在卵巢发育中的作用
2.1 Bmp/Smad 信号通路中配体的表达以及在卵巢发育中的作用 自发现BMP 家族成员在卵巢细胞中表达以来,越来越多的研究证实了Bmp/Smad 信号通路在哺乳动物生殖活动中的重要性[24]。在绵羊卵巢中,Canty-Laird 等[10]利用免疫组化的方法对BMP1 进行定位,结果显示,BMP1 存在卵泡发育所有阶段的颗粒细胞中,并且调节细胞外基质(ECM)的形成。Erickson 等[25]在小鼠卵巢原发性、继发性以及窦状卵泡颗粒细胞中检测到了BMP2 mRNA 的表达。在人卵丘细胞中,Demiray等[26]检测到BMP2 mRNA 的表达,并认为BMP2 的表达可作为检测卵母细胞以及胚胎质量的指标。Ying等[27]研究认为,内胚层衍生物BMP2 和外胚层衍生物BMP4 协作可刺激小鼠原始生殖细胞(Primordial Germ Cells,PGCs)生成。
1999 年,Shimasaki 等[28]认为BMP4 是格拉夫卵泡发育中的黄体化抑制因子。研究表明,BMP4 为绵羊生殖所必需,具有调节动物卵泡的发育、促进颗粒细胞增殖、卵丘扩散以及促进卵母细胞成熟和排卵等功能[29]。Tan 等[9]研究发现,BMP4 可促进卵泡发育,在小鼠体内或者体外添加都可以促进初级卵泡转化为次级卵泡。又有研究表明,BMP4 基因可诱导增加颗粒细胞对促卵泡激素(FSH)敏感性,调控FSH 依赖的雌激素和孕酮合成[28]。本团队前期研究发现[30],小尾寒羊BMP4 基因外显子3 第305 位碱基发生C/A 突变,该突变的BB 型小尾寒羊平均产羔数比AB 型和AA 型多0.61 只,与小尾寒羊产羔数呈加性效应。在大鼠卵巢中,Pierrer 等[31]通过原位杂交方法对BMP5 的表达模式进行研究,发现BMP5 主要表达于小型至大型窦状卵泡的颗粒细胞以及卵丘细胞中,并且BMP5 对孕酮生成有明显的剂量依赖性抑制作用。BMP6 mRNA 在小鼠、绵羊、牛以及山羊卵母细胞中表达[25-32]。Lee 等[33]研究发现,BMP7 可促进原始卵泡的募集,并且BMP7 抑制孕酮的产生可能与排卵机制相关,另外BMP7 在小鼠体内或体外添加均有利于雌二醇增加[34]。BMP15 又称为GDF9B,已经被确定为影响绵羊产羔数的主效基因,其在绵羊、小鼠、人以及牛的卵子发生和卵泡发育过程中扮演着重要的角色[36-39]。研究表明,BMP15 对动物卵泡发育、卵巢颗粒细胞的增殖、卵丘的扩展、卵母细胞的成熟和排卵等方面均发挥着重要调控作用[29,38-40]。Zhai 等[41]在猪卵丘卵母细胞复合体体外实验中发现,添加BMP15 可抑制卵丘细胞凋亡。Muralidharan 等[42]在水牛卵丘卵母细胞复合体体外培养实验中发现,BMP15 的表达与卵丘细胞的扩散程度密切相关。但是BMP15 在不同物种中的表达模式可能存在差异,Passos 等[38]在牛腔前卵泡体外培养实验中发现,添加BMP15 可上调FSHR 的表达。但是Otsuka 等[43]在体外培养大鼠颗粒细胞实验中发现,BMP15 可降低FSH 对颗粒细胞的刺激作用,延长细胞黄体化时间。关于其具体的表达模式需要进一步的研究证实。
2.2 Bmp/Smad 信号通路中受体以及SMAD 信号分子的表达及其在卵巢发育中的作用 在信号转导过程中,BMPs 必须与配体相结合形成异型低聚体复合物,再与下游SMAD 信号分子结合才可发挥生物学效应。1982年,Davis 等在高繁殖力布鲁拉美利奴羊中发现,常染色体的某个基因突变后会导致母羊的高排卵数性状出现,该基因增加1 个拷贝突变将导致母羊排卵数增加1.65 个[44]。1989 年,绵羊和山羊遗传学命名委员会将调控布鲁拉美利奴羊排卵数性状的基因命名为FecB(Fecundity Booroola)基 因[45]。2001 年,FecB 基 因突变被定位在BMPR1B 基因上,并认为BMPR1B 基因编码区发生了A746G 的突变,从而导致蛋白质序列中的第249 位的谷氨酰胺被置换为精氨酸(Q249R)[46]。BMPR1B 为BMP 的I 型受体,其突变后增加了信号转导过程对下游受体的信号强度,导致卵泡早熟,排卵数增加[45]。已有研究表明,BMP I 型以及II 型受体在小鼠、牛以及绵羊卵母细胞和颗粒细胞中表达[46-48]。在人体颗粒细胞中亦可检测到BMPRIA、BMPRIB 以及BMPRII[49]。在山羊卵巢中,Costa 等[50]测得BMPRIB以及BMPR II 的mRNA 表达水平在0.2 mm 的卵泡中高于1.0 mm 的卵泡。
SMAD 蛋白是将BMPs 配体信号转导至细胞核的介导蛋白。Jessica 等[51]利用可识别磷酸化R-SMADs 的抗体监测其信号传导过程发现,R-SMADs 以高度保守的方式存在于所有物种的信号传递途径中。SMAD1/5/8 为Bmp/Smad 信号转导通路受体激活型蛋白,它们与活化的I 型受体结合,被磷酸化后与SMAD4 结合转运至细胞核,使BMPs 发挥转录调控作用。在PGCs 分化期间,磷酸化的SMAD1/5/8 蛋白被定位在从细胞核转移至细胞质的过程中。Okamura 等[52]在小鼠PGCs 体外培养实验中发现,SMAD1/5 为BMP4 内信号因子,刺激PGCs外胚层的发育,SMAD1 和SMAD5 的协同表达可刺激BMP4 在E5.25~5.5 时PGCs 外胚层的发育。Hayashi 等[53]研究发现,SMAD1 基因缺陷的小鼠在E10.5~11.5 时由于器官发育不全而死亡。又有研究表明,SMAD1 基因缺失的小鼠同样由于器官发育不全而死亡[8]。这说明二者对于PGCs 的发育过程中起到关键作用。SMAD4 作为哺乳动物唯一的通用调节型蛋白,是哺乳动物卵泡发育以及排卵所必需[54],同时SMAD4 可促进卵巢颗粒细胞成熟分化,通过调节FSH 以及促黄体生成素(LH)的水平对卵巢功能进行调控[55]。Sirard 等[56]研究发现,与所有BMP 受体基因敲除的小鼠一样SMAD4 基因缺失的小鼠内脏器官不能正常发育而死亡,这说明SMAD4 作为通用型蛋白在Bmp/Smad 信号转导过程中的重要性。作为抑制型SMAD 蛋白,SMAD6 和SMAD7 通过不同的方式阻止或者干扰信号通路信号的转导。在哺乳动物中,SMAD6 可特异阻断Bmp/Smad1 途径的信号转导,但是不干扰SMAD1 的磷酸化,从而与SMAD4 竞争结合受体激活的SMAD1,产生无活性的SMAD1-SMAD6复合物,从而阻止信号的传递[57]。而SMAD7 主要抑制TGF-β 信号传导。Nakao 等[58]在非洲爪蟾胚胎研究中发现,SMAD7 的转染可抑制SMAD2 和SMAD3 的磷酸化,从而阻断TGF-β 通路信号的转导。
3 总结与展望
BMPs 发现至今已有39 年历史,关于该家族成员的功能研究已有大量报道。无论是基因敲除、PGCs 体外培养、卵巢颗粒细胞的培养实验,均表明BMPs 以及Bmp/Smad 信号通路在哺乳动物PGCs 的形成、卵巢颗粒细胞的增殖、卵母细胞的发育和成熟以及生殖激素的合成和分泌等方面均发挥着重要作用。
世界养羊业共同追求的高繁殖力目标是羊的多羔性状。在绵羊上进行高繁殖力影响因素的研究具有十分重要的意义,而Bmp/Smad 信号通路显著影响哺乳动物的繁殖性能,但这些基因的作用机理等方面研究还不够深入。相信随着现代生物技术的不断进步,在Bmp/Smad信号通路中会发现更多影响绵羊多羔性状的主效基因和候选基因,并对它们加以利用,以更好地促进养羊业发展。
