Ubc13对胶原诱导性关节炎小鼠体内Treg/Th17平衡的影响研究①
2019-08-12任路路范阔海姜俊兵
任路路 韩 蓉 郭 音 范阔海 姜俊兵
(山西农业大学动物科技学院,太谷030801)
类风湿性关节炎(Rheumatoid arthritis,RA)是一种全身性自身免疫疾病,其特征是进行性的关节软骨破坏和骨吸收,造成关节畸形[1]。RA发病原因目前尚不完全清楚,有研究发现RA患者体内T细胞稳态破坏,CD4+CD25+调节性T细胞(CD4+CD25+regulatory T cells,Treg)细胞数目下降[2],而辅助性T细胞17(T helper cell 17,Th17)细胞数目上升[3]。类风湿性关节炎患者体内的Treg细胞和Th17细胞的失衡可能是RA治疗的潜在靶点之一[4,5]。Treg细胞通过细胞-细胞接触和分泌多种细胞因子如白介素10(Interleukin-10,IL-10)和转化生长因子β(Transforming growth factor-β,TGF-β)抑制自身反应性淋巴细胞,预防自身免疫性疾病的发生[6],Treg细胞中特异性的转录因子是Foxp3,起控制Treg细胞的生长发育与免疫活性的作用[7],Treg细胞数量减少或者Foxp3表达降低均引发自身免疫性疾病[8]。Treg细胞调控Th17细胞的分化及表型的维持,但类风湿性关节炎患者中Treg细胞与Th17细胞的平衡被破坏,导致Th17细胞过度活化[9]。Th17细胞是自身免疫性疾病中重要的致病性细胞,抑制Th17细胞的分化或IL-17的产生能显著缓解多种自身免疫性疾病[10]。RORγt是Th17细胞的关键转录因子,与白介素23(IL-23)共同作用调控Th17细胞的分化与IL-17的分泌能力[11,12]。在CIA小鼠关节滑膜中,Th17细胞诱导成骨细胞表达核因子κB受体活化因子配体(Receptor activator of nuclear factor-κ B ligand,RANKL)表达,产生破骨细胞导致软骨腐蚀[13]。
胶原诱导性关节炎动物模型是广泛使用的类风湿性关节炎模型。研究证实,外周T细胞对自身胶原的识别导致T细胞稳态被破坏是CIA小鼠发病的主要原因[14],其中Treg细胞与Th17细胞的平衡被破坏,部分Treg细胞在长期炎症条件下获得Th17细胞表型,相比Th17细胞对关节滑膜造成更严重的损伤[15]。
泛素结合酶2N(Ubiquitin-conjugating enzyme E2 N,Ubc13)通过T细胞受体(TCR)通路调节外周T细胞增殖与活化能力,维持T细胞稳态[16,17]。研究证实在CIA小鼠中Ubc13能维持Treg细胞免疫抑制活性,抑制其获得Th17细胞表型[18]。由此预示Ubc13蛋白对维持CIA小鼠中Treg细胞免疫抑制功能,IL-17、IL-23和RORc等基因的表达,恢复Treg/Th17细胞的平衡,起到一定的治疗效果。
本试验通过CIA小鼠注射鼠源Ubc13重组蛋白研究Ubc13对CIA小鼠体内Treg细胞和Th17细胞数目的影响,以期了解Ubc13对CIA小鼠Treg细胞和Th17细胞平衡的作用。
1 材料与方法
1.1 材料 重组蛋白Ubc13由山西农业大学临床兽医学试验室提供[19];牛Ⅱ型胶原与完全弗氏佐剂(CFA)购自chondrex公司;反转录试剂盒购自TaKaRa公司;Trizol试剂购自Invitrogen公司;2×SYBR Green qPCR Master MIX购自Bimake公司;FITC anti-mouse-CD4 Antibody、PE anti-mouse CD25 Antibody、PE/Cy7 anti-mouse IL-17A Antibody、购自Biolegend公司;Foxp3 Monoclonal Antibody、细胞刺激剂(含蛋白转运抑制剂)、Foxp3转录因子染色套装、胞内因子染色套装购自Bioscience公司;SPF级DBA/1雄性小鼠购自北京维通利华实验动物技术公司。
1.2 方法
1.2.1 CIA小鼠模型的建立 将40只6周龄DBA/1雄性小鼠,随机分为5组,分别为Ubc13低剂量组、Ubc13中剂量组、Ubc13高剂量组、模型组和空白组。所有小鼠自由进食饮水,适应性喂养1周。将牛Ⅱ型胶原和不完全弗氏佐剂等体积混合,乳化后免疫小鼠,分别对Ubc13低剂量组、Ubc13中剂量组、Ubc13高剂量组和模型组小鼠经尾根部皮下多点注射,100 μl/只;空白组小鼠经尾根部皮下多点注射等量生理盐水。注射21 d后加强免疫。第2次免疫后,Ubc13低剂量组、Ubc13中剂量组和Ubc13高剂量组分别通过皮下注射Ubc13重组蛋白100 μl/只,Ubc13重组蛋白含量分别为(5 μg、25 μg、50 μg),每天注射1次,连续注射21 d;空白组每天注射一次等体积生理盐水,连续注射21 d;模型组不做任何处理。第2次免疫后,观察小鼠RA发病情况,每周2次记录关节炎评分,连续观察8周后,解剖小鼠。
1.2.2 关节炎评分 关节炎指数评定依据小鼠四肢红肿的程度和范围,0分为无红斑和肿大;1分为踝关节轻微的红肿;2分为整个足爪轻微的红肿;3分为整个足爪中度红肿;4分为整个足爪重度红肿。四肢单独计分,关节炎评分为四肢分数的总和。
1.2.3 关节滑膜组织HE染色 将小鼠双侧后肢自膝关节以上约1 cm处截断,去除皮肤和肌肉,于Bouin′s固定液中固定24 h,后置于pH7.4 13% EDTA在45℃水浴锅中脱钙7 d,每天更换EDTA脱钙液一次。石蜡切片经HE染色,干燥后中性树胶封片,光学显微镜下观察关节滑膜组织形态结构。
1.2.4 脾淋巴细胞分离与刺激 解剖小鼠,无菌取出脾脏,留一小部分冻存,其余部分于超净台中用剪刀剪碎,于200目筛上研磨,收集滤下的细胞,红细胞裂解液处理,收集淋巴细胞,用1 ml含5%血清1640培养基培养3 h,除未刺激对照组外,每孔加入2 μl 淋巴细胞刺激剂和转运抑制剂培养8 h,血细胞计数板计数后,收集1×106个淋巴细胞。
1.2.5 Treg/Th17细胞流式细胞术检测 在100 μl细胞悬液中加入相应的荧光标记抗体(FITC-CD4、PE-CD25),混匀,室温避光孵育20 min;加入2 ml细胞缓冲液混匀,500 g离心5 min,重复1次。
胞外染色后,于样品中加入1 ml细胞固定液,混匀,室温下避光固定15 min。固定液洗涤1次。加入2 ml破膜buffer,500 g,离心5 min,重复1次。用100 μl破膜缓冲液,轻柔混匀。加入荧光标记抗体(PE/cy7-IL-17a、APC-Foxp3),室温避光孵育30 min。加入2 ml染色buffer,500 g离心5 min,弃上清,重复1次。加入1 ml染色buffer,轻柔混匀,流式细胞仪(BD Accuri C6 plus)检测分析。
1.2.6 实时荧光定量检测RORc、IL-17、Foxp3和IL-23 mRNA表达 取冻存小鼠脾脏组织研磨,按照Invitrogen Trizol试剂说明书提取脾脏总RNA,用ND-1000(NanDrop Technologies)测定其浓度,凝胶电泳检测其完整性。使用TaKaRa公司反转录试剂盒进行cDNA合成。采用NCBI工具进行特异性引物设计,交由擎科生物公司合成,引物序列见表1。RORγt由RORc编码,RORc、IL-17、IL-23的表达水平表示Th17细胞活化程度,Foxp3表达水平表示Treg细胞活化程度。
使用bimake公司SYBR Green qPCR Mix进行荧光定量PCR。反应体系为:2×SYBR Green PCR Master Mix 10 μl,上游引物1 μl,下游引物1 μl,cDNA ≤100 ng,加水至20 μl。反应条件:95℃预变性5 min;95℃ 10 s,60℃ 10 s,72℃ 20 s,40个循环,72℃ 2 min。GAPDH 作为内参基因,与待检测样品共同扩增,每个样品重复3 次。根据扩增曲线的CT值计算定量结果。通过2-ΔΔCT计算RORc、IL-17、Foxp3和IL-23在对照组和实验组脾脏中的相对表达水平。GAPDH作为内参基因,与RORc、IL-17、Foxp3和IL-23共同扩增,每个样品重复3次。
2 结果
2.1 小鼠CIA模型的鉴定与治疗效果评价 模型组小鼠在第3天左右后足出现红肿,在第7天出现前足红肿,关节炎评分在14~25 d出现高峰,且其病症在模型建立56 d后未见显著减轻。模型组小鼠肿胀关节不能承重,关节活动障碍,皮毛杂乱,提示小鼠CIA模型建立成功。Ubc13处理的各组小鼠关节红肿出现时间与模型组接近。高剂量组关节炎病情在第0~33天内较模型组轻微,但Ubc13低剂量组和中剂量组关节炎评分较模型组无明显差异(P>0.05)。见图1。
表1 本试验所用引物序列
Tab.1 Primer sequences used in experiment
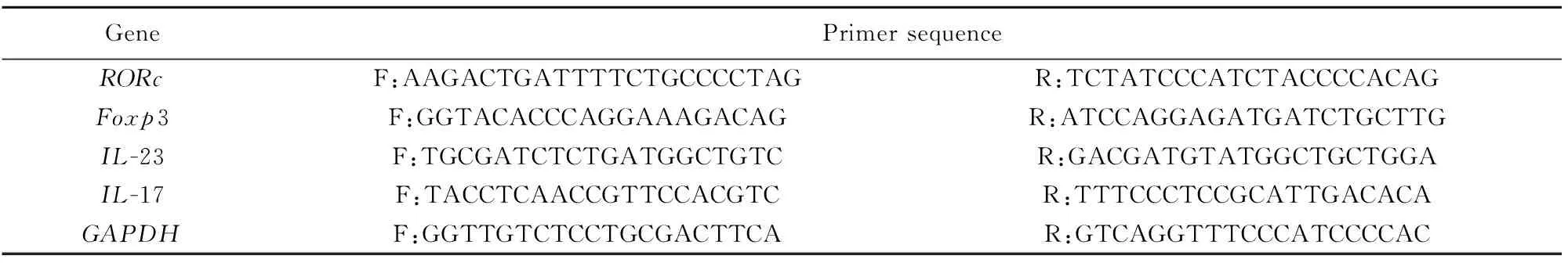
GenePrimer sequenceRORcF:AAGACTGATTTTCTGCCCCTAGR:TCTATCCCATCTACCCCACAGFoxp3F:GGTACACCCAGGAAAGACAGR:ATCCAGGAGATGATCTGCTTGIL-23F:TGCGATCTCTGATGGCTGTCR:GACGATGTATGGCTGCTGGAIL-17F:TACCTCAACCGTTCCACGTCR:TTTCCCTCCGCATTGACACAGAPDHF:GGTTGTCTCCTGCGACTTCAR:GTCAGGTTTCCCATCCCCAC
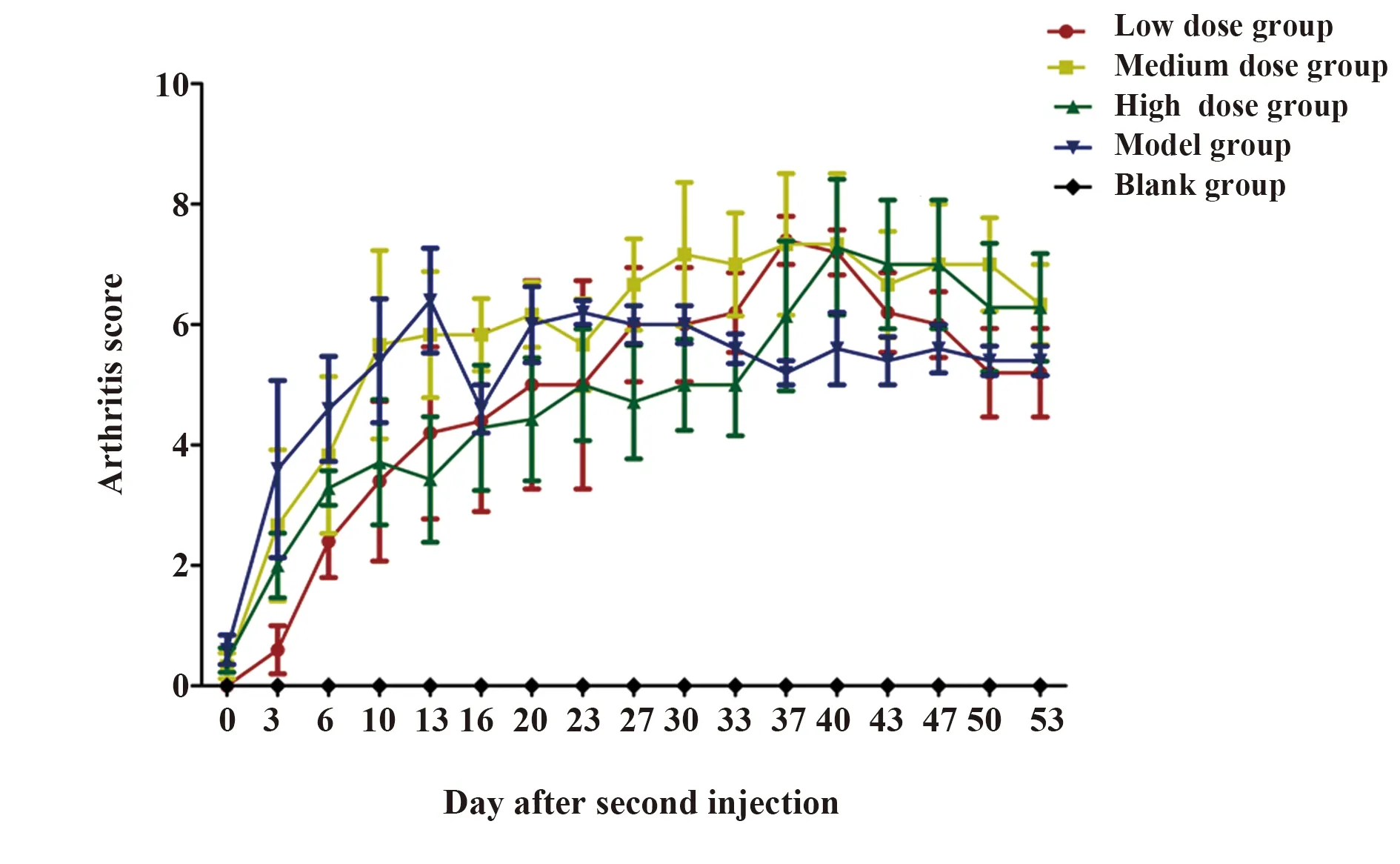
图1 CIA小鼠关节炎评分表(n=8)Fig.1 CIA mice arthritis score(n=8)Note: Observe the state of the mouse every day,record arthritis score twice a week after second inject collagen,Date are presented as
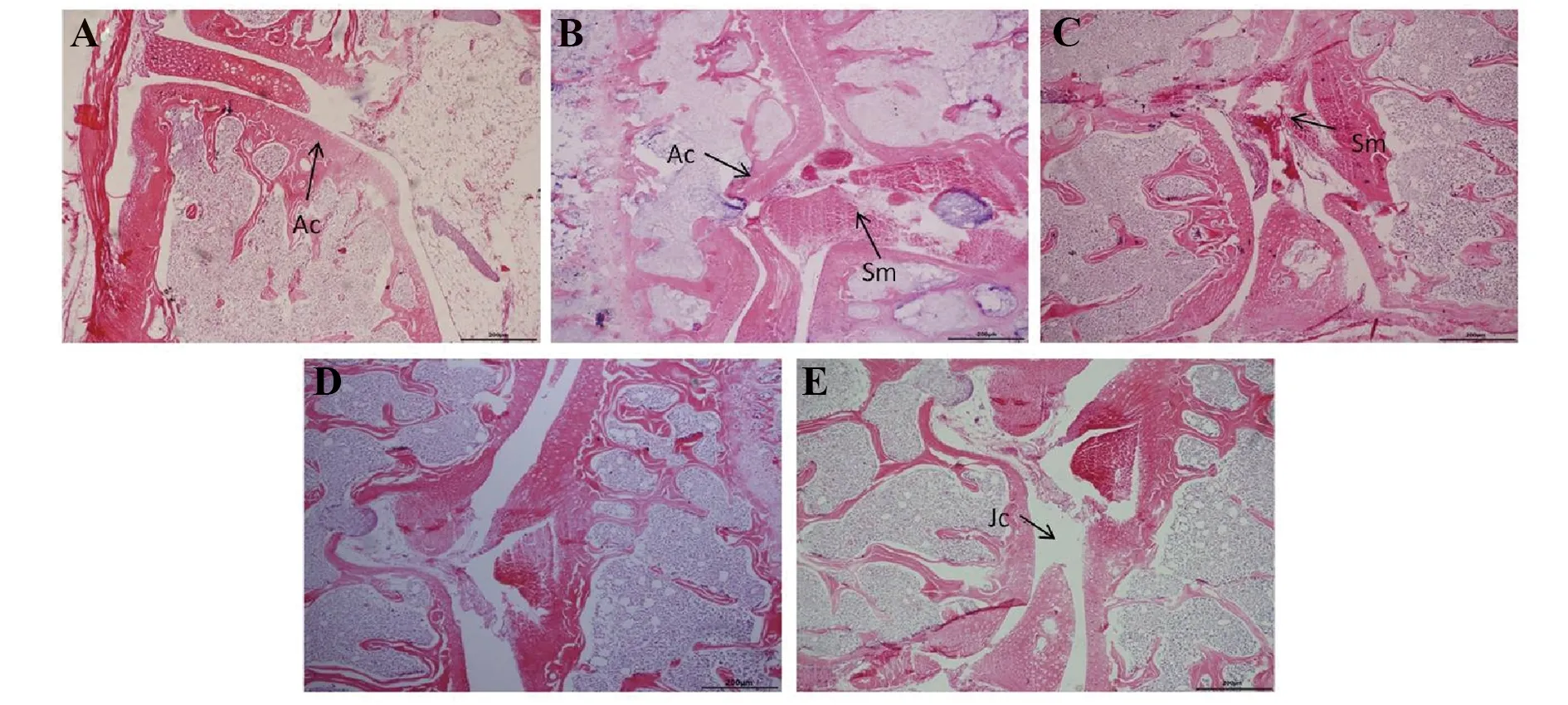
图2 模型组小鼠与Ubc13处理各组小鼠关节HE染色Fig.2 HE staining of mouse joint in model and Ubc13 treatment miceNote: The hind paw from CIA model and Ubc13 treatment mice were decalcificated,then stain by HE.A.Joint section from the control group mice;B.Joint section from the models group mice;C.Low does Ubc13;D.Medium dose;E.High dose mice joint section;Ac.Articular cartilage;Sm.Synovial membrane;Jc.Joint cavity.

图3 流式细胞术分析脾脏中Treg/Th17细胞的比率 Fig.3 Flow cytometry analysis of Treg cell ratio and Th17 cell ratio in model and Ubc13 treated mice spleensNote: A.FACS plot shows Th17 cells(as reported by CD4-FITC,IL-17A-PE/cy7) among CD4+T cells(CD4+determined by cell surface staining for CD4 protein);B.Bar graph shows the average percentage of Th17 cells among CD4+Tcell in spleen;C.FACS plot shows Treg cells(as reported by CD25-PE,Foxp3-APC) among CD4+T cells(CD4+determined by cell surface staining for CD4 protein);D.Bar graph shows the average percentage of Treg cells among CD4+T cell in spleen.For all graphs,date are presented as
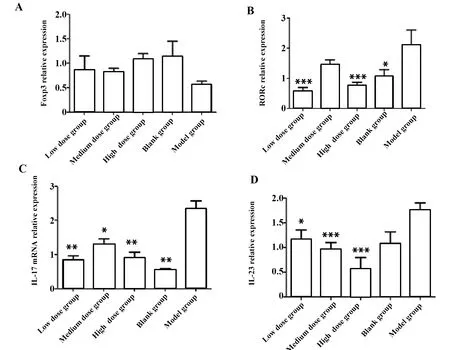
图4 实时荧光定量分析对照组与Ubc13处理组脾脏中RORc、IL-23、IL-17、Foxp3 mRNA的表达量Fig.4 qRT-PCR analysis of expression of RORc,IL-23,IL-17,Foxp3 mRNA in spleens samples collected from control and Ubc13 treatment micesNote: By the real-time PCR amplification plots and melt cruve analysis and judgement,the CT values calculated by analyzed through 2-ΔΔCT.A.The mRNA levels of Foxp3 in CIA model and Ubc13 treatment mices;B.The mRNA levels of RORc in CIA model and Ubc13 treatment mices;C.The mRNA levels of IL-17 in CIA model and Ubc13 treatment mices;D.The mRNA levels of IL-23 in CIA model and Ubc13 treatment mices.Date are presented as (n=8),*.P<0.05,**.P<0.01,***.P<0.001.
2.2 CIA小鼠膝关节组织病理学检查 HE染色结果显示,正常组小鼠关节软骨边缘光滑完整,未见淋巴细胞浸润与软骨缺失;模型组小鼠关节炎滑膜组织重度增生,滑膜层变厚,淋巴细胞浸润,软骨重度缺失;Ubc13处理的各组HE染色显示滑膜增生及淋巴细胞浸润、软骨丢失等较模型组轻。见图2。
2.3 脾脏中Treg细胞和Th17细胞比率 流式细胞术结果显示,与模型组相比,Ubc13各剂量组均能显著提高Th细胞中Treg细胞的比率(P<0.01),且高剂量组能极显著增加Treg的数目(P<0.001)。与模型组相比,Ubc13处理的各组Th17细胞数目无显著差异,高剂量组Th17细胞比率有下降趋势(P>0.05)。见图3。
2.4 Foxp3、RORc、IL-17、IL-23 mRNA表达水平 Foxp3表达表示Treg细胞分化水平,RORc、IL-17、IL-23表达表示Th17细胞活化水平。实时荧光定量结果显示,Ubc13处理组Foxp3表达量与模型与空白之间无显著差异(P>0.05),高剂量组有升高趋势。Ubc13处理组各组RORc表达量均低于模型组,其中高剂量组与低剂量组表达量极显著低于模型组(P<0.001);Ubc13处理组各组IL-17表达量均低于模型组,其中低剂量和高剂量极显著低于模型组(P<0.01);Ubc13处理组各组IL-23表达量均低于模型组(P<0.05),其中中剂量组与高剂量组mRNA表达量极显著低于模型组(P<0.001)。见图4。
3 讨论
Treg细胞和Th17细胞的平衡对维持免疫的稳态有重要作用,在CIA小鼠中,部分Treg细胞失去免疫抑制活性,T细胞稳态被破坏,造成多关节炎症。小鼠膝关节HE染色结果显示,小鼠关节在造模后56 d关节病理变化明显,与郭明等[20]的结果一致,提示CIA模型成功建立。与模型组相比,Ubc13处理组小鼠关节病症有一定程度的减轻,提示Ubc13对CIA小鼠关节有保护作用。
Treg细胞以来源不同分为胸腺来源的自然Treg细胞(nTreg)和外周来源的诱导型Treg细胞(iTreg)[21],研究证实Ubc13影响CIA小鼠体内外周T细胞的免疫抑制活性,而对胸腺来源T细胞无显著影响[17],因此本试验检测脾脏中Treg细胞数目。本研究中Ubc13处理的各组小鼠脾脏中Treg细胞比率显著上升,提示Ubc13对CIA小鼠体内Treg细胞免疫抑制活性有一定的恢复作用,与Chang等[16]的研究结果一致。与模型组相比,空白组Th17细胞比率无显著差异,提示Ubc13对IL-17蛋白水平表达无显著影响。
实时荧光定量PCR结果显示,CIA模型小鼠脾脏中IL-17、IL-23和RORc的表达显著上升,提示模型组小鼠脾脏中Th17细胞的过度活化。与对照组相比Ubc13处理的各组中IL-17、IL-23和RORc的表达显著降低。与模型组相比,Ubc13处理组RORc、IL-23和IL-17表达量显著降低,提示Ubc13通过降低RORc和IL-23的表达抑制Th17细胞的分化与IL-17的产生。
本研究中关节炎评分结果显示,模型组关节炎在二次免疫后开始发展,在第10天开始达到高峰,病症维持到二次免疫后56 d未见明显减轻。Ubc13处理的低剂量组与中剂量组关节炎评分与模型组无显著差异,Ubc13高剂量组小鼠关节炎评分与模型组相比有下降趋势,提示Ubc13对CIA有一定治疗作用,但效果不显著。
综上所述,Ubc13处理可导致CIA小鼠体内Treg细胞数目升高,抑制RORc、IL-23和IL-17的表达,减轻小鼠关节炎病症,为利用免疫细胞治疗类风湿性关节炎提供了一定的参考。
