利用NCI-H1975细胞筛选对奥西替尼耐药的铁氧还蛋白1基因及其功能鉴定
2019-08-12彭培佩李山虎王建刚
陈 晨*,彭培佩*,王 健,黄 芳,王 芃,李山虎,王建刚
(1.河南科技大学医学院药理学与分子生物学实验室,河南洛阳471023;2.军事科学院军事医学研究院生物工程研究所,北京100850;3.广东药科大学生命科学与生物制药学院,广东省生物技术候选药物研究重点实验室,广东 广州510006)
2018年,全球约有1810万新发癌症病例,其中肺癌占11.6%,是癌症中诊断率最高的病种[1]。而非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总数的80%~85%,是全球致死率最高的肿瘤[2]。在NSCLC治疗中,肺腺癌占总数50%以上,是最常见的组织亚型。导致肺腺癌发生的相关驱动基因包括表皮生长因子受体(epidermal growth factor receptor,EGFR),Kirsten大鼠肉瘤病毒致癌基因(kirsten rat sarcoma viral oncogene,KRAS)、人EGFR2(HER2)、磷脂酰肌醇-4,5-二磷酸3-酪氨酸α 催化亚基、B-Raf 原癌基因和Met 原癌基因(Met proto-oncogene,MET)基因突变及间变性淋巴癌激酶,ROS 原癌基因1 和RET 原癌基因重排[3]。EGFR 又称Her1 或者ErbB1,是ErbB 受体家族4大成员之一。EGFR 过度表达能激活下游重要的信号通路,从而导致细胞增殖、存活、转移和血管生成等[4]。在NSCLC 的研究中,EGFR 一直是一个热点。
对于NSCLC 治疗,一个重要的里程碑进展就是发现EGFR 激活突变是一种有效的治疗靶点,进而研发出具有显著抗肿瘤活性的一系列EGFR 酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitor,EGFR-TKI)。目前为止,已经开发出了3代EGFRTKI 药物,然而大多数接受EGFR-TKI 治疗的患者经常在1~2 年内产生耐药性[5-8]。EGFR-TKI 耐药最常见的机制之一是EGFR发生T790M突变,该突变约占获得性耐药患者比例的50%~60%[9-10]。第三代EGFR-TKI奥西替尼(osimertinib)克服了由于T790M 突变而产生的耐药,临床反应有效率为59%~71%[11-14]。但是随着时间的推移,患者对奥西替尼也不可避免地产生耐药性。有文献指出,EGFR 外显子20 中的新的C797S 氨基酸突变,是T790M 阳性患者中对奥西替尼耐药的潜在机制[15]。除了C797 位突变,L798I 突变[16-17],KRAS或者丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MEK)突变激活的丝裂原活 化 蛋 白 激 酶 激 活 通 路[18],或 通 过MET 或ERBB2[17,19-21]进行的旁路激活,都是已报道的第三代EGFR-TKI 耐药机制。尽管如此,目前为止人们对奥西替尼获得性耐药机制的了解并不完全。本研究主要是利用CRISPR-Cas9全基因组文库和人非小细胞肺癌NCI-H1975 细胞筛选对奥西替尼耐药基因及其分子作用机制。
1 材料与方法
1.1 细胞、药物、试剂和主要仪器
感受态细胞大肠杆菌DH5α 和DH10b 为本实验室保存,人NCI-H1975细胞购自中国医学科学院基础医学研究所细胞资源中心;奥西替尼购于美国Selleck 公司;Genome-scale CRISPR Knock-Out v2.0 pooled libraries(GeCKOv2 libraries)购于美国Addgene 公司;细胞染色体DNA 提取试剂盒购自美国Bimake 公司;pBM23 Toposmart 克隆试剂盒购于北京博迈德生物公司;山羊抗人微管蛋白多克隆抗体购自美国Santa Cruz 公司;兔抗人磷酸化EGFR(phosphorylation of EGFR,p-EGFR)、EGFR和FDX1的多克隆抗体购于英国Abcam公司;兔抗人细胞外信号调节激酶的磷酸化抗体(phosphorylation of extracellular regulated protein kinases,p-ERK),总聚(ADP-核糖)聚合酶全蛋白〔total-poly(ADP-ribose)polymerase,T-PARP〕多克隆抗体购自美国Cell Signaling 公司;山羊抗兔和兔抗山羊IgG二抗购于北京中杉金桥生物公司;RPMI 1640,DMEM 高糖培养基和胰蛋白酶购于美国Gibco 公司;二甲亚砜(DMSO)购于美国Sigma 公司;胎牛血清购于杭州四季青公司;青霉素和链霉素购于华北制药有限公司;嘌呤霉素购于美国HyClone 公司;蛋白酶抑制剂和结晶紫购于美国Amresco 公司;Lipofectamine 3000 转染试剂盒、BCA 蛋白定量试剂盒、CO2恒温培养箱和MULTISKAN FC酶标仪均购自美国Thermo 公司;ECL 发光液购于北京天跟生化科技有限公司;Cell Counting Kit8(CCK8)试剂盒购于东仁化学科技有限公司;5417R低温高速离心机及5418 台式常温离心机购于德国Eppendorf 公司;电泳槽和湿转膜仪购于美国Biorad公司。
1.2 GeCKO v2 libraries扩增及慢病毒包装
根据GeCKO v2 libraries 说明书,分别取A、B文库各1 μL,使用电击转化法转化大肠杆菌DH5α感受态细菌,转化产物涂氨苄平板,37℃温箱培养14 h,将A和B库两种转化子分别刮下收集,按质粒提取试剂盒(美国Axygen 公司)说明书提取质粒,并测定浓度,保存在-20℃。文库扩增后,根据Lipo3000 试剂盒说明书操作,在HEK293T 细胞中进行病毒包装,并测定病毒滴度。
1.3 Genome-scale CRISPR 文库筛选奥西替尼耐药基因
用GeCKO v2 libraries 来进行全基因组的筛选。NCI-H1975 细胞感染含有全基因组小导向RNA(sgRNA)序列的GeCKO v2 libraries 慢 病毒。控制细胞感染慢病毒感染复数(multipilicity of infection,MOI)≤0.3,以期确保大部分细胞中每个细胞只能感染1个sgRNA;为保证感染效率,初始病毒感染细胞数≥3.3×108。因此,使用90个175 cm2培养瓶,每瓶接种NCI-H1975细胞数为4.0×106,共接种细胞3.6×108,用嘌呤霉素抗性筛选后算出MOI=0.255,满足MOI≤0.3的实验要求。
将嘌呤霉素筛选后的细胞分成3 组,分别为第0天(d 0)细胞组(即为进行奥西替尼筛选当天收集的1/3细胞)、奥西替尼4 nmol·L-1组和细胞对照组,每组细胞数6×107。奥西替尼开始筛选的当天即将d 0 细胞样品冻存收集,同时当奥西替尼4 nmol·L-1组和细胞对照组细胞增殖至大致1.2×108时进行传代,2组细胞分别筛选10代,以确保潜在目的基因的稳定富集。筛选结束后,收集3 组细胞并送上海寻百会生物科技有限公司进行高通量测序和生物信息学分析,分析富集的sgRNA及对应的基因。
1.4 候选耐药基因铁氧还蛋白1(ferredoxin 1,FDX1)敲除质粒构建和细胞系建立
利用CRISPR.V2 载体建立敲除FDX1 基因的慢病毒表达载体,靶向FDX1 的sgRNA 序列,F:CACCGATCCAGCGCGGGACCCAGCG,R:AAACCGCTGGGTCCCGCGCTGGATC;靶向腺相关病毒结合位点1(adeno-associated virus integration site1,AAVS1)基因sgRNA 序列(对照组),F:CACCGGGGGCCACTAGGGACAGGAT,R:AAACATCCTGTCCCTAGTGGCCCCC。引物由北京博迈德生物工程公司合成,4℃保存。使用CRISPR.V2载体按胶回收试剂盒(Axygen公司)说明书进行酶切回收载体片段,将设计的sgRNA 进行退火,将载体片段和退火片段通过T4 连接酶连接后转化大肠杆菌DH10b,涂氨苄平板,挑单克隆菌落,摇菌提取质粒,并测定浓度,-20℃保存。送北京博迈德生物工程公司进行测序。
为了获得慢病毒,将293T细胞接种于100 mm细胞培养皿,24 h 后,分别用靶向FDX1 或AAVS1的sgRNA 质粒和产生慢病毒颗粒的包装质粒psPAX2以及包膜质粒pMD2.G按照4∶3∶1用量共转染细胞,12 h 后换成8 mL 新鲜培养液并分别在24 和48 h 后收取病毒液,将2 次病毒液混合后用0.45 微米孔径滤器过滤,分装,留部分于4℃保存待感染目的细胞,其余放在-80℃保存。
将NCI-H1975 细胞接种在100 mm 细胞培养皿中,密度40%~50%。第2天,将4 mL DMEM完全培养液与聚凝胺6~8 g·L-1和4 mL 病毒液混合后替换老的培养液,12 h后换为新鲜DMEM完全培养基,2 d 后,细胞密度达到80%~90%时,加入嘌呤霉素1.5 g·L-1筛选72 h。建立sg-FDX1 和sg-AAVS1细胞系。
1.5 细胞染色体DNA提取和测序
按照细胞染色体DNA提取试剂盒的要求,首先将sg-FDX1 细胞接种在30 mm 小皿中,生长密度为80%~90%时吸去培养液,PBS 洗2遍。收取细胞,加入100 μL消化液,充分重悬,55℃水浴30 min;然后在95℃水浴5 min 灭活蛋白酶。DNA 直接进行PCR 扩增,取大约2 μL 扩增产物(50 ng),1 μL T 载体pBM23 和1 μL 10×Toposmart,加离子水补充到10 μL反应体系后在室温下连接5~15 min,然后将5 μL连接产物加入到50 μL DH5α感受态细胞中,冰浴30 min;然后于42℃热激45 s,冰浴2 min,加入500 μL 无抗性LB培养液后,再置37℃摇床中,165 rpm培养1 h;取200 μL菌液均匀涂抹于氨苄抗性LB平板上,置37℃恒温培养箱中。12 h后挑取单克隆菌落,摇菌12 h 送检测序。PCR 扩增引物:FDX1-F:TGGAGTCTCTCGCGGCCTCA,FDX1-R:GCACTGGAACCAGAGACTC。
1.6 Western 印迹法检测sg-FDX1 和sg-AAVS1细胞中的FDX1,c-PARP蛋白水平及EGFR和ERK磷酸化水平
将敲除FDX1 和AVVS1 表达的NCI-H1975 细胞分别接种在2 个培养皿中,贴壁后收取细胞Western 印迹法检测敲除效果。将sg-FDX1 和sg-AVVS1 细胞各接种在4 个培养皿中,分别加入奥西替尼0,30,50 和100 nmol·L-1处理30 h 后收取细胞;用含蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液裂解细胞,利用BCA 比色法在酶标仪570 nm 处检测吸光度(A570nm)值,测定标准曲线得出蛋白样品的浓度。向蛋白样品中加入5×SDS 加样缓冲液并煮沸10 min,对蛋白进行预变性处理。以10%SDS-PAGE聚丙烯酰胺凝胶电泳分离蛋白样品后,在湿转装置中以200 mA 进行恒流转膜2.5 h,在5%脱脂奶粉中封闭约30 min。使用5%脱脂奶粉稀释一抗(1∶1000),在4℃的摇床上孵育过夜。用TBST洗膜3次后加入二抗(1∶5000)室温孵育1 h,之后用TBST 洗膜3 次,每次5 min,以ECL法显影及定影。胶片经扫描后用Image J进行积分吸光度分析。以目标蛋白和内参蛋白的积分吸光度的比值表示蛋白相对表达水平。
1.7 CCK-8法检测细胞存活
将处于对数生长期的细胞消化后,按每孔3000 个细胞接种到96 孔板中,每组3 个孔,置于CO2培养箱24 h 后,各孔单独加入奥西替尼0,12,20,30 nmol·L-1处理72 h,或用奥西替尼30 nmol·L-1处理细胞3,5 和7 d 后,去除原孔内的培养液后每孔加入100 μL稀释后的CCK8工作液(按CCK8原液与培养液1∶9 的比例配制)继续孵育2 h,利用酶标仪在450 nm处检测吸光度(A450nm)值,细胞相对存活率(%)=(加药组A450nm-空白组A450nm)/(正常对照组A450nm-空白组A450nm)×100%。实验重复3次。
1.8 平板克隆形成实验检测细胞增殖
当克隆生长到约有10个细胞时,加入奥西替尼12 nmol·L-1,10 d后去除原培养液,加入PBS 洗涤3次,甲醇固定细胞约30 min后,加入结晶紫染液染色30 min,用流水缓慢清洗孔内剩余染料后放置于室内风干。显微镜下计数≥10 个细胞的克隆数。实验重复3次取平均值。
1.9 统计学分析
2 结果
2.1 CRISPR-Cas9文库筛选NCI-H1975细胞中奥西替尼耐药基因FDX1
图1 是通过CRISPR-Cas9 文库在NCI-H1975细胞中筛选对奥西替尼发挥耐药作用的FDX1基因的流程。本研究采用GeCKO v2 libraries 慢病毒文库感染NCI-H1975细胞,经嘌呤霉素筛选后建立起全基因组敲除的NCI-H1975细胞系。将该细胞系分成3组,分别命名为第0天组(d 0),奥西替尼4 nmol·L-1处理组和细胞对照组,将奥西替尼4 nmol·L-1组和细胞对照组分别培养筛选10代后,将3组细胞提取全基因组DNA 并且PCR 扩增进行sgDNA 高通量测序和生物信息学分析,发现其中一种sgRNA 富集,所对应的基因为FDX1。
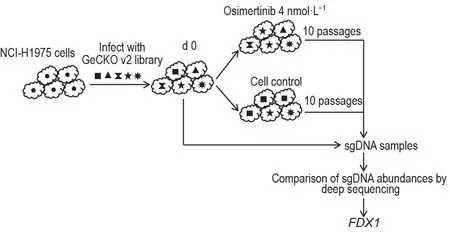
Fig.1 Genome-wide CRISPR screens identified ferredoxin 1(FDX1)as potential osimertinib resistance gene on NCI-H1975 cells.
2.2 建立的敲除FDX1的NCI-H1975细胞
提取敲除FDX1 的NCI-H1975 细胞(sg-FDX1细胞)的基因组DNA,经PCR 扩增sgRNA 靶点两端的片段并连接T 载体后,送公司测序发现在靶点位置造成了301 bp 的大片段缺失突变(图2A)。Western 印迹结果(图2B)显示,sg-FDX1 细胞中FDX1 蛋白的表达水平显著降低(P<0.01),表明成功构建敲除FDX1基因细胞sg-FDX1细胞。
2.3 奥西替尼对sg-FDX1细胞凋亡的作用
Western 印迹结果(图3)显示,奥西替尼50 nmol·L-1处理30 h 后,sg-AAVS1 细胞活化的PARP 显著升高(P<0.01),sg-FDX1 细胞活化的PARP无明显变化。说明敲除FDX1减弱了奥西替尼对细胞凋亡的作用。
2.4 奥西替尼对sg-FDX1 细胞FDX 蛋白表达及EGFR和EGFR蛋白磷酸化的影响
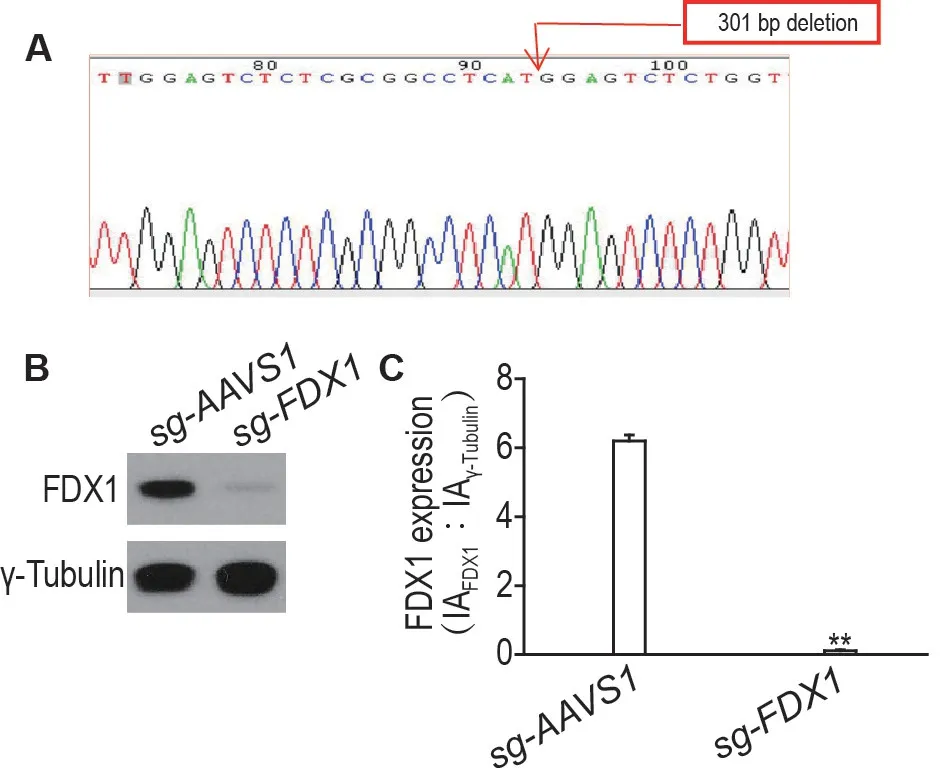
Fig.2 Expression of FDX1 protein in sg-FDX1 cells by Western blotting. A:the sequence result of sg-FDX1 and 301 bp was deleted around the sgRNA target site;B:the FDX1 expression level in sg-adeno-associated virus integration site1(AAVS1)and sg-FDX1 cells;C:the semi-quantitative analysis of B. IA:integrated absorbance.s,n=3. **P<0. 01,compared with sg-AAVS1 cells.
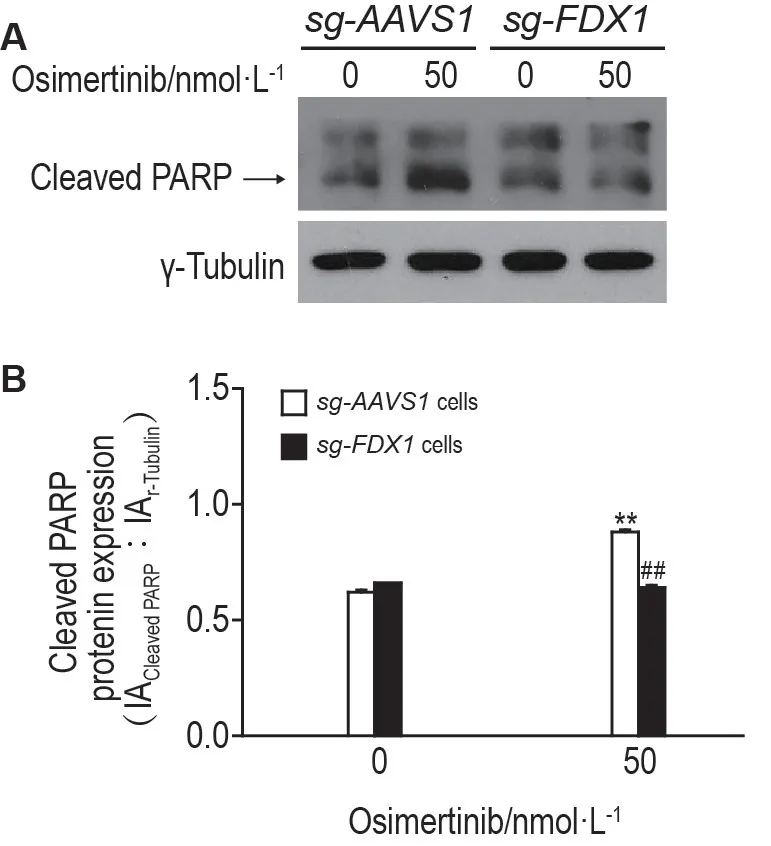
Fig.3 Effect of osimertinib on protein expression level of cleaved-poly(ADP-ribose)polymerase(PARP)in sg-AAVS1 and sg-FDX1 cells by Western blotting. The cells were treated for 30 h. B was the semi-quantitative analysis of A.s,n=3. **P<0.01,compared with sg-AVVS1 cells without osimertinib treatment;##P<0.01,compared with sg-AVVS1 cells with osimertinib treatment.
Western印迹结果(图4)显示,奥西替尼0,30,50,100 nmol·L-1处理细胞30 h 后,与sg-AAVS1细胞相比,在抑制FDX1 蛋白表达的条件下,sg-FDX1 细胞p-EGFR 和p-ERK 蛋白表达水平明显升高(P<0.05);2组细胞ERK全蛋白表达水平无明显差异。而sg-FDX1 细胞中EGFR 全蛋白水平降低(P<0.01)。表明敲除FDX1 可以减弱奥西替尼对细胞中EGFR 信号及受其调控的ERK 信号通路的抑制作用。
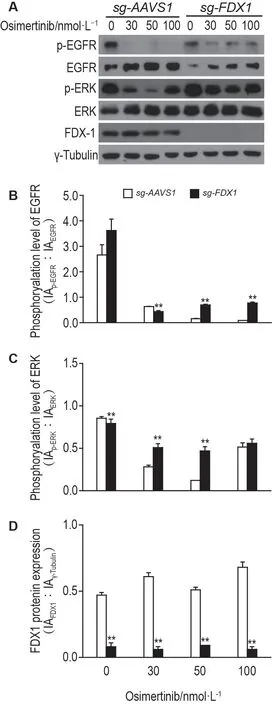
Fig.4 Effect of osimertinib on phosphorylation levels of EGFR,ERK and FDX1 protein expression in sg-FDX1 cells by Western blotting. A:cells were treated with osimertinib at 0,30,50,100 nmol·L-1 for 30 h;B,C and D:the semiquantitative analysis of A. s,n=3. **P<0.01,compared with sg-AVVS1 cells.
2.5 奥西替尼对sg-FDX1 细胞克隆形成和细胞存活的影响
平板克隆结果(图5A,B)显示,奥西替尼12 nmol·L-1处理10 d,sg-AAVS1和sg-FDX1细胞的克隆形成能力都显著减弱(P<0.01),但相比sg-AAVS1 细胞,sg-FDX1 细胞在奥西替尼作用后的克隆形成能力显著提高(P<0.01)。CCK8 结果(图5C,D)表明,相比sg-AAVS1细胞,奥西替尼0,12,20,30 nmol·L-1作用7 d,或者用奥西替尼30 nmol·L-1分别处理细胞3,5 和7 d,sg-FDX1 细胞增殖能力明显增强(P<0.01)。表明敲除FDX1会导致奥西替尼耐药。
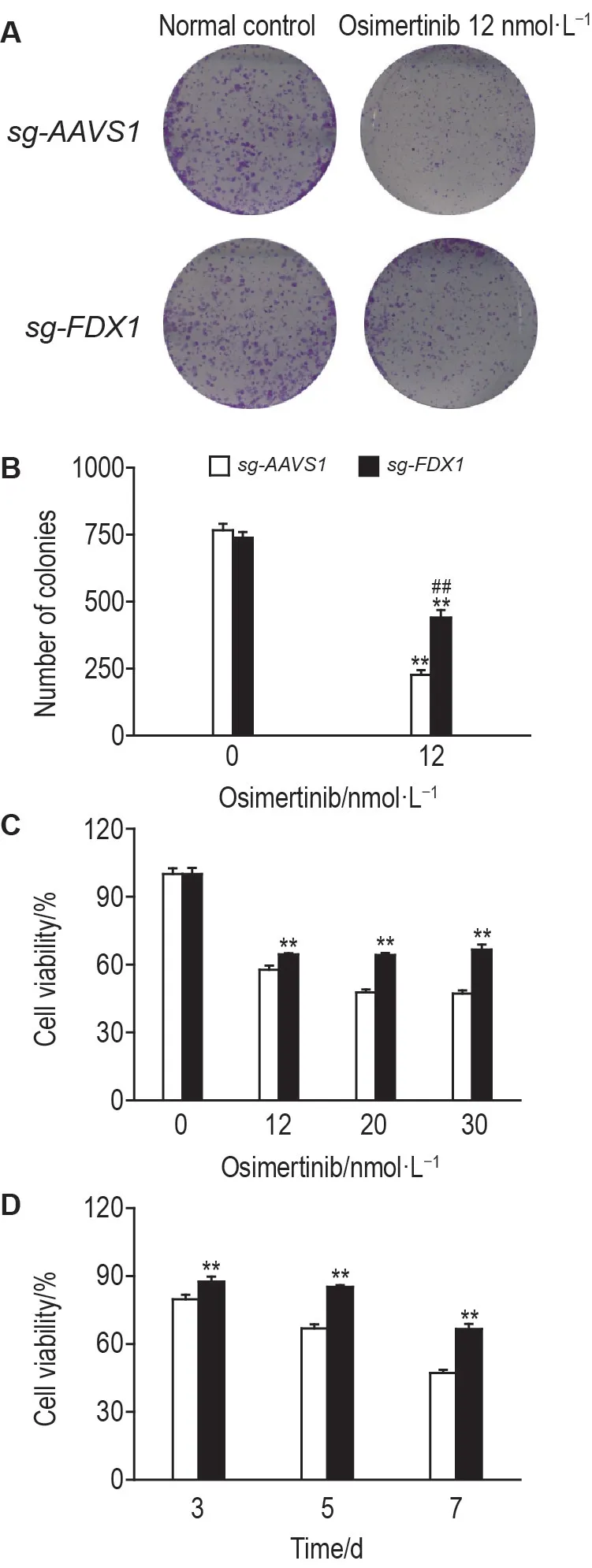
Fig.5 Effect of osimertinib on clonal formation(A,B)and cell survival(C,D)of sg-FDX1 cells. A and B:the cells were treated with osimertinib 12 nmol·L-1 for 10 d. x±s,n=3.**P<0.01,compared with corresponding without osimertinib treatment group;##P<0.01,compared with sg-AVVS1 cells with osimertinib treatment. C:cells were treated with the indicated concentrations for 7 d;D:the cells were treated with osimertinib 30 nmol·L- 1 for indicated time points. ±s,n=3. **P<0.01,compared with corresponding sg-AAVS1 cells.
3 讨论
本研究利用CRISPR-Cas9全基因组文库筛选系统,发现在奥西替尼的作用下,在NCI-H1975 细胞中FDX1的sgRNA发生了显著的富集,提示FDX1可能参与了细胞对奥西替尼的耐药作用。进一步研究发现,当敲除NCI-H1975 细胞FDX1 表达后,奥西替尼对于诱导细胞的凋亡以及对ERGR/ERK信号通路的抑制作用都显著降低,同时对肿瘤细胞的克隆形成和增殖的抑制作用,相对于sg-AAVS1细胞均显著降低。这些结果都表明,FDX1 表达水平改变在NSCLC对于第三代靶向治疗药物奥西替尼的耐药中发挥作用。
近年来,随着CRISPR-Cas9 高通量筛选系统的不断发展和完善,已经筛选获得了一系列的药物治疗耐药基因或毒物抗性基因[22-24]。FDX1基因编码一种小铁硫蛋白,通过铁氧还蛋白还原酶将电子从NADPH转移到线粒体细胞色素P450,参与类固醇,维生素D和胆汁酸代谢[25]。研究表明,FDX1功能的丧失破坏了铁-硫成簇酶的活性和细胞中铁的稳态分布,导致线粒体铁过载和细胞质中的铁缺失[26]。目前没有研究表明该分子和NSCLC对奥西替尼耐药有关。我们敲除了NCI-H1975 细胞对奥西替尼敏感的FDX1,发现奥西替尼对细胞的增殖能力和克隆形成能力都得到了减弱,表明FDX1 缺失导致NCT-H1975细胞对奥西替尼产生抗性。
利用CRISPR-Cas9文库筛选发现,FDX1缺失表达减弱了伊利司莫(elesclomol)对k562 细胞的毒性作用,而伊利司莫能够诱导细胞发生凋亡[27-28],这提示FDX1 可能参与了奥西替尼对NSCLC 细胞NCI-H1975 的凋亡诱导功能。目前的研究已经证明,奥西替尼能够有效地诱导EGFR 突变的NSCLC 细胞发生凋亡,这种作用可能是通过抑制EGFR以及下游ERK信号通路,导致BIM蛋白的表达上调和Mcl-1 蛋白的降解来实现的,抑制ERK信号通路能够增强细胞对奥西替尼的敏感性[29]。另外对奥西替尼产生获得性抗性的NSCLC细胞的研究发现,和敏感的细胞相比,NSCLC 抗性细胞对于MEK 信号通路抑制剂司美替尼(selumetinib)的抑制作用更加敏感,而同时使用奥西替尼和司美替尼能够阻止NSCLC 细胞PC9 耐药性细胞的发生,并且能够延缓NCI-H1975 细胞针对奥西替尼产生耐药[18]。这些研究提示,MAPK/ERK信号通路的激活可能是导致NSCLC细胞对奥西替尼产生耐药的分子机制之一。
本研究发现,当敲除FDX1后,能够明显减弱奥西替尼诱导NCI-H1975 细胞凋亡作用。信号通路结果表明,敲除FDX1 后,奥西替尼对NCI-H1975细胞中EGFR 信号通路以及与凋亡有关的ERK 信号通路的抑制作用都均减弱,这可能正是FDX1 在NCI-H1975 细胞中对奥西替尼产生耐药功能的重要分子机制之一,但是FDX1 是如何调控相关信号通路活性还需深入研究。
