多柔比星诱导的骨骼肌功能障碍机制研究进展
2019-08-12魏安奎
李 爱,魏安奎,徐 昕
(1.上海市儿童医院,上海交通大学附属儿童医院康复科,上海200062;上海体育学院2.运动科学学院,3.运动康复系,上海200438)
癌症被认为是世界上第二位主要死亡原因,其治疗中药物干预通常基于化学疗法[1]。多柔比星(doxorubicin,DOX)是治疗多种实体肿瘤广泛使用的化疗药物[2],但DOX在杀灭肿瘤细胞的同时可产生肌肉毒性[3],引起肌肉疲劳和无力,患者耐受能力下降,诱导骨骼肌功能障碍,促使骨骼肌萎缩[4],导致患者对治疗的反应减弱,预后恶化,生活质量下降[5]。近年来,DOX的肌毒性作用逐渐受到相关研究领域的关注,但有关DOX诱导骨骼肌功能障碍的发生机制尚不清楚。因此,本文就DOX诱导的骨骼肌功能障碍的发病机制进行综述,希望为临床DOX用药预防产生肌毒性提供理论依据,促进化疗药物DOX生物利用度的提高,达到减少癌症化疗引起的相关并发症并改善患者生命质量的目的。
1 多柔比星毒性作用简述
DOX 是从链霉菌培养物中分离出来的一种广泛使用且有效的蒽环类化疗剂,其主要是通过损害DNA 复制和RNA 转录,抑制拓扑异构酶Ⅱ(topoisomeraseⅡ,TOPⅡ)以及自由基生成导致DNA损伤或脂质过氧化而发挥药效[6-8]。另一方面,在DOX的化学结构中存在醌环,可以通过氧化还原酶黄嘌呤氧化酶、NADH 脱氢酶和细胞色素P450 还原酶介导药物的单电子还原。这种还原可将醌转化为半醌自由基,其在有氧环境中经历氧化还原循环以形成羟基自由基、超氧化物和过氧化物,引起脂质过氧化、DNA 损伤和细胞死亡[9],对各种生长周期的肿瘤细胞都具有杀灭作用[10],临床上广泛用于乳腺癌、肝癌、结肠癌、淋巴瘤和白血病等多种癌症的治疗[11]。然而,由于其剂量依赖性毒性作用,对心、脑、肝、肾、肺及骨骼肌等器官组织均可产生不同程度的毒性反应,造成全身多个系统的损伤[12-14],严重威胁癌症患者生存质量。由于DOX心肌毒性严重威胁患者生命,在临床和基础研究中都受到广泛的关注[15]。近年来研究表明,DOX的毒性除了对心肌具有高度特异性,也可与骨骼肌相互作用产生肌肉毒性,诱导骨骼肌功能障碍[16]。
2 多柔比星诱导的骨骼肌功能障碍
2.1 多柔比星诱导骨骼肌功能障碍的表现
骨骼肌是人体最大器官,成年人中占总体质量的40%,其基本功能是产生机械力以支持身体姿势并促进各种运动[17],并且在血糖控制和代谢稳态中起关键作用[18]。有研究报道,DOX给药后会引起骨骼肌显著的生理变化,包括肌力、肌生成速度的下降以及肌疲劳感的增加,最终导致骨骼肌功能的衰退[19]。也有研究表明,DOX对骨骼肌纤维类型可产生不良影响,如DOX 给药后,比目鱼肌(Ⅰ型,慢肌纤维)易产生疲劳;减少趾长伸肌(Ⅱ型,快肌纤维)可减少力的产生并且增加疲劳。因此,在研究DOX肌肉毒性和干预措施时,还应考虑对骨骼肌纤维类型的影响,以便尽量减少毒副作用[20]。在分子生物学层面,DOX 还可以增加骨骼肌线粒体活性氧成分,引起骨骼肌细胞凋亡,并且促使肌肉质量明显下降,表明DOX诱导的肌肉损伤可引起肌肉质量的丧失和肌肉功能的恶化[21];同时,在对肌肉特异性糖皮质激素受体敲除(muscle-specific glucocorticoid receptor knockout,mGRKO)小鼠进行环磷酰胺(cyclophosphamide),DOX 和5-氟尿嘧啶(5-fluorouracil,5-FU)联合用药时,发现可以引起小鼠肌肉萎缩,并且这种化疗药物引起的肌肉萎缩的重要原因可能依赖于骨骼肌中的糖皮质激素信号[22]。因此,明确DOX诱导骨骼肌功能障碍的相关发病特点对于机制研究和并发症防治至关重要。
2.2 可诱导骨骼肌功能障碍的多柔比星剂量
DOX被广泛用于多种恶性肿瘤的化疗,其剂量选择也因疾病状况和个体差异而有所不同。目前,临床推荐最大累计剂量为450~500 mg·m-2,当DOX 的累积使用剂量达到550 mg·m-2体表面积时,可能会使患者发展为充血性心力衰竭(congestive heart failure,CHF)或引起心肌病等心脏毒性反应[23]。有实验结果显示,昆明种小鼠隔日注射DOX(1.5,3.0和4.5 mg·kg-1),共7次,DOX诱导产生心肌损伤的极量为4.5 mg·kg-1,如再增加剂量便会明显增加死亡率[24]。对肿瘤坏死因子受体1(tumor necrosis factor receptor subtype 1,TNFR1)基因缺乏小鼠,单次ip给予DOX 20 mg·kg-1(该剂量相当于给予小细胞肺癌患者的DOX 化疗),发现可抑制小鼠趾长伸肌的最大力,并且加速疲劳;注射后72 h,小鼠血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)水平升高,由此推测临床DOX 浓度可能以TNFR1 依赖性方式破坏啮齿类动物肢体肌功能[25]。因此,研究DOX 单次(急性)或累积(慢性)给药后实验动物的生存率及其对骨骼肌的损害程度,有助于更好地把握DOX诱导产生骨骼肌功能障碍,建立合适的动物模型,为未来临床研究奠定理论基础。
3 多柔比星诱导的骨骼肌功能障碍机制
3.1 氧化应激
癌症或化学治疗剂介导的氧化应激是药物诱导的毒性的潜在机制。非靶向组织,如横纹肌,在化学疗法中受到氧化应激的严重影响,引起毒性反应和功能损伤[4]。DOX生成的活性氧(reactive oxygen species,ROS)可能会导致细胞氧化损伤和蛋白酶的活化,进一步产生分解代谢[3]。研究显示,细胞中被干扰的氧化还原信号已被证实可以激活几种蛋白水解,ROS 可作为信号分子,促使钙蛋白酶和胱天蛋白酶3的活化。钙蛋白酶可通过分解结构蛋白导致肌萎缩,而增加的ROS可引起细胞质钙水平升高,激活钙蛋白酶[26-27]。同时,胱天蛋白酶3在消耗性疾病环境中对肌蛋白降解过程产生重要作用[28]。此外,除了DOX诱导的钙蛋白酶和胱天蛋白酶3 活化外,在骨骼肌纤维中产生的DOX 介导的ROS还可以通过对肌蛋白的氧化修饰潜在加速蛋白质的分解[29],引起骨骼肌功能障碍。
3.2 Ca2+超载
Ca2+作为真核生物体内的第二信使,参与细胞内众多生命现象的发生与调节[30]。在骨骼肌中Ca2+可通过去极化或由ATP 激活的嘌呤受体来释放。在去极化状态下,二氢吡啶受体与兰尼碱受体(ryanodine receptor,RyR)相互作用,从肌浆网释放Ca2+[31],而DOX给药增加了从骨骼肌分离的肌浆网中的钙释放,在整个肌肉水平,DOX 会干扰肌动蛋白-肌球蛋白相互作用并降低钙的敏感性[16]。van Norren 等[32]认为,Ca2+失调可破坏对肌管应答的平衡,产生较低的最大力,降低最大松弛速度,增加疲劳感,破坏骨骼肌松弛和限制收缩,且长期使用DOX 还会引起初始Ca2+过载而引起细胞凋亡增加,而现存的骨骼肌细胞可能会因为不断减少Ca2+的再吸收而受损。也有研究认为,在DOX心肌毒性作用下,CHF诱导的肌肉类型特异性损伤与细胞内钙离子释放和吸收机制的缺陷以及肌钙二氢吡啶敏感性钙通道活性的降低有关,并且这种损伤在慢肌纤维中更为明显[33]。由此可见,DOX心肌毒性也可造成骨骼肌功能障碍,并且因肌纤维类型的不同有所差异,而对于其中的相关作用机制还有待于进一步探讨。
3.3 线粒体能量代谢
线粒体超氧化物的产生是细胞内ROS 的重要来源。Gilliam 等[34]认为,DOX 可能以时间依赖性方式破坏骨骼肌中线粒体能量代谢与氧化还原的平衡。在单次大剂量DOX(20 mg·kg-1)给药2 h后发现,DOX抑制线粒体复合物Ⅰ和复合物Ⅱ呼吸能力并增加H2O2排放,损伤线粒体呼吸功能;线粒体呼吸/膜电位〔respiratiry O2flux(JO2)/membrane potential(Δψm),JO2/Δψ〕曲线相在DOX 给药24 h后向右移动明显,可见线粒体氧消耗增加,膜电位下降,破坏细胞内正常的氧化还原平衡,导致骨骼肌氧化损伤;在72 h时间点线粒体呼吸能力进一步下降,H2O2的释放潜力增加。同时,DOX 损害线粒体中的钙摄取,并增加线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)对钙开放的敏感性。相关研究还指出,线粒体ROS释放增加和钙蛋白酶活化是DOX 诱导的心肌和骨骼肌肌病发生的重要原因。DOX给药后,大鼠心肌和骨骼肌中线粒体ROS 产生增加,钙蛋白酶活化,线粒体呼吸功能下降,心肌和骨骼肌发生氧化损伤、肌细胞凋亡和收缩功能障碍[35]。此外,最新研究数据显示,DOX等化疗药物可诱导线粒体超氧化物产生,并引起线粒体毒性反应,促使线粒体功能受损,但并不一定会导致骨骼肌氧化能力降低[36]。
3.4 细胞自噬和凋亡
DOX给药可引起自噬体成熟辅助因子(Beclin-1,Atg12 和Atg7)、微管相关蛋白1 轻链3(microtubule associated protein 1 lightchain 3,LC3)、LC3Ⅱ/LC3Ⅰ比值和组织蛋白酶L(cathepsin L)等几种重要自噬蛋白的mRNA 水平和蛋白丰度在肌肉水平增加,并导致肌结构损伤,促进细胞凋亡[37],产生肌肉疲劳、无力甚至引起肌萎缩和肌消耗等一系列并发症。表明相关自噬基因表达在DOX 诱导的骨骼肌功能障碍中具有一定的催化作用。同时,DOX作为一种有效的化疗药物,也是肌细胞凋亡的诱导剂。相关组织学研究数据显示,DOX给药后可引起正常肌结构改变,TUNEL染色肌纤维中阳性细胞核数量显著增加,表明DOX 可诱导骨骼肌细胞凋亡[21]。Campbell等[38]认为,DOX给药后,小鼠体质量呈现明显下降趋势,比目鱼肌中LC3-I 和P62 等相关自噬蛋白在不同时间段表达显著升高;比目鱼肌和跖肌形态学异常,表明DOX给药可能对骨骼肌细胞的凋亡和自噬等分解代谢过程产生不良影响。最新研究表明,DOX可通过Akt-mTOR通路诱导比目鱼肌细胞凋亡,而分泌型卷曲相关蛋白2(secreted frizzled-related protein 2,sFRP2)可通过增强Akt-mTOR 信号通路转导抑制DOX 的这种不良影响,这提示sFRP2 可能是DOX 诱导骨骼肌细胞凋亡的一个潜在治疗靶点[39]。
3.5 一氧化氮浓度和氨基酸代谢
一氧化氮(nitric oxide,NO)可以调节静息和收缩骨骼肌中的氧输送[40],骨骼肌中NO 产生波动会造成骨骼肌生长和分化受损,导致骨骼肌功能下降,单剂量DOX给药并且定量检测骨骼肌细胞内和间充质NO 浓度,在不同时间段可出现较为明显的波动,但未见剂量依赖效应。而NO浓度的改变,可能对骨骼肌产生显著的生理影响,造成组织中局部血液灌注增加,ROS 生成增加和过亚硝酸盐形成,可能是引起DOX 给药后骨骼肌功能障碍的潜在机制[41];另一方面,骨骼肌肌质量的增减与蛋白合成和降解之间的动态平衡密切相关,并且这一动态平衡过程的核心是游离氨基酸中氨基酸的可用性[42]。Fabris等[43]在其研究中监测了DOX给药后骨骼肌间充质、细胞内和血管腔内氨基酸的浓度。发现DOX 给药后,细胞内总氨基酸、必需氨基酸和支链氨基酸浓度显著增加,说明DOX给药后可造成骨骼肌蛋白质降解增加,加剧骨骼肌损伤。在血浆中,总氨基酸浓度与DOX 给药剂量差异也密切相关,与DOX 4.5 mg·kg-1剂量组相比,在1.5 mg·kg-1组观察到更高浓度的血浆总氨基酸,表明细胞内到循环系统中氨基酸浓度的流出高于系统性摄取,致使动脉氨基酸浓度增加。微透析研究骨骼肌间充质也揭示了DOX 可能对骨骼肌到血管系统的氨基酸转运机制产生剂量相关的影响,这些可能机制为未来研究氨基酸代谢减少骨骼肌损伤和恢复提供坚实的理论基础。
3.6 肌源性调节因子表达
在成人骨骼肌中,肌源性调节因子(myogenic regulatory factor,MRF)可以诱导卫星细胞恢复肌肉完整性,以应对损伤和压力。被活化的卫星细胞表达初生MRF,形成成肌细胞,并在次生MRF的作用下分化成肌管,重建肌纤维。而DOX的肌肉毒性作用可破坏MRF表达,改变肌肉的完整性和再生能力。研究显示,DOX 给药后,比目鱼肌中MYF5 和生肌决定因子蛋白(myogenic determining factor,MyoD)表达升高[44],但是这种上调与之前已有研究报道相反(DOX 给药可下调MYF5和MyoD 蛋白),破坏骨骼肌MRF 表达[45],骨骼肌结构和功能受损,从而引起骨骼肌功能障碍),分析推测可能与DOX给药时间相关。DOX急性给药(24 h),仅支持生肌信号反应在这一时间点的变化,未来的研究中应该延长DOX 给药时间继续探索[44]。另一方面,DOX肌毒性相关的骨骼肌萎缩可能继发于血管功能障碍和DOX 衍生的心功能障碍引起的骨骼肌血流量减少[7,34]。同时,DOX 心脏毒性可引起左心功能降低,最终导致心衰[46],而心衰时流向骨骼肌的血流减少,进一步引起骨骼肌萎缩和坏死,破坏骨骼肌MRF表达[47]。此外,也有研究表明,DOX诱导的骨骼肌和心肌质量变化,特别是在转录组学中,骨骼肌变化更为明显,并进一步分析可能与两种组织再生能力不同有关[48]。因此,把握DOX肌肉毒性与心肌毒性之间的潜在联系,有助于更全面地探索DOX的毒性反应机制,在未来研究中显得尤为重要。
4 结语
DOX 作为一种常用的强效抗癌药物用于多种癌症的治疗,但同时发现DOX 具有细胞毒性作用,在杀灭癌细胞时也可产生肌毒性反应,引起肌肉疲劳、无力,促使肌萎缩,最终引起骨骼肌的功能失调。图1 总结了DOX 诱导的骨骼肌功能障碍可能与氧化应激、Ca2+超载、线粒体能量代谢、细胞自噬与凋亡、一氧化氮浓度和氨基酸代谢以及肌源性调节因子表达等多种机制相关;同时,DOX 的肌肉毒性作用与使用剂量也密切相关。未来研究中应结合临床用药情况,进一步深入探讨DOX致机体各个系统毒副作用的潜在联系,以便展开有效的预防措施,改善癌症患者生存质量,惠及广大患者及家庭。
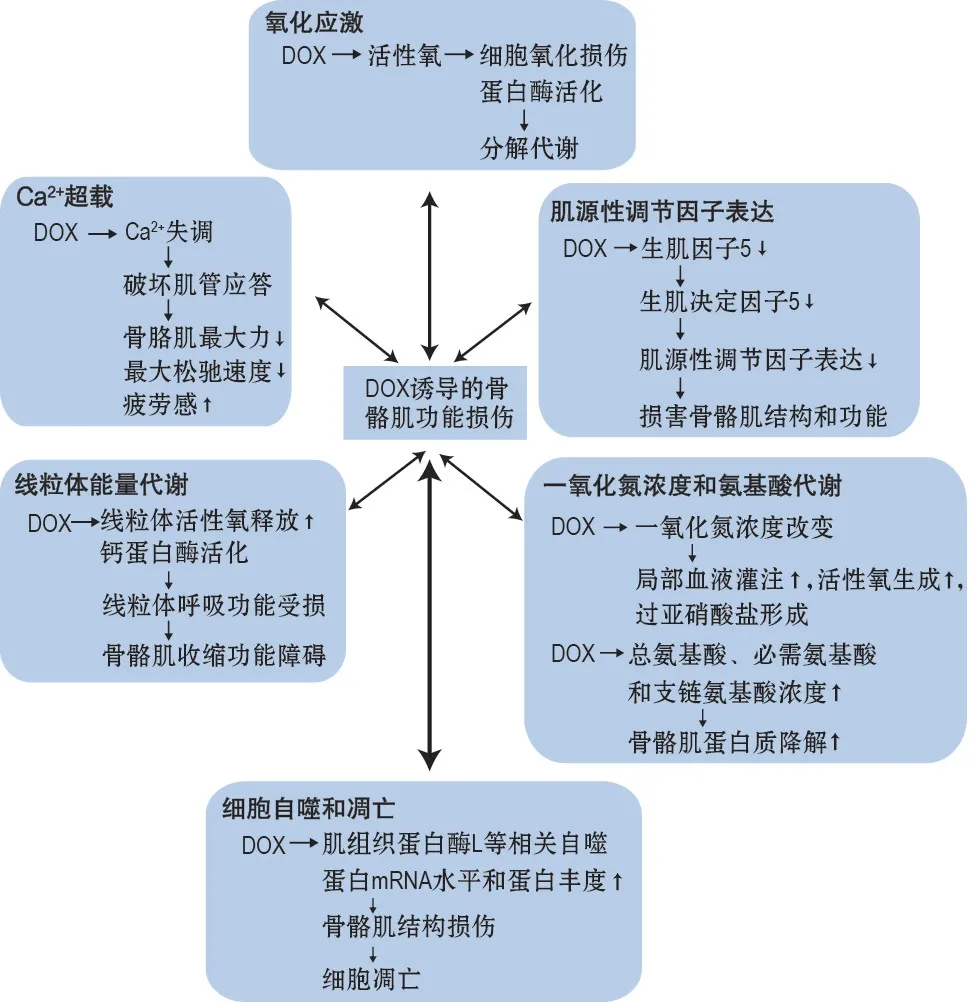
图1 多柔比星(DOX)诱导的骨骼肌功能障碍相关机制.
