浙江和上海地区生产及零售端鸡肉源沙门氏菌特性研究
2019-08-12曹晨阳肖英平赵瑞婷刘晨星杨保伟
曹晨阳,张 依,张 倩,肖英平,赵瑞婷,刘晨星,杨 华,赵 敏,杨保伟,*
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100; 2.浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021; 3.浙江大学 动物科学学院,浙江 杭州 310058; 4.西安万隆制药股份有限公司,陕西 杨凌 712100)
沙门氏菌是肠杆菌科革兰氏阴性杆菌,是世界上引发食源性疾病的重要病原菌。我国每年约3亿人因感染沙门氏菌而患病,占病原菌食源性疾病总数的70%~80%[1-4]。沙门氏菌血清型繁多,已有超过2 610种血清型被确认[5]。沙门氏菌对动物或人所致疾病的症状和危害程度主要取决于其血清型,不同地域、时间和环境条件下沙门氏菌的流行优势菌株不同[6]。
目前,抗生素是被广泛应用于畜牧业生产,预防和控制畜禽沙门氏菌感染的首选药物。但随着抗生素的广泛使用和滥用,导致许多病原菌,包括沙门氏菌产生了耐药性,且耐药菌株比例逐年上升,耐药范围逐渐扩大,已成为全世界关注的焦点[7-9]。由于耐药菌株可通过直接接触动物及其粪便、食用未煮熟的肉或接触肉表面而传播给人类[8],因此快速增加的沙门氏菌耐药性给食品性动物生产和公共卫生安全造成了极大威胁。
在浙江及其附近地区,除童哲等[10]、于丽莉等[11]、刘颖[12]和杨慧[13]分别对食品和食品性动物源沙门氏菌开展过监测研究外,尚无对该地区鸡肉源沙门氏菌相关特性的研究报道。本文旨在对浙江和上海部分屠宰端和零售鸡肉中沙门氏菌的污染状况、血清型分布及药敏特性进行研究,为保障食品安全提供依据。
1 材料与方法
1.1 材料
1.1.1 菌株
沙门氏菌共102株,分别从2016年7月至10月采集自浙江杭州、湖州、嘉兴、建德、金华、绍兴等地及上海的204份肉鸡屠宰端、零售端鸡肉及屠宰场环境样品中采集(表1),菌株的分离与鉴定参考Cui等[14]方法进行。沙门氏菌标准菌株SalmonellaTyphimurium LT2、药敏性测定标准质控菌株EsherichiacoliATCC25922和EnterococcusfaecalisATCC29212均为中国食品药品检定研究院惠赠。
1.1.2 培养基
LB营养琼脂、MH琼脂、半固体营养琼脂、蛋白胨缓冲水(buffered peptone water,BPW)、四硫磺酸钠亮绿培养基(tetrathionate broth base,TTB)及配套添加剂、RV肉汤均购自北京陆桥技术有限责任公司;木糖赖氨酸脱氧胆酸钠培养基(xylose lysine desoxycholate medium,XLD)、XLT4培养基及配套补充液购自美国BD公司。
1.1.3 沙门氏菌血清
泰国S&A公司诊断血清(WHO指定诊断血清),包括沙门氏菌O多价抗血清、O群抗血清、O单因子抗血清、H多价抗血清、H相抗血清、H单因子抗血清和H抗原诱导相抗血清。
1.1.4 抗生素药敏纸片
抗生素药敏纸片包括氨苄西林(Ampicillin)、阿莫西林/克拉维酸(Amoxicillin/Clavulanate)、头孢曲松(Ceftriaxone)、头孢西丁(Cefoxitin)、头孢哌酮(Cefoperazone)、庆大霉素(Gentamicin)、卡那霉素(Kanamycin)、阿米卡星(Amikacin)、链霉素(Streptomycin)、四环素(Tetracycline)、甲氧苄啶/磺胺甲噁唑(Trimethoprim/Sulfamethoxazole)、氯霉素(Chloramphenicol)、萘啶酮酸(Nalidixic acid)和环丙沙星(Ciprofloxacin)等共14种,均由英国OXIOD公司生产,购自广州迪景微生物科技有限公司。
1.1.5 主要仪器
超净工作台(苏州苏洁净化设备有限公司),高压灭菌锅(日本TOMY公司),超纯水处理器(美国Millipore公司),-40 ℃低温冰箱(日本SANYO公司),-80 ℃低温冰箱(日本SANYO公司),隔水式培养箱(上海精宏实验设备有限公司),恒温摇床(上海智成分析仪器制造有限公司),移液器(德国Eppendorf公司),恒温水浴锅(宁波赛福实验仪器厂)。
1.2 沙门氏菌分离鉴定
将采集的整鸡样品装于无菌采样袋中,称重后用其重量乘以400 mL体积的无菌BPW充分淋洗鸡肉样品,淋洗液置于37 ℃摇床100 r·min-1条件下培养6~8 h后,分别取10 mL和1 mL增菌液加入到100 mL TTB和RV增菌液中,于42 ℃摇床100 r·min-1条件下培养18~20 h。用无菌接种环取适量TTB增菌液划线至XLT4培养基、RV增菌液划线至XLD培养基表面后,于37 ℃条件下培养18~24 h,挑取沙门氏菌疑似菌落,在XLT4平板上纯化后,以沙门氏菌特异性基因invA作为靶基因,采用PCR方法鉴定沙门氏菌。invA扩增引物为:invA-F∶5’-TATCGCCACGTTCGGGCAATCTT-3’,invA-R∶5’-TCGCACCGTCAAAGGAACCACT-3’。沙门氏菌标准菌株SalmonellaTyphimurium LT2用作沙门氏菌分离和鉴定的阳性对照。
环境样品置于无菌采样袋后,加入50 mL无菌BPW,振荡均匀后培养,后续处理条件与分离方法同整鸡样品。
1.3 血清型鉴定
采用玻片凝集法鉴定试样血清型,分别确定O抗原和H抗原类型,查阅S&A公司沙门氏菌抗血清诊断附录和沙门氏菌检验国家标准(GB/T4789.4—2016),根据抗原式确定沙门氏菌的血清型。
1.4 药敏性测定
采用临床实验室标准化委员会(clinical and laboratory standards institute,CLSI)[15]推荐的纸片扩散法测定沙门氏菌的药敏性,按照CLSI标准判读药敏结果并确定耐药表型。药敏测定中使用EsherichiacoliATCC25922和EnterococcusfaecalisATCC29212用作标准质控菌株。
1.5 数据处理
采用SPSS 20.0对不同样品来源、采样地区和采样月份阳性样品检出率及药敏性结果进行卡方检验。当P<0.05时,视其具有显著性差异;当P<0.01时,视其具有极显著性差异。
2 结果与分析
2.1 沙门氏菌分离鉴定
如表1所示,204份样品中,85份携带沙门氏菌,阳性样品平均检出率为41.67%。屠宰环节整鸡中沙门氏菌阳性样品检出率最高(42.67%),环境样品阳性率最低(33.33%),不同来源样品中沙门氏菌阳性样品检出率间无显著性差异。
在不同采样地区,绍兴地区阳性样品检出率最高(78.95%),上海最低(16.67%);绍兴地区阳性样品检出率极显著(P<0.01)高于湖州及上海地区,其他地区样品中阳性样品检出率间无显著性差异(P>0.05)。在不同采样时间,9月份阳性样品检出率最高(80.00%),10月份最低(26.47%);不同月份采集的样品中阳性样品检出率在1%水平上表现出极显著差异(表1)。
204份样品中,有75份来自整鸡、脱羽、净膛、清洗、预冷、包装、冷藏等屠宰端生产环节。其中,冷藏、脱羽、净膛、清洗、包装环节中,样品沙门氏菌阳性率均高于40%(表2)。
2.2 沙门氏菌血清型鉴定
如表3所示,102株沙门氏菌中共检出15种血清型。其中,德尔卑沙门氏菌(23.53%)最为常见,其他检出率较高血清型的分别为:阿贡纳沙门氏菌(17.65%)、印第安纳沙门氏菌(12.75%)、鼠伤寒沙门氏菌(11.76%)和达布沙门氏菌(7.84%)。检出率较低的有舒卜拉沙门氏菌、波茨坦沙门氏菌、纽波特沙门氏菌、罗森沙门氏菌、斯坦利沙门氏菌、肠炎沙门氏菌和胥伐成格隆沙门氏菌等。
表1 不同样品来源、不同采样地区和采样月份沙门氏菌阳性样品检出状况
Table 1 Results of positive samples ofSalmonellafrom different sources, areas and months
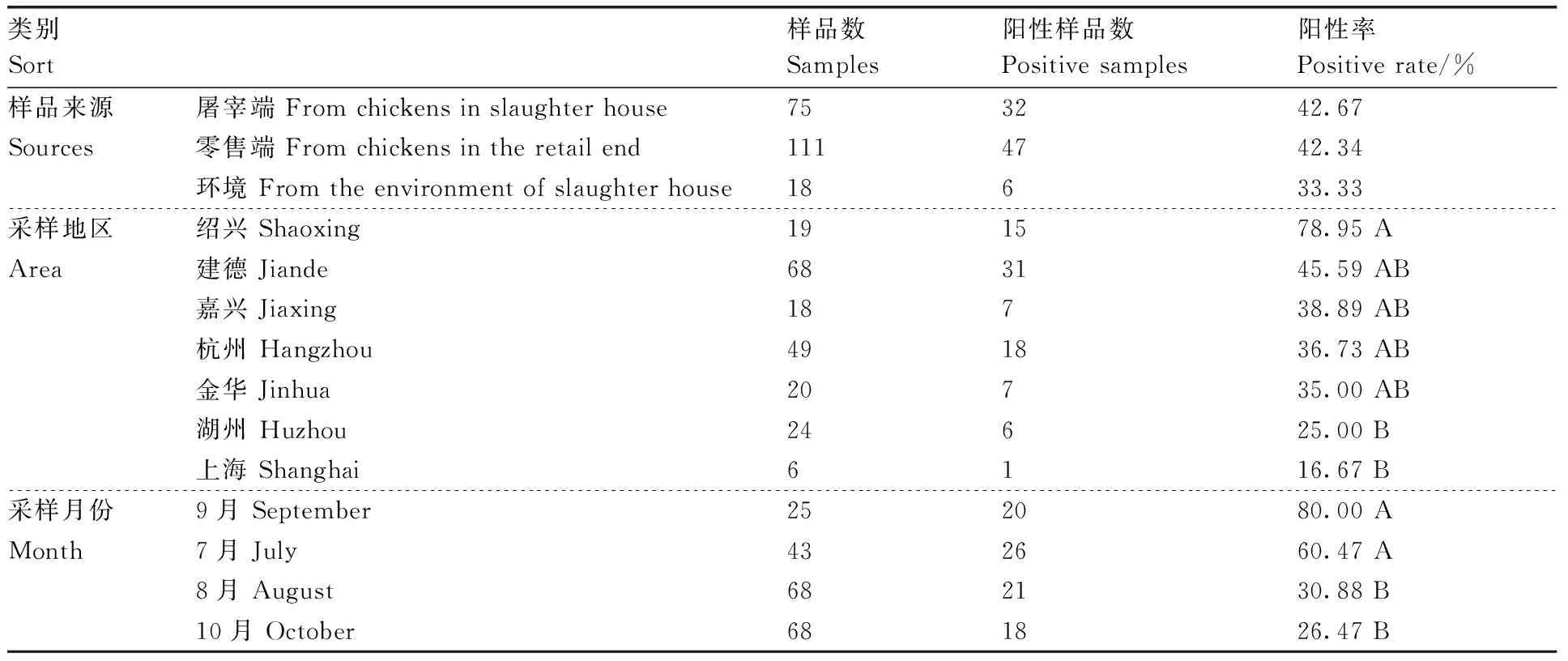
类别Sort样品数Samples阳性样品数Positive samples阳性率Positive rate/%样品来源屠宰端 From chickens in slaughter house753242.67Sources零售端 From chickens in the retail end1114742.34环境 From the environment of slaughter house18633.33采样地区绍兴 Shaoxing191578.95 AArea建德 Jiande683145.59 AB嘉兴 Jiaxing18738.89 AB杭州 Hangzhou491836.73 AB金华 Jinhua20735.00 AB湖州 Huzhou24625.00 B上海 Shanghai6116.67 B采样月份9月 September252080.00 AMonth7月 July432660.47 A8月 August682130.88 B10月 October681826.47 B
同列数据后无相同大写字母表示在0.01水平上差异显著,无相同小写字母表示在0.05水平上差异显著。
Data without the same uppercase letters in a column indicated significant differences at the 0.01 level, without the same lowercase letters indicated no significant difference at the 0.05 level.
表2 屠宰端不同环节沙门氏菌阳性样品检出状况
Table 2 Results of positive samples ofSalmonellafrom in different slaughter link

屠宰环节Slaughter links样品数Samples阳性样品数Positive samples阳性率Positive rate/%冷藏 Cold storage10770.00脱羽 To shed feathers15853.33净膛 Eviscerated15746.67清洗 Cleanout10440.00包装 Packaging10440.00整鸡 Whole chicken 5120.00预冷 Precool10110.00
屠宰场环境样品中,仅检出4种血清型的菌株,分别为鼠伤寒沙门氏菌(33.33%)、印第安纳沙门氏菌(33.33%)、纽波特沙门氏菌(16.67%)和德尔卑沙门氏菌(16.67%);屠宰端样品中,检出的沙门氏菌主要为德尔卑沙门氏菌(37.78%)、印第安纳沙门氏菌(24.44%)和鼠伤寒沙门氏菌(17.78%),未检出达布沙门氏菌、肯塔基沙门氏菌、肠炎沙门氏菌、波茨坦沙门氏菌、姆班达卡沙门氏菌和胥伐成格隆沙门氏菌;零售端样品中,阿贡纳沙门氏菌(29.41%)较为流行,其次为达布沙门氏菌(15.69%)、肯塔基沙门氏菌(13.73%)、德尔卑沙门氏菌(11.76%)和科瓦利斯沙门氏菌(9.80%),未检出印第安纳沙门氏菌、纽波特沙门氏菌、斯坦利沙门氏菌和舒卜拉沙门氏菌。
表3 不同来源和不同采样地区样品中沙门氏菌的血清型
Table 3 Serotype ofSalmonellain samples of different sources and areas

血清型SerotypeA杭州Hangzhou湖州Huzhou嘉兴Jiaxing金华Jinhua上海Shanghai绍兴ShaoxingB杭州Hangzhou建德JiandeC建德Jiande合计To-tal德尔卑沙门氏菌 S. Derby210003017124阿贡纳沙门氏菌 S. Agona40151403018印第安纳沙门氏菌 S. Indiana000000011213鼠伤寒沙门氏菌 S. Typhimurium00100162212达布沙门氏菌 S. Dabou3120020008肯塔基沙门氏菌 S. Kentucky4111000007科瓦利斯 S. Corvallis0211011006纽波特沙门氏菌 S. Newport0000000112肠炎沙门氏菌 S. Enteritidis0000020002姆班达卡沙门氏菌 S. Mbandaka0110000002胥伐成格隆沙门氏菌 S. Schwarzengr-und0020000002罗森沙门氏菌 S. Rissen0000010102斯坦利沙门氏菌 S. Stanley0000000202舒卜拉沙门氏菌S. Shubra0000000101波茨坦沙门氏菌 S. Potsdam0000010001 合计 Total136971157386102
A,零售端;B,屠宰端;C,环境端。下表同。
A, from chickens in the retail end; B, from chickens in slaughter house; C, from the environment of slaughter house. The same as below.
屠宰场环境样品血清型较少,从屠宰端与零售端样品中分离到的沙门氏菌数量相当,分别为45株和51株,但血清型却存在差异,种类增加,可能流通的范围扩大和接触的人群、环境增加决定了血清型差异。
2.3 不同地区样品中沙门氏菌的血清型
如表3所示,在杭州采集的零售及屠宰端样品中共检出6种血清型的沙门氏菌,主要为鼠伤寒沙门氏菌、肯塔基沙门氏菌、阿贡纳沙门氏菌和达布沙门氏菌。在湖州和嘉兴采集的零售样品中分别检出5种和7种血清型的沙门氏菌,但每种血清型的菌株数量均较少。在金华采集的零售样品中共检出3个沙门氏菌血清型,主要为阿贡纳沙门氏菌。在绍兴采集的零售端样品中共检出8种沙门氏菌血清型,主要为阿贡纳沙门氏菌和德尔卑沙门氏菌。上海采集的零售样品中只分离出阿贡纳沙门氏菌。建德采集的屠宰端及屠宰场环境样品中共检出8种血清型的沙门氏菌,以德尔卑沙门氏菌和印第安纳沙门氏菌最为常见,其余6种血清型菌株数量均较少。杭州与绍兴地区零售端样品中检出的沙门氏菌数量相当,但杭州地区主要为肯塔基沙门氏菌,而绍兴地区则主要是阿贡纳沙门氏菌,两地零售鸡肉中流行的沙门氏菌具有一定的血清型差异。
2.4 沙门氏菌分离株的药敏性及多重耐药结果
如表4所示,102株沙门氏菌中,所有菌株对阿莫西林/克拉维酸和头孢西丁敏感,四环素耐药率最高。抗生素的耐药率依次为:氯霉素(49.02%)、氨苄西林(41.18%)、萘啶酮酸(38.24%)、甲氧苄啶/磺胺甲噁唑(37.25%)、链霉素(28.43%)、环丙沙星(23.53%)、头孢曲松(22.55%)、头孢哌酮(22.55%)、卡那霉素(20.59%)、庆大霉素(19.61%)和阿米卡星(17.65%)。
零售端样品源沙门氏菌对β-内酰胺类抗生素的耐药性显著(P<0.05)低于源于屠宰端和环境样品的菌株,只有5.88%的零售端样品源沙门氏菌对人用的头孢曲松和头孢哌酮耐药。零售端样品源沙门氏菌对氨基糖苷类和(氟)喹诺酮类抗生素的耐药菌株比例也显著(P<0.05)低于屠宰端及环境样品源沙门氏菌。而3类不同来源的沙门氏菌对四环素和氯霉素的耐药菌株比例较为相似,无显著性差异(P>0.05)。研究结果表明,人类的介入程度导致沙门氏菌耐药性的变化。
表4 源于不同环节样品的沙门氏菌对14种抗生素的耐药率
Table 4 Resistance to 14 antimicrobials ofSalmonellaisolates from different sources
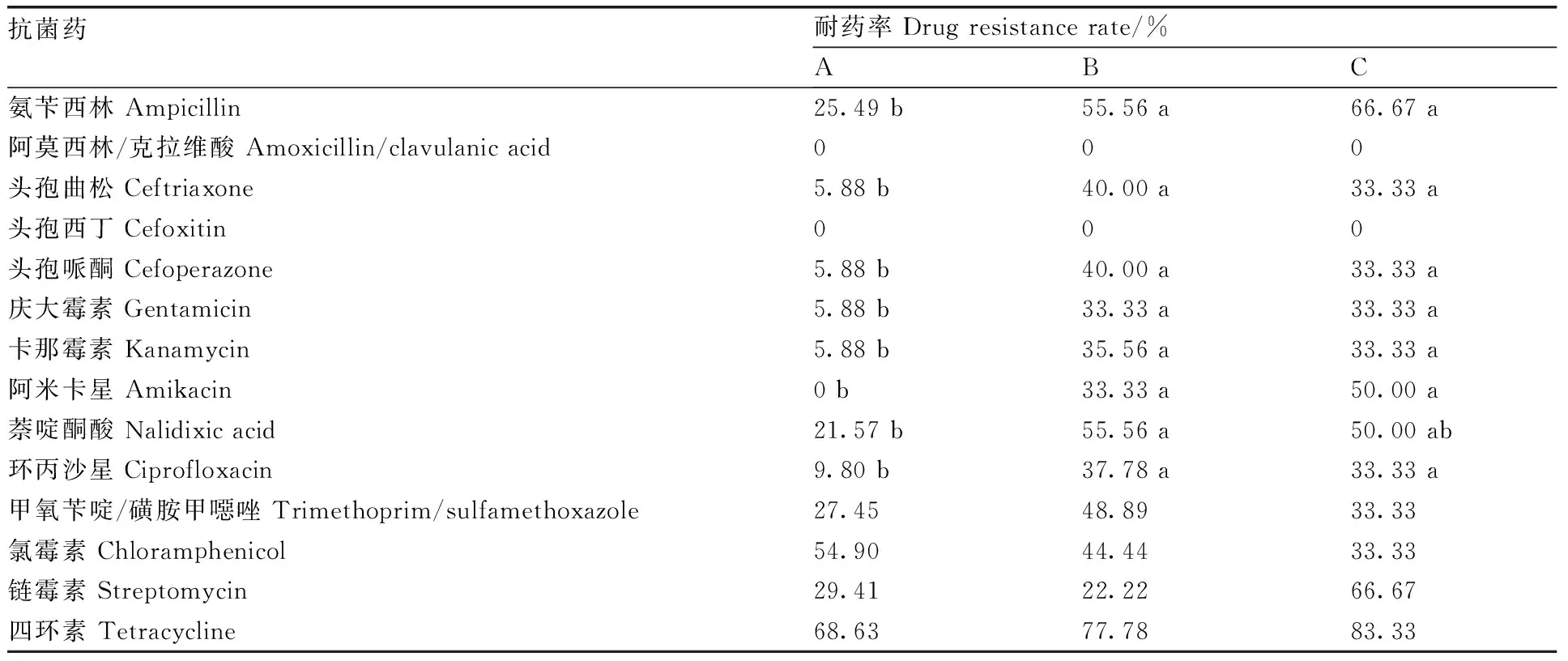
抗菌药耐药率 Drug resistance rate/%ABC氨苄西林 Ampicillin25.49 b55.56 a66.67 a阿莫西林/克拉维酸 Amoxicillin/clavulanic acid000头孢曲松 Ceftriaxone5.88 b40.00 a33.33 a头孢西丁 Cefoxitin000头孢哌酮 Cefoperazone5.88 b40.00 a33.33 a庆大霉素 Gentamicin5.88 b33.33 a33.33 a卡那霉素 Kanamycin5.88 b35.56 a33.33 a阿米卡星 Amikacin0 b33.33 a50.00 a萘啶酮酸 Nalidixic acid21.57 b55.56 a50.00 ab环丙沙星 Ciprofloxacin9.80 b37.78 a33.33 a甲氧苄啶/磺胺甲噁唑 Trimethoprim/sulfamethoxazole27.4548.8933.33氯霉素 Chloramphenicol54.9044.4433.33链霉素 Streptomycin29.4122.2266.67四环素 Tetracycline68.6377.7883.33
同行数据后无相同小写字母表示0.05水平上差异显著,无字母表示差异不显著(P>0.05)。
Data without the same letters in a line indicated significant differences at 0.05, without letters indicated no significant difference at 0.05.
102株沙门氏菌中,除5株对所有供试抗生素敏感外,97株(95.10%)至少可抗1种抗生素,39株(38.24%)可抗4种或4种以上抗生素,17株(16.67%)可抗10种或10种以上抗生素。可抗10种以上抗生素的17株沙门氏菌均来自于屠宰端及环境源样品,其中有15株(88.24%)对四环素产生抗性,4株(23.53%)可抗链霉素且均为印第安纳沙门氏菌。该17株菌除对阿莫西林/克拉维酸、头孢西丁、四环素及链霉素均不耐受或部分耐受外,全部可抗其余10种抗生素。
3 讨论
沙门氏菌不仅是一种能引发动物疾病,而且是与人类多种疾病密切相关、具有重要意义的人畜共患病病原菌[1]。在美国,每年约有4 800万人由于进食染菌食物而患病,其中940万人由食源性病原菌所致[16]。美国CDC统计数据显示,2015年共有902起食源性疾病事件暴发,其中由沙门氏菌引起的事件为149起,在引发疾病的病原菌中位列第2位[17]。沙门氏菌能在人和动物间交叉传播,并通过污染食物导致食物中毒,对人类健康威胁巨大[18]。沙门氏菌血清型种类复杂,且具有很强的地域分布特点。在不同地域、时间和环境,沙门氏菌的优势流行菌株有所不同,血清型也决定其对动物或人类所致疾病的症状和危害程度。
3.1 沙门氏菌的检出率及血清型分布
美国CDC 2013年数据显示,引起食源性疾病的沙门氏菌主要为肠炎沙门氏菌、鼠伤寒沙门氏菌、海德尔堡沙门氏菌、纽波特沙门氏菌和爪哇安纳沙门氏菌[19]。在我国,吴云凤等[20]对南京市零售鸡类食品中的沙门氏菌阳性率的调查结果为14.9%,Yang等[21]对中国零售鸡肉样品的阳性样品检出率为43.4%,元振杰等[22]研究表明,西藏拉萨市部分鸡场沙门氏菌阳性率为48.96%。在国外,对采集于印度巴特那的228份鸡肉中沙门氏菌阳性样品的检出率和对尼泊尔鸡肉样品中沙门氏菌检出率研究均显示其低于本研究结果[8,23],表明不同国家和地区鸡肉中沙门氏菌污染状况存在一定差异。
研究对采集自屠宰加工过程中7个不同关键环节的鸡肉样品中沙门氏菌的检测结果表明,冷藏环节样品带菌最为普遍,脱羽环节次之,预冷环节最低。沙门氏菌检出率先降后升和血清型变化说明屠宰处理是有效的,而包装冷藏环境存在固有的污染源。Yang等[24]研究表明,储存于冷藏和冷冻条件下鸡肉中沙门氏菌阳性样品的检出率分别为52.4%和45.7%,显示冷藏的鸡肉更易带染沙门氏菌,与本研究结果一致。但这与朱冬梅等[25]和阎学燕等[26]分别对四川和开封肉鸡屠宰加工过程各关键环节沙门氏菌阳性样品的检出结果不同。不同研究选取的屠宰链及相应环节不同,研究结果存在一定差异,但这些研究结果均表明不同地区肉鸡屠宰场屠宰环节沙门氏菌污染客观存在,对屠宰场各屠宰环节沙门氏菌的预防十分必要。
本研究检出的沙门氏菌主要为德尔卑沙门氏菌、阿贡纳沙门氏菌、印第安纳沙门氏菌和鼠伤寒沙门氏菌,其中零售端主要为阿贡纳沙门氏菌,屠宰端则主要为德尔卑沙门氏菌,该结果与张玉[27]和Kaushik等[23]研究结果一致。杨保伟等[28]和黄裕等[5]研究显示,在陕西省和深圳市鸡肉中检出的沙门氏菌主要为肠炎沙门氏菌,与本研究存在一定差异,表明食品产地来源和流通销售等自然因素的差异,会导致同种食品带染不同血清型的沙门氏菌。对浙江省而言,要严格预防德尔卑沙门氏菌和阿贡纳沙门氏菌对屠宰及零售鸡肉的污染,确保食品安全。此外,本研究分离的102株沙门氏菌涵盖了15种血清型,检出了罗森沙门氏菌、达布沙门氏菌和胥伐成格隆沙门氏菌等我国不常见血清型,表明浙江省肉鸡加工和零售鸡肉源沙门氏菌的血清型具有丰富的多样性。
3.2 药物敏感性及多重耐药性
动物养殖等领域抗生素的无节制添加,临床治疗领域大剂量抗生素滥用等都加剧了各类耐药菌的迅速产生和蔓延[29],给食品安全和公共卫生安全带来了极大的危害。郝宏珊等[30]对陕西、河南、四川和北京四省市鸡肉源沙门氏菌研究结果表明,沙门氏菌对萘啶酮酸和环丙沙星的耐药率分别为63.59%和21.28%。诸葛石养等[31]研究表明,分离自广西生鸡肉中的沙门氏菌对四环素、萘啶酮酸和氯霉素的耐药率分别为58.33%、72.22%和63.89%。Yang等[32]对分离自河南省零售食品中的沙门氏菌药敏性研究结果表明,对四环素耐药的菌株比例达到75.8%。本研究也显示沙门氏菌对四环素耐药最为常见(耐药菌比例为73.53%),对氯霉素、氨苄西林、萘啶酸、甲氧苄啶/磺胺甲噁唑和链霉素均表现出较高的抗性,耐药菌株比例分别为49.02%、41.18%、38.24%、37.25%和28.43%,结果与上述报道较为一致。
据美国CDC报道,美国每年有18 000 t抗生素用于农业和畜牧业,其中12 600 t用于非治疗性的促生长剂,导致美国市售鸡肉源沙门氏菌普遍对多种抗生素耐药[33]。近10年来,国内也有许多关于沙门氏菌多重耐药性的报道[4-7],由此可见,菌株多重耐药性问题在全球普遍存在,食品安全形势处于较为严峻的局面。本研究中,95.10%沙门氏菌分离株可抗至少1种以上抗生素,38.24%分离株可抗至少4种以上抗生素,16.67%分离株可抗至少10种以上抗生素。本研究结果表明,食品性动物源沙门氏菌耐药谱不断扩宽,多重耐药现象普遍存在,给食品安全和公共卫生安全造成了巨大威胁。
4 结论
综上所述,浙江和上海地区肉鸡屠宰过程及零售鸡肉沙门氏菌污染较为普遍,屠宰处理有效地减少了沙门氏菌,但包装、冷藏环节的鸡肉携带沙门氏菌显著增加。沙门氏菌分离株血清型种类丰富,耐药状况严重且多重耐药现象普遍,在整个肉鸡生产消费链条中,呈现明显的变化,即沙门氏菌不是单纯来源于该批次肉鸡携带菌,各环节固有存在和人员携带的菌株也加入了其中,造成终端产品的现状。研究结果揭示了沙门氏菌在鸡肉产品中分布的状况和来源,为采取合理的干预措施,预防该区域肉鸡生产全产业链中沙门氏菌的污染及耐药菌的出现、确保食品安全提供了相应的数据和理论支持。
