一株邻苯二甲酸二丁酯和邻苯二甲酸二(2-乙基己基)酯降解菌的筛选鉴定与降解特性
2019-08-14梁浩花王亚娟李娇玲
梁浩花,陶 红,王亚娟,李娇玲
(1.宁夏大学 资源环境学院,宁夏 银川750021; 2.宁夏(中阿)旱区资源评价与环境调控重点实验室,宁夏 银川 750021; 3.宁夏大学 经济管理学院,宁夏 银川 750021)
邻苯二甲酸酯(phthalic acid esters,PAEs)又称酞酸酯,是一类人工合成的有机化合物,作为增塑剂、添加剂在塑料、化肥、农药、玩具、化妆品与涂料等行业中均有广泛使用[1]。农膜的大量使用被认为是土壤中PAEs重要来源之一,由于PAEs与塑料聚合物高分子碳链以氢键或范德华力结合,并未真正与塑料化学键结合,使得PAEs分子在加工、使用、处置的过程中容易迁移到土壤环境中[2]。土壤中PAEs不仅影响土壤质量、植物的生长和品质,而且在作物中具有一定的生物累积效应,通过食物链富集,对生态系统和人体健康构成严重威胁[3]。其中,邻苯二甲酸二丁酯(dibutyl phthalate,DBP)和邻苯二甲酸二(2-乙基己基)酯[di-(2-ethylhexyl) phthalate,DEHP]是土壤中检出率和含量较高的2种PAEs化合物,具有典型的内分泌干扰性和潜在的“三致”效应,被美国环境保护署(Environmental Protection Agency,EPA)列入“优先控制污染物”。一些研究报道了我国不同地区土壤中DBP和DEHP的含量,如北京设施蔬菜基地[4](0.440、0.380 mg·kg-1),咸阳市郊菜地[5](0.037~6.313、ND~3.871 mg·kg-1),汕头蔬菜产区[6](ND~7.652、0.001~4.197 mg·kg-1),以上地区土壤中DBP和DEHP都为主要的PAEs类污染物。
DBP和DEHP在自然环境中的水解、光解速率缓慢,属于难降解物质。微生物降解是其主要降解途径之一[7]。近年来,国内外众多学者针对PAEs类污染物的微生物降解进行了较多研究,例如针对DBP的Geotrichumsp.[7]、Brucellasp.和Sinobactersp.[8]、变形假单胞菌(Pseudomonasplecoglossicida)[9]、Paenibacillussp.[10]、Bacillussubtilis[11]、Gordoniasp.[12];针对BBP的琼氏不动杆菌(Acinetobacterjunii)[13];针对DEHP的嗜吡啶红球菌(Rhodococcuspyridinivorans)[14]、汇合分支杆菌(Mycobacteriumconfluentis)[15]、Pseudomonassp.[16]、戈登氏菌[17](Gordoniasp.);针对DMP的恶臭假单胞菌(Pseudomonasputida)[18]、戴尔福特菌属(Delftiasp.)[19]。目前,大多数研究针对的是单一短侧链或者单一复杂的、不容易降解的长侧链PAEs的生物降解,关于同一菌株同时降解DBP和DEHP的研究较少。研究同一菌株对多种PAEs的降解特性,修复多种PAEs污染的农田土壤,以减少有机污染物对环境的危害和提高农产品质量和安全具有重要应用价值。节杆菌(Arthrobactersp.)是一类革兰氏阳性菌,能降解多种有机污染物,对于有机污染土壤的修复具有重大意义。已有节杆菌降解PAEs的报道较少,褚娇艳等[20]研究表明,Arthrobactersp. ZJUTW对DBP有较强的降解能力和较高的耐受性;周长健[21]研究表明,Arthrobactersp. JQ-1能修复DEHP污染的土壤,但是关于节杆菌同时降解DBP和DEHP研究尚未见报道。
本课题组前期对于银川市东郊设施菜地土壤中PAEs的污染现状研究表明,该区域PAEs类主要污染物为DBP和DEHP。因此,本研究以银川市东郊设施菜地土壤为材料,从中筛选出能同时降解DBP和DEHP的菌株,并通过生理生化特征、16S rDNA序列分析技术鉴定菌株,分析不同环境因素对菌株的生长及降解特性影响,以期为该区域PAEs污染土壤的治理和生物修复提供一定的理论依据。
1 材料与方法
1.1 实验材料
实验供试土壤样品采自银川市东郊设施蔬菜基地,将采集的鲜样封存于4 ℃的冰箱中备用。
1.2 培养基配制
无机盐培养基(MSM):K2HPO4·3H2O 1.0 g,NaCl 1 g,NH4NO30.5 g,MgSO4·7H2O 0.4 g,CaCl20.1 g,FeCl3·6H2O 0.01 g,定容至1 L,调整pH为7,于121 ℃下湿热灭菌30 min。固体培养基加琼脂18.0 g·L-1。
选择培养基:移取0.2 mL的2 g·L-1的DBP和DEHP混合溶液于100 mL灭菌的无机盐培养基中,待丙酮完全挥发,即可得到浓度为100 mg·L-1的DBP和DEHP混合无机盐液体培养基。固体培养基加琼脂18.0 g·L-1。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,定容至1 L,调整pH为7,于121 ℃湿热灭菌30 min,固体培养基加琼脂18.0 g·L-1。
1.3 DBP和DEHP降解菌的筛选、纯化与鉴定
称取10 g土样,加入盛有90 mL蒸馏水和10 mL玻璃珠的三角瓶,30 ℃,175 r·min-1,振荡30 min,静置。取1 mL的上清液接种于含有100 mg·L-1的DBP和DEHP混合的100 mL无机盐液体培养基中,避光条件下振荡培养7 d。采用梯度压力驯化法,按1%的接菌量逐步转接至300、600、800、1 000 mg·L-1的DBP和DEHP混合无机盐液体培养基中,每7 d作为1个驯化周期转接1次,持续进行培养。
取100 μL终期驯化液,涂布于DBP和DEHP混合的100 mg·L-1牛肉膏蛋白胨固体平板上,然后置于30 ℃生化培养箱中静置培养。待长出肉眼可见菌落后,观察其生长特征,筛选出长势最好的菌株,挑取单菌落将其反复划线接种于新的牛肉膏蛋白胨固体培养基上,直至镜检纯化为止。将菌株送往生工生物工程(上海)股份有限公司完成测序工作。
1.4 菌株对DBP和DEHP降解能力测定
菌悬液的制备:挑取光滑完整的菌落,接种到牛肉膏蛋白胨液体培养基中,置于恒温振荡器中,30 ℃、175 r·min-1培养48 h。取出牛肉膏蛋白胨液体培养基后,将培养液分装于100 mL灭菌的离心管中,室温条件下4 000 r·min-1离心10 min,收集湿菌体。然后用灭菌的0.9% NaCl溶液洗涤3次,再用0.9% NaCl溶液将菌体调配成菌悬液,使其在波长为600 nm下的吸光度为1.0。
将分离纯化后的不同菌株,以2%接菌量分别接种到100 mg·L-1的DBP和DEHP混合的100 ml灭菌无机盐液体培养基,35 ℃,175 r·min-1培养3 d,以不接菌的无机盐液体培养基作为对照,测定DBP和DEHP的降解率和吸光度,确定最佳降解菌株。每个处理设置3次重复。
1.5 环境条件对降解菌生长和PAEs降解性能的影响
1.5.1 转速对AS001生长与降解邻苯二甲酸酯的影响
配制初始浓度为100 mg·L-1的DBP/DEHP无机盐液体培养基,调节pH=7,灭菌。分别将2%菌悬液加入50 mL的DBP/DEHP无机盐溶液中,在35 ℃条件下分别以0、100、150、175、200 r·min-1振荡培养3 d,以不接菌液的无机盐液体培养基为对照,测定DBP、DEHP含量和D600。每个处理设置3个重复。
1.5.2 pH对AS001生长和降解邻苯二甲酸酯的影响
配制初始浓度为100 mg·L-1的无机盐液体培养基,用0.1 mol·L-1HCl和0.1 mol·L-1NaOH 调整pH值为5.0、6.0、7.0、8.0、9.0,灭菌。将2%菌悬液加入50mL的DBP/DEHP无机盐溶液中,分别在35 ℃、175 r·min-1条件下振荡培养3 d,以不接菌液的无机盐液体培养基为对照,测定DBP、DEHP含量和D600。每个处理设置3个重复。
1.5.3 初始浓度对AS001生长与降解邻苯二甲酸酯的影响
分别配制总浓度为50、100、200、300、400 mg·L-1的DBP/DEHP无机盐液体培养基,调节pH=7,灭菌。将2%菌悬液加入50 mL的DBP/DEHP无机盐溶液中,在35 ℃、175 r·min-1条件下振荡培养3 d,以不接菌液的无机盐液体培养基为对照,测定DBP和DEHP含量、D600。每个处理设置3个重复。
1.5.4 接菌量对AS001生长与降解邻苯二甲酸酯的影响
配制初始浓度为100 mg·L-1的DBP/DEHP无机盐液体培养基,调节pH=7,灭菌。分别将1%、2%、3%、4%、5%菌悬液加入50 mL的DBP/DEHP无机盐溶液中,分别在35 ℃、175 r·min-1条件下振荡培养3 d,以不接菌液的无机盐液体培养基为对照,测定DBP和DEHP含量、D600。每个处理设置3个重复。
1.5.5 温度对AS001生长与降解邻苯二甲酸酯的影响
配制初始浓度为100 mg·L-1的DBP/DEHP无机盐液体培养基,调节pH=7,灭菌。将4%菌悬液加入50 mL的DBP/DEHP无机盐溶液中,分别在15、25、35、45 ℃,175 r·min-1条件下振荡培养3 d,以不接菌液的无机盐液体培养基为对照,测定DBP和DEHP含量、D600。每个处理设置3个重复。
1.6 分析方法
1.6.1 液体中DBP和DEHP的提取方法
参照饶潇潇等[22]和王冬莹[23]的方法,向100 mL的DBP和DEHP无机盐培养基中加入1 mL的100 μg·mL-1苯甲酸苄酯,加入萃取液乙酸乙酯30 mL,放入恒温振荡器中振荡30 min。转移至分液漏斗中振荡5 min,分液,再用30 mL乙酸乙酯冲洗3次,将乙酸乙酯溶液全部转移到平底烧瓶中。取出净化柱,依次加入2 g无水硫酸钠,4 g弗罗里硅土,2 g无水硫酸钠。先用10 mL乙酸乙酯预洗柱子,弃去该淋洗液,再用50 mL乙酸乙酯洗脱。收集全部洗脱液至鸡心瓶中,经旋转蒸发浓缩至蒸干。加入甲醇定容,过有机系0.22 μm滤膜后进行气相色谱分析。
1.6.2 生物量的测定
菌株生物量的测定:采用UV-9600紫外可见分光光度计测量培养液在600 nm时的吸光度D600。
1.6.3 PAEs的测定
气相色谱条件。色谱柱HP-5MS(30 m×0.25 mm×0.25 μm),载气N2(纯度≥99.999%),进样口温度260 ℃,FID检测器温度290 ℃,分流进样,分离比为30,进样量为1 μL。程序升温:60 ℃保持1 min,以20 ℃·min-1的速度升至220 ℃,保持1 min;以3 ℃·min-1的速度升至290 ℃,保持5 min。
1.6.4 菌株生理生化特征的测定方法
生理生化特征试验参照文献[24]。
1.7 数据处理
数据处理和分析采用软件Excel,绘图利用Origin 8.5软件。
2 结果与分析
2.1 菌株的筛选、形态和生理生化特征
采用富集驯化法从银川市东郊设施菜地土壤中分离得到了3株菌株,分别命名为AS001、AS002和AS003。不同菌株对DBP和DEHP降解能力的比较结果(图1)表明,菌株2即菌株AS001的降解效果最佳。菌株AS001在固体平板上培养,形成的菌落较大,呈淡黄色、湿润、微凸、黏质不透明(图2)。无丝状体,形态呈杆状,长度约1.2~8.0 μm。菌株AS001革兰氏染色呈阳性(图2),接触酶、硫化氢、吲哚和V-P试验呈现阳性,甲基红、脲酶、柠檬酸盐、硝酸盐还原、酪素水解、淀粉水解试验呈现阴性。
2.2 菌株的16S rDNA分子鉴定与系统发育树
由生工生物工程(上海)股份有限公司对降解菌AS001进行测序,测序结果表明,AS001的16S rDNA基因序列大小为1 485 bp,GenBank中序列登录号为MG569788。在GenBank中进行BLAST比对分析,结果发现,与菌株AS001的16S rDNA序列相似性最高的是节杆菌(Arthrobactersp.),其同源性达到99%。从GenBank中取同源性高的相关序列作为参考菌株序列,首先用Clustal X将序列进行完全比对,然后用MEGA 5软件中Neighbor-joining对其做系统发育进化树(图3)。如图3所示,菌株AS001与菌株

图2 菌株AS001形态和革兰氏染色结果Fig.2 Colonial morphology and gram staining result of strain AS001

采用邻接法计算距离,节点上的数值是自展值(%),括号中为菌株的登录号。Distances were calculated using neighbor-joining method. The numbers at the branch nodes were bootstrap values (%). Accession numbers of the bacterial isolates were shown in brackets.图3 菌株AS001和相关菌株的16S rDNA系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequences of strain AS001 and other related strains
SD41的亲缘关系最近;菌株1132G-1与S15、菌株TD3与A-1、菌株m3与X4的自展值为100;菌株scl-2与前6株菌株的自展值为100,它们之间亲缘关系非常相近;菌株ZXY-2与前7株菌株的自展值为99,它们之间的亲缘关系也很近。
2.3 环境条件对降解菌的生长和降解性能的影响
2.3.1 转速对AS001生长及降解DBP和DEHP的影响
转速决定了氧气的供应程度和碳源的分布是否均匀[21]。如图4所示:总体上,菌株对DBP的降解率高于对DEHP的降解率;随着摇床转速增大,降解菌AS001的D600逐渐升高,摇床转速在150~175 r·min-1时,菌株AS001生长情况较好,且菌株对DBP和DEHP的降解率随着转速的增大显著增加,当转速为175 r·min-1时,菌株对DBP和DEHP降解率达到最高,分别为85.55%和39.86%,菌株的D600值最大(0.137),但转速增加至200 r·min-1时,菌株生长和对DBP和DEHP的降解率迅速下降。主要是随着转速的增大,培养液中溶解氧的含量不断增加,利于菌株的生长和代谢活动而使其生物量不断增加[25];但是当转速太高时,剪切力较大,菌丝容易被打断,不利于菌丝体生长[26]。
2.3.2 pH对AS001生长及降解DBP和DEHP的影响
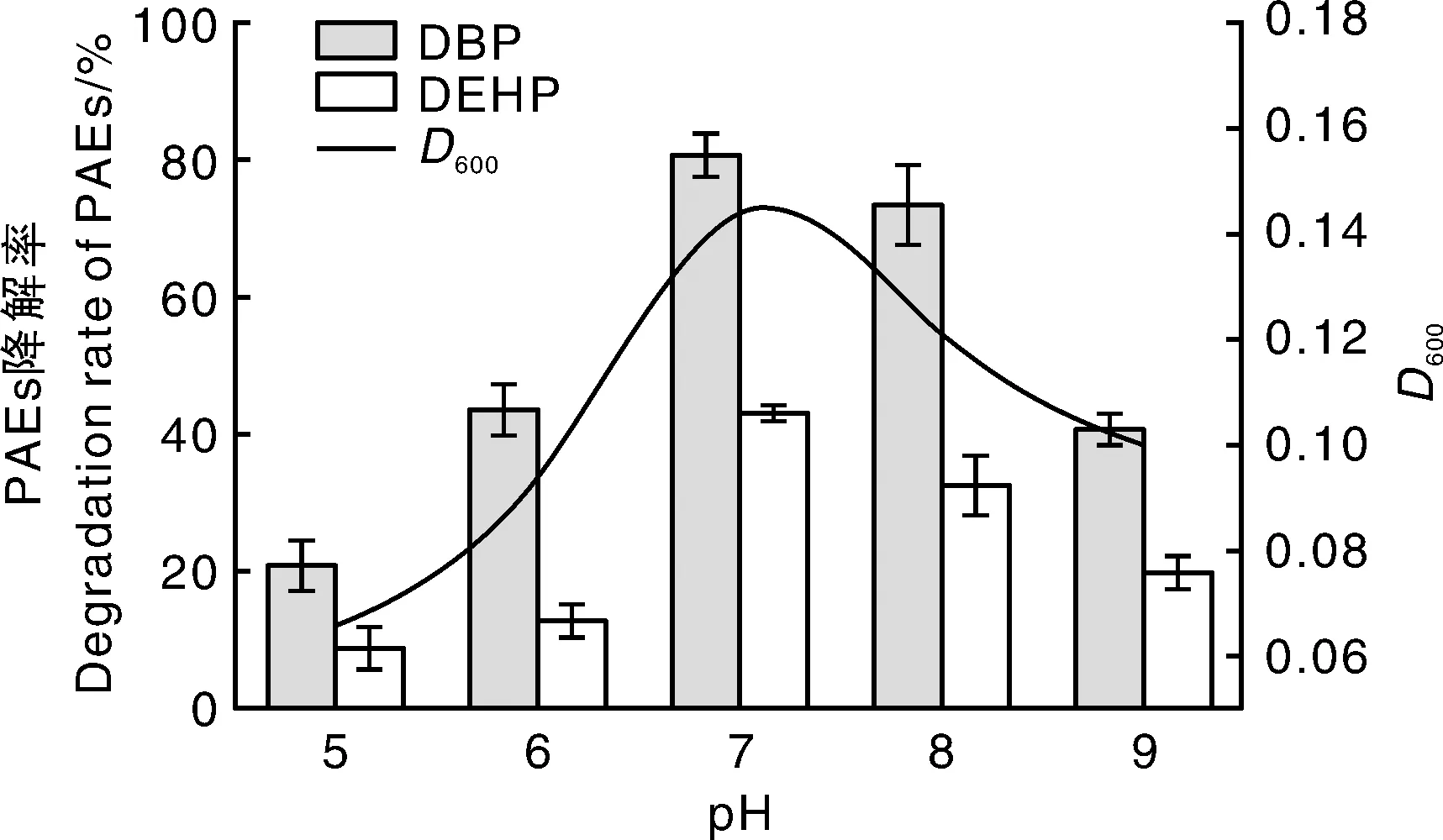
图5 pH对AS001生长及降解DBP和DEHP的影响Fig.5 Effect of pH on biodegradation of DBP and DEHP by AS001 and its growth
酸碱度是影响细菌生长的又一重要因素,pH能够影响菌株的酶活性、细胞膜的通透性和酶促反应速率,从而对菌株在转化有机污染物过程中的生理和生化性质产生影响[21]。由图5可知,总体上,菌株AS001对DBP的降解率高于对DEHP的降解率。菌株生长及对DBP和DEHP降解率随着pH的升高先增加后降低,在pH=7时DBP和DEHP的降解率达到最大,分别为80.87%和43.13%,且D600也最大,表明中性环境中菌株生长最好,降解效果最佳;pH超过7后,菌株生长及对DBP和DEHP的降解率均呈缓慢下降趋势,pH=8时,菌株的D600及对DBP和DEHP的降解率仍呈现较高值;pH>8时,菌株的D600及对DBP和DEHP的降解率呈明显下降趋势。说明该菌株可在pH为7~8条件下生长良好,在pH为5~6或者pH>8时,酶活性和酶促反应速率都会受到抑制,从而降低菌株对PAEs的降解。
2.3.3 初始浓度对AS001生长及降解DBP和DEHP的影响
初始浓度对菌株AS001生长及DBP和DEHP降解率的影响如图6所示,当底物浓度为50 mg·L-1,菌株对DBP和DEHP降解率分别为60.89%和30.95%;底物浓度为100 mg·L-1时,菌株的D600及对DBP和DEHP的降解率最大,D600为0.13,降解率分别为73.63%和42.58%;随着底物浓度的继续升高,菌株生长的D600及对PAEs的降解率显著下降。表明低浓度的PAEs可为降解菌株提供充足的碳源和能源以满足其生长代谢需求,但是高浓度PAEs环境会对降解菌产生一定的毒害作用,降低菌株对PAEs的降解能力[27]。在不同浓度条件下,DBP的降解率均大于DEHP,这可能与分子的大小和结构复杂程度有关[23]。一般而言,PAEs侧链越短,微生物降解效率越高,DEHP属于长链PAEs化合物,相对分子质量较大,但水溶性较低,辛醇-水分配系数较大,不容易被微生物降解;而DBP相对DEHP更容易被微生物降解[28-29]。

图6 初始浓度对AS001生长及降解DBP和DEHP的影响Fig.6 Effect of initial concentration on biodegradation of DBP and DEHP by AS001 and its growth
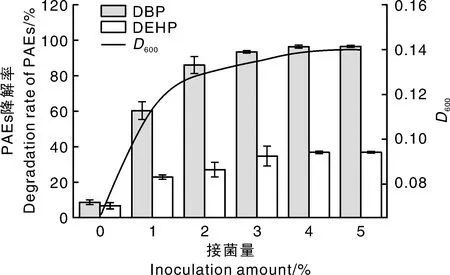
图7 接菌量对AS001生长及降解DBP和DEHP的影响Fig.7 Effect of inoculum size (V/V) on biodegradation of DBP and DEHP by AS001 and its growth
2.3.4 接菌量对AS001生长及降解DBP和DEHP的影响
不同接菌量对菌株AS001生长及对DBP和DEHP的降解率影响见图7。总体上,菌株对DBP的降解率高于对DEHP的降解率。接菌量为0时,D600为0.006,菌株对DBP降解率为8.57%,对DEHP的降解率为5.53%。作为空白对照处理,表明自然状态下转速等其他因素对DBP和DEHP的降解率会有影响,但影响效果较小,突出菌株对DBP和DEHP的降解效果明显。接菌量增至1%时,菌株生长速度,以及DBP和DEHP的降解率迅速提高;但接菌量由2%增至4%时,菌株生长及对DBP和DEHP的降解率缓慢增加,D600由0.13增加至0.14,对DBP的降解率由86.05%增长至96.63%,对DEHP的降解率由27.06%增长至35.69%,且两者降解率均达到最大;当接菌量增加至5%时,菌株生长及对DBP和DEHP的降解率基本稳定,DBP的降解率维持在96.6%左右,DEHP的降解率稳定在35.6%左右。主要原因是,PAEs作为碳源满足菌株的生长,随着接种量的增加,高浓度菌液中菌体自身的相互竞争,使得对DBP和DEHP的降解能力增加缓慢。
2.3.5 温度对AS001生长及降解DBP和DEHP的影响
温度是影响细菌生长的重要因素之一,它能够通过影响微生物的代谢活动,降低酶的活性及DBP和DEHP的溶解度,进而影响PAEs的降解效率[30]。菌株AS001对环境温度非常敏感,如图8所示,总体上,菌株对DBP的降解率高于对DEHP的降解率。15 ℃时,菌株AS001的D600为0.06,对DBP和DEHP降解率仅为26.19%和23%,随着温度升高,其D600和降解率逐渐增加,25~35 ℃时增加较快,35 ℃时菌株的D600为0.12,对DBP和DEHP的降解率也达到最大,分别为95%和73.65%,降解效果最佳。随着温度继续升高,菌株的生长及对DBP和DEHP的降解率迅速下降,到45 ℃菌株AS001降解能力受到限制,对DBP和DEHP的降解率仅为18%和16.62%。图8表明,菌株AS001的最佳培养温度为30~35 ℃,适宜温度菌株生长较快,生物量增加较快,还可以增加DBP和DEHP在水中的溶解度,菌株的可利用碳源得到一定程度的增加,促进其生长;而低温和高温时,菌株基本处于休眠状态,生长量不高,对PAEs的降解受到抑制[21]。
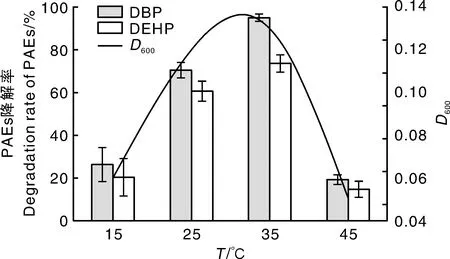
图8 温度对AS001生长及降解DBP和DEHP的影响Fig.8 Effect of temperature on biodegradation of DBP and DEHP by AS001 and its growth
3 结论
本研究从设施菜地土壤中分离得到了一株能够以邻苯二甲酸二丁酯(DBP)和邻苯二甲酸2-乙基己基酯(DEHP)有机污染物为唯一碳源和能源生长的细菌AS001,经过形态学特征、生理生化特征和16S rDNA序列系统学分析,初步鉴定该菌株为节杆菌(Arthrobactersp.)。菌株AS001的生长及对DBP和DEHP降解的最适宜条件为:175 r·min-1振荡培养,pH 7.0,初始浓度100 mg·L-1,接菌量4%,温度35 ℃。在最佳条件下,菌株AS001能高效利用DBP和DEHP作为碳源和能源进行生长,对DBP的降解率明显高于对DEHP的降解率。
