浙江省甘薯上发现瓜类细菌性果斑病菌
2019-08-14洪纤纤吴秀芹罗金燕王艳丽孙国仓安千里
洪纤纤,吴秀芹,罗金燕,王艳丽,孙国仓,安千里,邱 文,*,李 斌
(1.浙江大学 生物技术研究所,农业农村部作物病虫分子生物学重点实验室,浙江 杭州 310058; 2.上海市农业技术推广服务中心,上海 201103; 3.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
细菌性果斑病是当前危害瓜类作物的重要毁灭性检疫病害,其病原物为西瓜噬酸菌(Acidovoraxcitrulli,原Acidovoraxavenaesubsp.citrulli)[1]。自20世纪80年代开始,我国不断有人发现并报道西瓜细菌性果斑病,后来研究表明其病原物为西瓜噬酸菌。瓜类细菌性果斑病属于毁灭性的种传病害,在西瓜苗期和成株期均可发病,幼苗期染病瓜苗的子叶首先出现水渍状黄色小点并伴有晕圈,侵染植株真叶,受害初为水渍状的小斑点,水渍状病斑扩大后因受粗叶脉的限制扩展成暗色角斑或不规则坏死大斑;果实发育期首先在果皮上出现直径几毫米的水渍状凹陷斑点,此后扩展为圆形或不规则形,呈暗绿色斑块,后逐渐扩大汇集成片状并逐渐深入果肉,最后引起全果腐烂[2]。
目前尚未见到宁海县有西瓜果斑病害发生的报道,然而在2016年原农业部发布的《全国农业植物检疫性有害生物分布行政区名录》中在浙江台州与温岭出现瓜类果斑病菌。而甘薯茎腐病则是近年来在浙江19个县市区甘薯上发生严重检疫性细菌病害,引起极大重视[3]。据已有报道,田间常将甘薯与西瓜套种,该种植方式不仅能够保证甘薯产量有所提高,又可增加一季西瓜收入,经济效益十分显著[4-6]。但值得重视的是,本文在调查浙江宁海田间疑似甘薯茎腐病的过程中,对采集的病样进行病原物分离与纯化,获得4株烟草过敏反应阳性的分离物,进一步通过菌落形态观察、革兰氏染色反应、16S rRNA方法和致病性测定,将这些分离物鉴定为西瓜噬酸菌。
瓜类果斑病自然发病寄主范围广,包括西瓜、甜瓜、香瓜、黄瓜和南瓜等,但不能侵染马铃薯和甘薯[7]。作者通过致病性测定也发现这些分离物不能侵染甘薯,因此猜测可能是由于种子(苗)人为携带或者调运过程导致当地田间存在西瓜果斑病菌,因其未达到暴发的适宜外部环境,所以在当地尚未发现该病害;但与甘薯进行套种后导致病原物从西瓜传到非寄主植株甘薯上。本文详细报道了浙江省甘薯上检测到西瓜果斑病菌这一过程并结合当地实际提出了针对性的防控和检疫处理措施。
1 材料与方法
1.1 材料
1.1.1 发病样品及参考菌株
供试样品为浙江省宁海县田间采集的疑似甘薯茎腐的茎秆病样标本1;阳性对照菌株则是由浙江大学生物技术研究所植物细菌与检疫实验室保存的西瓜果斑病菌AcidovoraxcitrulliSD01及甘薯茎腐病菌Dicekyadadantii1501。
1.1.2 供试植物
致病性测定采用市售西瓜种子(8424麒麟瓜)培育后带1~2片子叶与真叶的西瓜苗,及在浙江金华采集的甘薯苗(浙773)。
1.2 方法
1.2.1 病原菌分离与纯化
将甘薯病样浸泡在70%乙醇中约30~60 s,进行表面消毒,用无菌水清洗3遍,在病健交界处用灭菌剪刀剪取大小为5 mm2的组织,剪碎后于无菌水中静置10~30 min,用接种环蘸取该组织液在NA培养基上划线,长出单菌落后再一次划线纯化,用于后续致病性测定及病原物的鉴定实验[8]。
1.2.2 菌落形态观察
挑取单菌落于NA培养基平板上划线,置于30 ℃恒温箱中培养48 h后,观察其菌落大小、形状、颜色、表面是否粗糙隆起、边缘是否规则等培养性状。
1.2.3 烟草过敏反应
将分离获得的14株菌株于30 ℃过夜培养,将其浓度统一调为108CFU·mL-1菌悬液,采用浸润法将菌液接种到烟草叶片上,在30 ℃下培养24 h,调查过敏性反应。
1.2.4 16S rRNA测定
将能引起烟草发生过敏反应的4株菌株配制成108CFU·mL-1菌悬液,用该菌液为模板,采用16S rDNA通用引物进行PCR扩增。通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′),由上海擎科生物技术有限公司合成。
PCR反应体系(50 μL):模板2 μL,上下游引物各2.5 μL,PCR Mix酶25 μL,无菌水18 μL。
PCR扩增程序:98 ℃预变性10 min;98 ℃变性20 s,55 ℃退火15 s,72 ℃延长10 s,35个循环;72 ℃延伸3 min,4 ℃保存。反应终止后,以DL 2 000 marker为对照,PCR产物上样于1%的预混有GelRed染料的琼脂糖凝胶上进行电泳,结束后于凝胶成像仪上拍照保存,PCR产物送至上海擎科生物技术公司测序,并与Ezbiocloud数据库中已知序列进行同源性对比。
1.2.5 特异性引物鉴定
特异性引物WFBl和WFB2来源于西瓜果斑病菌标准菌株16S rRNA,所处位置分别为293~310和652~669 bp,引物之间的片段长度为360 bp[9]。目前,国内外关于细菌性西瓜果斑病菌的PCR检测主要还是基于16S rDNA设计的引物WFBl、WFB2[10-11],引物核苷酸序列分别为WFB1(5′-GACCAGCCACACTCGGAC-3′)和WFB2(5′-CTGCCGTACTCCAGCGAT-3′),由上海擎科生物技术有限公司合成。
PCR反应体系(20 μL):模板1 μL,上下游引物各1 μL,PCR Mix酶10 μL,无菌水7 μL。
PCR扩增程序:98 ℃预变性10 min;98 ℃变性15 s,65 ℃退火15 s,72 ℃延长15 s,35个循环;72 ℃再延伸5 min,4 ℃保存。
为了增强引物特异性,提高检测鉴定准确率,陈新垲[12]通过比较燕麦噬酸菌西瓜亚种及其近缘种的ITS序列差异设计,筛选出了可用于燕麦噬酸菌西瓜亚种检测的特异引物TIF2和TIF3,该对引物正向起始于西瓜细菌性果斑病菌(Acidovoraxavenaesubsp.citrulliAAC00-1)全基因组的1 579 467 bp处,反向止于1 579 928 bp处,所扩增的片段为462 bp。引物核苷酸序列分别为TIF2(5′-GCTGGATCACCTCCTTTCTG-3′)及TIR3(5′-TGACGCAATCAAATTTTTGTCA-3′),由上海擎科生物技术有限公司合成。
PCR反应体系(20 μL):模板1 μL,上下游引物各1 μL,PCR Mix酶10 μL,无菌水7 μL。
PCR扩增程序:98 ℃预变性10 min;98 ℃变性15 s,56 ℃退火15 s,72 ℃延长15 s,35个循环;72 ℃再延伸5 min,4 ℃保存。
1.2.6 致病性测定
采用浸润法对健康的西瓜苗进行致病性测定,将SD01标准菌株与待测菌30 ℃培养12 h后,配成108CFU·mL-1菌悬液,用针筒吸取1 mL菌液,将针头拔出后采用浸润法将菌液接种于长出子叶和真叶的西瓜苗叶柄上,并以实验室所保存西瓜果斑菌株SD01作为阳性对照,以水作为阴性对照。此外,同时采用浸泡法[13]对甘薯苗进行致病性测定。把健康苗插入装有培养菌液的三角瓶中,将经过16 s初步筛选出的4株菌株与标准菌株进行过夜培养,配成108CFU·mL-1菌悬液,以无菌水作为阴性对照,接种后套袋保湿48 h(相对湿度90%~100%),置温度30 ℃,相对湿度80%的人工气候箱中培养,每隔12 h观察一次。
2 结果与分析
2.1 病原菌分离
本实验共获得14株病原菌株,编号为NH-01至NH-14,用于后续鉴定。
2.2 菌落形态和革兰氏染色
在NA平板上,菌落初期为透明小斑点,生长较慢,菌落凸起,边缘较整齐,后期菌落大小变化不大,革兰氏染色阴性。
2.3 烟草过敏反应
通过浸润法注射烟草叶片,编号为NH-01、NH-02、NH-04、NH-05的4株菌株均出现明显的烟草过敏反应。
2.4 16S rRNA测定分析
将通过PCR扩增获得4个菌株的16S rRNA产物进行电泳检测,结果显示,以DL 2000 marker为参照,该核苷酸片段约在1 400 bp处有一明亮条带,并无其他非特异性条带(图 2),即获得的目的DNA片段产量高,纯度好,可进行测序。将PCR产物送往上海擎科生物技术有限公司测序,测出的菌株16S rRNA基因序列大小约为1 390 bp,登录Ezbiocloud网站,将菌株的16S rRNA序列与数据库中亲缘关系相近的已知序列进行比较。结果表明,分离得到的NH-01、NH-02、NH-04、NH-05四个菌株与已报道的AcidovoraxcitrulliDSM 17060(T)分别具有99.93%、100.00%、99.93%、99.93%的同源性,同时用MEGA(6.0)软件采用邻接法构建系统发育树(图3),发现分离得到的4个菌株属于Acidovoraxcitrulli,确定了其系统发育地位。
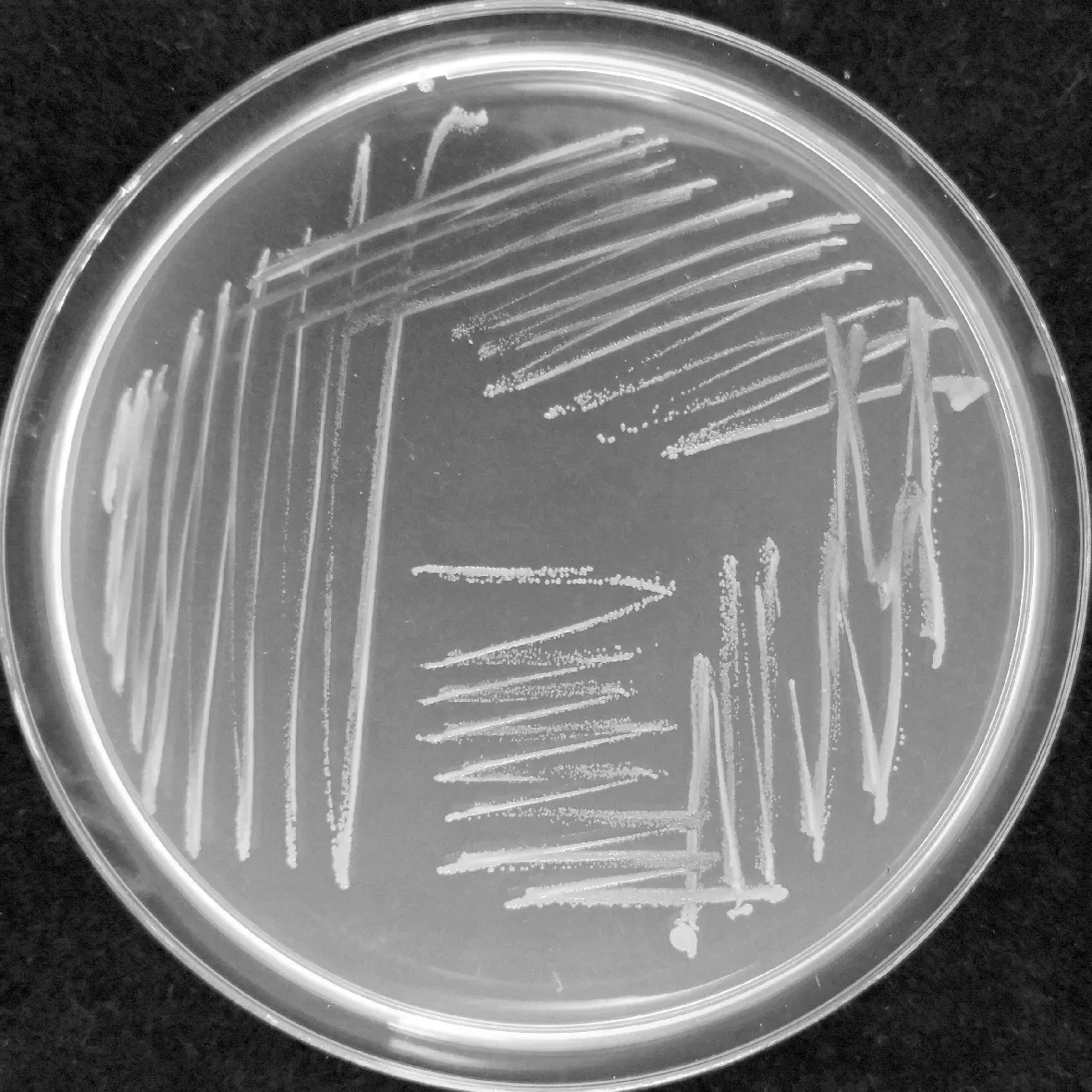
图1 细菌分离物在NA培养基上的菌落形态Fig.1 Morphological characteristics of the bacterial isolates on NA
2.5 特异性引物鉴定
PCR结果显示,本研究空白样品无条带,供试的其他菌株均扩增到条带,且大小与阳性对照菌株所扩增的条带一致(图4目的条带大小约360 bp。图5目的条带大小约462 bp),表明了细菌性西瓜果斑病菌的存在。
2.6 致病性测定
结果显示,阳性对照菌株SD01具有致病性(图6-A、图7-A),供试菌株在西瓜子叶首先出现水渍状黄色小点并伴有晕圈(图6-B),侵染西瓜真叶,受害初为水渍状的小斑点,水渍状病斑扩大后成暗色角斑(图7-C),取病斑的病健交界处又分离到了该菌株,实验证明了这些分离物确实是瓜类果斑病菌。另一方面,甘薯茎腐病菌菌株编号1501浸泡处理48 h,甘薯茎秆明显出现腐烂甚至断开;蒸馏水处理茎秆末端长出新根,无致病性;而分离物NH-01、NH-02、NH-04和NH-05处理并未发现明显症状,说明这些菌株对甘薯苗无致病性,甘薯为其非寄主植物(图8)。
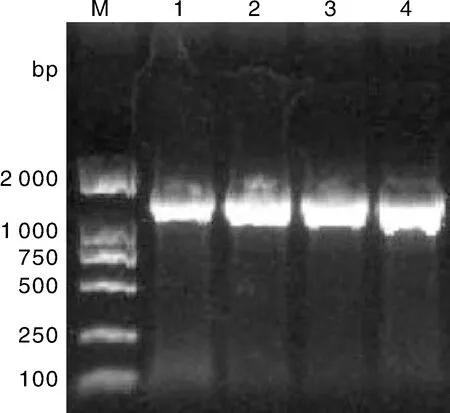
泳道M,DL 2 000 marker;泳道1,NH-01 16S rRNA扩增条带;泳道2,NH-02 16S rRNA扩增条带;泳道3,NH-04 16S rRNA扩增条带;泳道4,NH-05 16S rRNA扩增条带。Lane M, DL 2 000 marker; Lane 1, Gene band of NH-01 strain; Lane 2, Gene band of NH-02 strain; Lane 3, Gene band of NH-04 strain; Lane 4, Gene band of NH-05 strain.图2 16S rRNA PCR扩增产物电泳图Fig.2 Agarose gel electrophoresis of 16S rRNA PCR production

图3 分离菌株的系统发育地位Fig.3 Phylogenetic status of the isolate strain
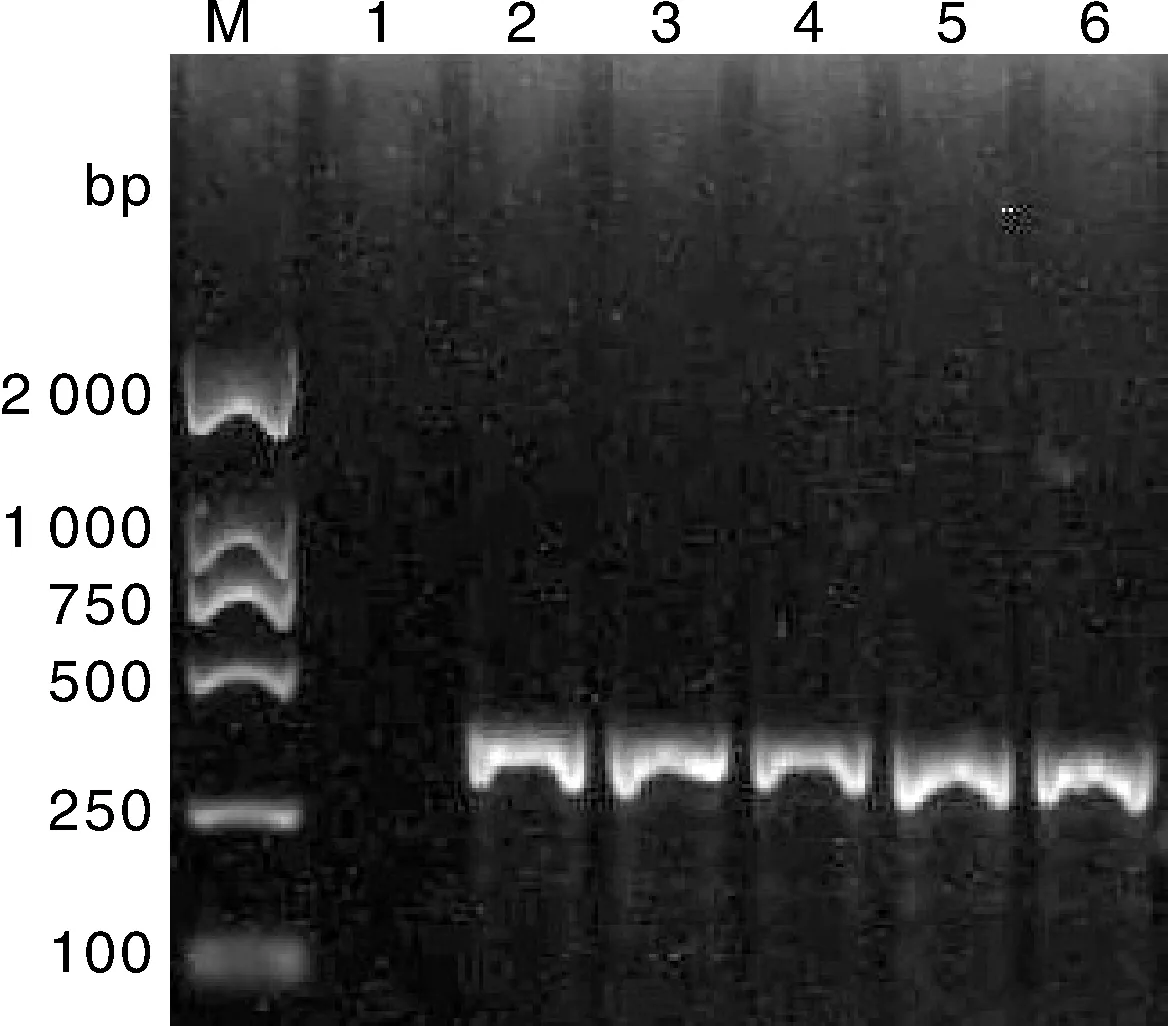
泳道M,DL 2 000 marker;泳道1,无菌蒸馏水(对照);泳道2,Acidovorax citrulli SD01菌株扩增条带;泳道3,NH-01菌株扩增条带;泳道4,NH-02菌株扩增条带;泳道5,NH-04菌株扩增条带;泳道6,NH-05菌株扩增条带。Lane M, DL 2 000 marker; Lane 1, Negative control; Lane 2, Gene band of Acidovorax citrulli SD01 strain; Lane 3, Gene band of NH-01 strain; Lane 4, Gene band of NH-02 strain; Lane 5, Gene band of NH-04 strain; Lane 6, Gene band of NH-05 strain.图4 特异性引物WFB1、WFB2扩增产物电泳图Fig.4 Agarose gel electrophoresis of amplification products with specific primers WFB1, WFB2
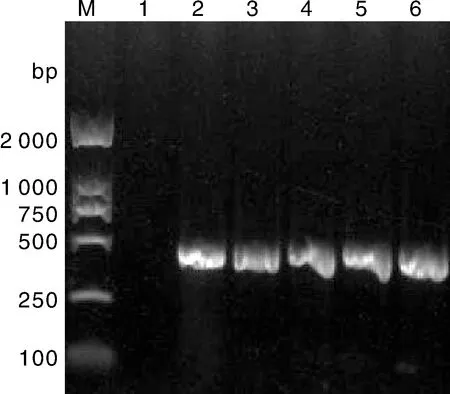
泳道M,DL 2 000 marker;泳道1,无菌蒸馏水(对照);泳道2,Acidovorax citrulli SD01菌株扩增条带;泳道3,NH-01菌株扩增条带;泳道4,NH-02菌株扩增条带;泳道5,NH-04菌株扩增条带;泳道6,NH-05菌株扩增条带。Lane M, DL 2 000 marker; Lane 1, Negative control; Lane 2, Gene band of Acidovorax citrulli SD01 strain; Lane 3, Gene band of NH-01 strain; Lane 4, Gene band of NH-02 strain; Lane 5, Gene band of NH-04 strain; Lane 6, Gene band of NH-05 strain.图5 特异性引物TIF2、TIR3扩增产物电泳图Fig.5 Agarose gel electrophoresis of amplification products with specific primers TIF2, TIR3

图A,右子叶为SD01,Acidovorax citrulli SD01,作阳性对照;图B,左子叶为双蒸水,作为阴性对照;右子叶为所分离菌株。Picture A, The right leaf: SD01, Acidovorax citrulli SD01, as the positive control; Picture B, The left leaf, Double distilled water, as the negative control; The right leaf, The isolated strains.图6 供试菌在西瓜子叶上的致病性测定Fig.6 Pathogenicity test for the subject strain on cotyledon of watermelon

图A,SD01,Acidovorax citrulli SD01,作阳性对照;图B,双蒸水,作为阴性对照;图C, 所分离菌株。Picture A, SD01, Acidovorax citrulli SD01, as the positive control; Picture B, Double distilled water, as the negative control; Picture C, The isolated strains.图7 供试菌在西瓜真叶上的致病性测定Fig.7 Pathogenicity test for the subject strain on euphylla of watermelon

1501,Dicekya dadantii 1501,为阳性对照;DDW,双蒸水,为阴性对照; NH-01, NH-02 , NH-04, NH-05为所分离菌株。Treatments: 1501, Dicekya dadantii 1501, as the positive control;DDW, Double distilled water, as the negative control; NH-01, NH-02, NH-04, NH-05 were the isolated strains.图8 不同处理下甘薯茎秆生长情况Fig.8 The growth of sweet potato stem under different treatments
3 讨论
3.1 病原菌来源
从宁海县疑似甘薯茎腐病样品1(采集于2018年8月2日)中分离出14株菌株,通过菌落形态观察、革兰氏染色、致病性测定、烟草过敏反应和16S rRNA序列分析,将其中4株菌株鉴定为西瓜果斑病菌,编号为NH-01、NH-02、NH-04、NH-05。首先,目前尚未见到宁海县有西瓜果斑病害发生的报道,那么病原菌是从何而来?据原农业部发布的植物检疫病害最新名录中显示,浙江台州与温岭已出现瓜类果斑病菌,因此猜测可能是由于种子(苗)带菌通过人为携带或者调运过程导致当地田间存在西瓜果斑病菌,但又因其未达到暴发的适宜外部环境,所以在当地尚未发现瓜类细菌性果斑病害;此外,据已有报道[4-6],将甘薯与西瓜套种既能保证甘薯产量有所提高,又可增加一季西瓜收入,从而达到双收效益。通过实地调查,在采集地点附近存在西瓜与甘薯进行套种现象,导致病原物从西瓜传到非寄主植株甘薯上。但是关于宁海西瓜果斑病原菌的初侵染来自何处还有待进一步研究。
3.2 防治措施
(1)加强检疫措施。各级植物检疫机构应严格采取产地检疫、调运检疫、市场检疫措施,加强瓜类作物育苗、生长期间监测与调查,对曾发生瓜类果斑病害的田块要加强跟踪,对疑似症状进行田间快速诊断。同时需在农户间普及瓜类果斑病的严重危害性和防控知识,增强农户检疫意识,提高其防控水平。当在田间发现有疑似症状的病株,立即拔除带到田外深埋,并采样送至植保站进行检测,及早确认疫情,并采取封控措施。
(2)加强种子管理。瓜类果斑病作为一种毁灭性的种传病害,应该加强引种审批,一旦查见病害,应及时指导生产者采取防控措施。首先要求瓜类作物的生产基地和种植大户必须通过正规渠道购买经检疫合格的种子,同时通过干热处理和药剂处理可降低种子带毒几率,比如用40%福尔马林150倍液浸种30 min后,用清水浸泡6~8 h,再催芽播种[14]。为了确保种子无携带病原物,应进行带菌检测。
(3)种植抗病品种。西甜瓜各品种间感病差异性较大。如甜瓜感病品种有皇后系列、86系列,抗病品种有西域系列等[7]。邢东光[14]研究表明,晚熟大型果花皮类西瓜庆发十二号较为抗病。因此,发病较重地区,可选用较抗病的西瓜品种减轻为害。
(4)做好农业防治。首先应在嫁接前用10%磷酸三钠、75%乙醇或肥皂水对工具进行消毒,防止人为交叉传播。其次是轮作换茬,应在瓜类集中种植区实行3年以上的轮作。再次是加强田间管理,做到合理密植,适量灌溉与施肥,防止病害传播。
(5)做好化学防治。使用溴甲烷进行土壤消毒处理,密封熏蒸后通风2~3 d揭膜后再进行播种或移栽。已经发病的大棚或露地田块可撒施石灰氮、生石灰或硝石灰,也可选用铜制剂或抗生素等药剂进行预防,如可杀得、噻菌铜等铜制剂,农用链霉素、四环素等抗生素[15]能够快速有效地杀死田间病原细菌。
瓜类果斑病是全国农业植物检疫性病害,浙江台州与温岭已出现瓜类果斑病菌,本文在浙江宁海甘薯上检出瓜类果斑病菌,显示随着农产品贸易的日益频繁,病害随瓜类作物种子(苗)调运传入浙江省其他市县的风险正在加大。
