胃饥饿素对衣霉素诱导成骨细胞内质网应激的影响
2019-08-12刘焕娜张砚华徐丽丽朱晓琳李华建王春芝杨乃龙
刘焕娜 张砚华 徐丽丽 朱晓琳 李华建 王春芝 杨乃龙*
1.青岛大学医学院附属医院内分泌科,山东 青岛 266000 2.青岛李沧区中心医院内二科,山东 青岛 266041 3.青岛市市立医院老年内科,山东 青岛 266071 4.海阳市人民医院神经外科,山东 烟台 265100 5.海阳市人民医院内分泌科,山东 烟台 265100
内质网是负责细胞内蛋白质合成、折叠、成熟和加工的重要细胞器。当细胞遭遇衰老、基因突变、营养缺失、病原体感染时[1],将会导致内质网中蛋白质的错误折叠或未折叠,这将会引起内质网管腔中蛋白质的累积,从而引发内质网应激(endoplasmic reticulum stress,ERS)[2],过度的ERS会诱导细胞凋亡。而成骨细胞内的ERS是发生骨质疏松的主要机制之一[3],但具体机制不清。
Ghrelin是主要分泌于胃底部泌酸粘膜区的一种胃肠道激素,其主要作用是促进食欲和生长激素的分泌,是生长激素促分泌受体(GHSR)的天然配体[4]。GHSR表达于不同组织,如大脑[5]、肾脏[6]和前列腺[7],同时也表达于成骨细胞,直接促进成骨细胞的增殖和分化[8]。动物实验和体外实验均以证明,ghrelin对骨形成具有保护作用[9]。在临床中发现,胃大部切除术后可迅速引起骨量减少,而不依赖于钙吸收不足等缺陷。说明ghrelin对体内的骨重建起到重要的作用[10]。本研究通过衣霉素诱导成骨细胞内质网应激模型,利用ghrelin预处理成骨细胞后,观察ghrelin对成骨细胞内质网应激的影响。
1 材料和方法
1.1 实验材料
小鼠前体成骨细胞MC 3T3-E1购于中科院上海细胞库;α-MEM培养基、胎牛血清购自美国GIBCO公司;胰蛋白酶、青链霉素混合液、二甲基亚砜(DMSO)、CCK-8试剂盒购自北京索莱宝公司;活性氧(ROS)测试盒购自南京建成生物工程研究所;引物由上海生工公司设计并合成;胃饥饿素由南京肽业生物科技有限公司合成;衣霉素购自美国Cayman Chemical公司;Trizol购自美国Sigam公司;反转录试剂盒、RT-PCR试剂盒购自日本Takara公司。
1.2 实验方法
1.2.1细胞培养:将MC3T3-E1细胞培养于含有10%胎牛血清、1%双抗的α-MEM培养基中,置于5% CO2、37 ℃条件的培养箱中培养,每2 d 换液1次,待细胞密度长至70%~80%时进行细胞传代。
1.2.2细胞活性检测:采用CCK-8法。取对数生长期状态良好的细胞以5000/孔的密度接种于96孔板中,每孔100 μL,待培养箱中培养24 h 贴壁后,更换含不同浓度衣霉素的完全培养基,根据衣霉素的浓度分为5组,即0μg/mL组、0.5μg/mL 组、1μg/mL组、1.5μg/mL组。每组4个复孔,另设调零孔。继续培养24 h后,每孔加入10 μL的CCK-8试剂,孵育4 h后用酶标仪测定450 nm波长处的吸光度(A值)。选取最敏感浓度1.5μg/mL的衣霉素浓度做后续的实验。为验证ghrelin对内质网应激的影响,用不同浓度的ghrelin(0、10-11、10-9、10-7mol/L)预处理细胞4 h 后再加入1.5μg/mL的衣霉素干预24 h,每组4个复孔,另设零孔。培养结束后,采用上述方法检测每孔吸光度。实验重复3次。ghrelin的合成序列见图1。
1.2.3胞内活性氧(ROS)测定:根据ROS检测试剂盒说明书进行检测。简言之,将生长状态良好的细胞以5000/孔的密度接种于96孔板中,孵育24 h贴壁后,分组方法同前,每组4个复孔。用无血清的培养液将荧光探针DCFH-DA稀释至10 μmol/L,去除细胞培养液,每孔加入50 μL的稀释的DCFH-DA,于培养箱中避光孵育45 min,用PBS洗涤细胞3次,以充分去除未进入细胞的DCFH-DA。用荧光酶标仪在488 nm激发波长、525 nm发射波长处检测荧光强度。实验重复3次。
1.2.4实时定量PCR检测:采用实时定量PCR 2-△△CT法。细胞以密度为105/孔接种于6孔板中,孵育24 h贴壁后,分组方法同上。每组设定3个平行孔。培养结束后,使用Trizol试剂常规提取细胞总RNA,测定其纯度、浓度并反转录为cDNA。总反应体系为25 μL,包括dd水8.5 μL、正反引物各1 μL、cDNA 2 μL、TB Green Premix Ex TaqII 12.5 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 60 s,40个循环。各基因引物序列及引物扩增片段长度见表1。

图1 酰化ghrelin的合成序列Fig.1 The synthetic sequence of acylated ghrelin

名称引物序列片段长度(bp)GRP78F:5′-GCCAACTGTAACAATCAA-3′R:5′-GCTGTCACTCGGAGAATA-3′165CHOPF:5′- GCTGGAAGCCTGGTATG-3′R:5′- CTTTGGGATGTGCGTGT-3′183Caspase-12F:5′-AAGGTAGGCAAGACTGGTTCC-3′R:5′-AATAGTGGGCATCTGGGTCA-3′147β-actionF:5′-CCTTCCGTGTTCCTACCC-3′R:5′-CCCAAGATGCCCTTCAGT-3′130
1.3 统计学处理
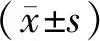
2 结果
2.1 衣霉素干预对细胞增殖活性的影响
与对照组相比,1.0 μg/mL和1.5 μg/mL的衣霉素干预24 h可明显降低成骨细胞的增殖活力和生存率(P<0.05),而0.5 μg/mL衣霉素干预24 h后对细胞增殖无明显影响(P>0.05)。见表2。根据以上结果,本实验决定用效果最明显的1.5 μg/mL的衣霉素进行后续的实验。

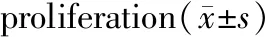

组别A570存活率(%)对照组0.989±0.036100Tm(0.5 μg/mL)0.905±0.01177.12Tm(1.0 μg/mL)0.619±0.028∗61.75∗Tm(1.5 μg/mL)0.444±0.043∗∗44.36∗∗
注:Tm:衣霉素;G:ghrelin;与对照组相比,*P<0.05,**P<0.01。
2.2 衣霉素干预对胞内ROS的影响
用不同浓度的衣霉素干预24 h后,胞内ROS的含量随着衣霉素浓度的增加而增加,与对照组相比明显升高(P<0.05),而1.5 μg/mL的衣霉素干预细胞24 h后胞内ROS的含量将近是空白对照组的2倍(P<0.001)。见图2。

图2 不同浓度的衣霉素对胞内ROS含量的影响注:与0μg/mL的衣霉素相比,*P<0.05,**P<0.01。Fig.2 Effects of different concentrations of tunicamycin on intracellular ROS content
2.3 衣霉素干预成骨细胞对BIP、CHOP、caspase-12表达的影响
与对照组相比,用不同浓度的衣霉素干预成骨细胞24 h后CHOP、BIP、caspase-12 mRNA的表达水平呈浓度依赖性增加。于CHOP mRNA的表达,不同浓度的衣霉素均有统计学意义(P<0.05)。于BIP和caspase-12 mRNA的表达,1.0μg/mL和1.5μg/mL的衣霉素干预24 h后有统计学意义(P<0.05),而0.5μg/mL的衣霉素干预24 h后无统计学意义(P>0.05)。见表3。

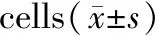

组别(μg/mL)CHOPBIPcaspase-12对照1.00±0.2311.00±0.1821.00±0.2370.515.68±0.470∗1.29±0.2971.57±0.3621.020.49±0.124∗5.71±0.673∗8.23±0.450∗1.527.48±0.205∗8.57±0.534∗10.23±0.471∗
注:与对照组比较,*P<0.05。
2.4 ghrelin预处理对衣霉素干预成骨细胞增殖的影响
与单纯1.5 μg/mL的衣霉素相比,用不同浓度的ghrelin预处理4 h后再加入衣霉素干预24 h可以使细胞增殖活力和存活率提高。10-9mmol/L和10-7mmol/L的ghrelin组细胞增殖活力和存活率明显提高(P<0.05),而10-11mmol/L的ghrelin组差异无统计学意义(P>0.05)。与对照组比,单纯加入不同浓度的ghrelin干预4 h后,细胞增殖活力和生存率无统计学意义(P>0.05),见表4。
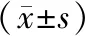
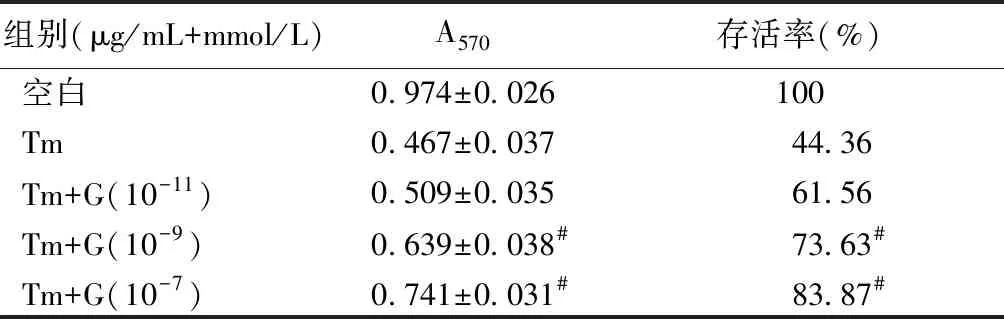
组别(μg/mL+mmol/L)A570存活率(%)空白0.974±0.026100Tm0.467±0.03744.36Tm+G(10-11)0.509±0.03561.56Tm+G(10-9)0.639±0.038#73.63#Tm+G(10-7)0.741±0.031#83.87#
注:与单纯1.5 μg/mL衣霉素相比,#P<0.05
2.5 ghrelin预处理对衣霉素干预成骨细胞胞内ROS的影响
与单纯1.5 μg/mL的衣霉素相比,用不同浓度的ghrelin预处理成骨细胞4 h后再加入衣霉素干预细胞24 h后,胞内ROS的含量随着ghrelin浓度的增加而减少。用10-11mmol/L的ghrelin预处理后,差异有统计学意义(P<0.05),而10-9mmol/L和10-7mmol/L组的ghrelin预处理后差异有明显的统计学意义(P<0.001)。与对照组相比,单纯ghrelin干预成骨细胞4 h,胞内ROS的含量差异无统计学意义(P>0.05),见图3。

图3 不同浓度的ghrelin预处理对衣霉素干预细胞后胞内ROS含量的影响注:与单纯1.5 μg/mL衣霉素相比,#P<0.05,##P<0.01。Fig.3 Effects of pretreatment with different concentrations of ghrelin on intracellular ROS content after tunicamycin intervention
2.6 Ghrelin预处理对衣霉素干预成骨细胞CHOP、BIP、caspase-12 mRNA表达的影响
与单纯1.5 μg/mL的衣霉素相比,不同浓度的ghrelin预处理后均可降低由衣霉素引起的CHOP、BIP、caspase-12 mRNA表达的增高,对于CHOP mRNA的表达,在10-11mmol/L ghrelin干预4 h后无统计学意义(P>0.05),呈现与单纯衣霉素干预组相反的趋势(均P<0.05)。见表5。
表5不同浓度的ghrelin预处理对衣霉素干预细胞后对CHOP、BIP、caspase-12 mRNA表达的影响
Table5Effects of pretreatment with different concentrations of ghrelin on the expression of CHOP, BIP, and caspase-12 mRNA in the cells

组别CHOPBIPcaspase-12对照组1.00±0.3251.00±0.0601.00±0.352Tm27.48±0.2058.57±0.62210.23±0.471Tm+G(10-11mmol/L)23.51±0.3365.45±0.546∗7.89±0.358∗Tm+G(10-9mmol/L)18.87±0.452∗2.21±0.223∗5.08±0.219∗Tm+G(10-7mmol/L)9.06±0.209∗1.19±0.856∗2.67±0.177∗
注:Tm:1.5 μg/mL衣霉素;G:ghrelin;与单纯1.5 μg/mL衣霉素相比,*P<0.05。
3 讨论
ghrelin是1999年由日本科学家Kojima发现的含有28个氨基酸的多肽激素,主要分泌于胃底部泌酸粘膜区的X/A细胞,另在垂体、下丘脑、肺、肾脏、睾丸、卵巢中少量分泌[11-12]。ghrelin最初发现是作为内源性生长激素促泌受体(GHSR)的天然配体,其主要作用是促进食欲和生长激素的分泌。因GHSR广泛表达于多种组织中,其生物作用非常广泛,可促进胃蠕动和胃酸的分泌[13],与味觉[14]、压力和焦虑[15]、葡萄糖的代谢[16]、心脏的输出[17]和骨形成[8]有关。近年来随着对ghrelin的深入研究,越来越多的证据证明ghrelin和骨质疏松之间存在着密切的关系。Nouh等[18]以绝经前、围绝经期和绝经后妇女为研究对象,对其进行骨矿物质密度(BMD)和ghrelin水平的测定。发现与绝经前组相比,围绝经期和绝经后组的平均血浆ghrelin水平和BMD显著下降,且ghrelin与BMD之间存在显著的正相关,证明ghrelin可以影响BMD,但具体机制不清。有学者认为ghrelin有可能是骨骼的潜在促进因子[19-20]。Yu等[21]观察到,对30位病态肥胖患者进行胃旁路手术,20位肥胖患者进行假手术。2年后手术组比假手术组脊柱和髋部BMD均明显下降,且两组中血钙、维生素D和甲状旁腺素(PTH)水平保持稳定,BMD下降原因具体机制不清,因胃旁路手术后阻断胃底部血运,致ghrelin分泌减少。所以考虑是因ghrelin水平降低所导致的。但至今研究甚少,需进一步研究证明。
内质网是细胞内负责蛋白质合成、折叠、运输的重要细胞器,当细胞内未折叠或错误折叠蛋白质的量超过内质网处理能力后即会发生内质网应激。活性氧(ROS)是生物代谢的衍生物,可破坏并氧化蛋白质、脂质和DNA,导致细胞功能改变,促进骨质的流失引起骨质疏松[22]。据报道,ROS是导致内质网中错误蛋白折叠的主要原因[23]。观察性研究发现,骨质疏松患者和去卵巢成年大鼠的ROS和BMD值之间呈负相关[24]。适度的内质网应激可以保护细胞的功能,而过度的内质网应激则促进细胞的凋亡。在内质网中存在三种跨膜蛋白,分别是蛋白激酶激酶RNA样内质网激酶(protein kinase RNA-like endoplasmic retieulum kinas, PERK),IRE1(inositol requiring kinase 1)、活化转录因子6(activating transcription factor 6,ATF6)。正常情况下,三种跨膜蛋白和分子伴侣免疫球蛋白结合蛋白/葡萄糖调节蛋白78(immunoglobulin binding protein,BIP/glucose-regulated protein 78,GRP78)结合,使其失去活性[25]。当适度的内质网应激时,BIP从三种跨膜蛋白中解离并活化PERK、IRE1、ATF6,启动内质网应激的保护作用[26]。当持续或过度的内质网应激时,细胞已不能恢复功能,则通过CHOP途径、caspase-12途径、JNK途径诱导细胞凋亡[27]。内质网应激与许多疾病有关。包括癌症[28]、神经性疾病[29]、糖尿病[30]、心脏病[31]、肝脏疾病[32]和骨质疏松症[3]。而成骨细胞中内质网应激是发生骨质疏松的重要机制之一[3,33],但在成骨细胞中有关ghrelin和内质网应激的关系研究甚少。
本研究是探究ghrelin是否可以抑制成骨细胞内质网应激来预防骨质疏松的发生。以MC3T3-E1为研究对象,通过1.5 μg/mL的衣霉素干预成骨细胞建立内质网应激模型,测定成骨细胞的增殖活力,胞内ROS的含量、内质网应激标志性基因的表达含量能反映内质网应激的发生。然后用不同浓度的ghrelin预处理细胞4 h后,用同样方法检测上述指标。结果发现,ghrelin预处理后细胞的存活率升高,胞内ROS的含量和内质网应激相关标志性基因表达量降低,说明ghrelin可以改善成骨细胞的内质网应激。已经提出一种ghrelin改善细胞中内质网应激的机制,即ghrelin增加细胞内抗氧化活性[34],我们的数据显示ghrelin可以降低衣霉素诱导后胞内ROS的含量,表明ghrelin可以上调细胞内抗氧化酶或ghrelin即具有抗氧化活性。一项研究[35]发现,ghrelin可以改善由内质网应激诱导的大鼠心肌损伤和凋亡,其可能通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK),AMPK作为燃料传感器,调节细胞和全身的的能量平衡。也有研究[36]认为,ghrelin的保护作用是由刺激GHSR所介导的,但具体下游机制还未确定。但有待于观察ghrelin是否通过AMPK改善成骨细胞中的内质网应激。现已证明ghrelin可以改善心肌细胞中的内质网应激,防止动脉粥样硬化的发生[17]和缺血再灌注损伤[37]。ghrelin还可改善由高水平的亚硫酸盐诱导的内质网应激[38]。在成骨细胞中,已证明ghrelin可以改善氧化应激带来的细胞的凋亡[39]。虽现对ghrelin对成骨细胞内质网应激的研究甚少,但不能否定其价值。尤其对于骨质疏松的治疗,不仅可以促进成骨细胞的增殖和分化,同时抑制细胞的凋亡,为骨质疏松的治疗提供新的方案,但需要更多的试验进行验证。
