补正续骨丸对去卵巢大鼠骨量及其相关骨折的作用机制研究
2019-08-12于岩松柳椰那俊夫于冬冬杨鸫祥
于岩松 柳椰 那俊夫 于冬冬 杨鸫祥*
1.沈阳市骨科医院,沈阳市骨科医院承基医院,辽宁 沈阳 110032 2.辽宁中医药大学附属医院,辽宁 沈阳 110032
绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)是原发性骨质疏松症主要类型,其骨折发生率高[1],老年PMOP在髋部及脊柱的骨质疏松性骨折5年后生存率不到60%[2]。其致死原因为患者长期卧床出现如坠积性肺炎、下肢深静脉血栓形成等并发症。PMOP患者骨量丢失严重,对内固定物把持力弱,手术失败率高[3]。补正续骨丸在我院应用半个世纪,对骨质疏松症有一定的疗效[4-7],但对PMOP及相关骨折的作用及机制还不清楚,本研究对补正续骨对PMOP及相关骨折的作用及潜在机制进行研究,为临床应用该药治疗PMOP及相关骨折提供实验依据。
1 材料和方法
1.1 材料
1.1.1实验动物:SD大鼠由辽宁长生生物技术有限公司提供,共100只,均为健康雌性大鼠,体重为180±20 g,许可证:SCXK(辽)2015-0001。辽宁中医药大学附属医院动物实验伦理委员会审核通过。
1.1.2主要实验药物与试剂:本实验所用实验药品均源于辽宁中医药大学附属医院,补正续骨丸由沈阳金竹药业有限公司生产,组成:首乌(制)25 g、鹿茸 15 g、煅自然铜 40 g、骨碎补 30 g、续断 30 g、枸杞 20 g、菟丝子 15 g、香橼、鸡血藤、合欢、乌贼骨各 15 g;骨疏康颗粒由辽宁康辰药业有效公司生产,批号:160919;接骨七厘胶囊由湖南金沙药业有限公司生产,批号:Z20053999;雷帕霉素(分装)由上海MKL生化科技有限公司生产,批号:K1089;阿仑膦酸钠产于上海MKL生化科技有限公司,批号:A801267。
EDTA脱钙液(AR1071,中国),P1NP ELISA试剂盒(m1002251,中国),β-CTX ELISA试剂盒(m1038002,中国),P70S6K一抗(bs-0295G-HRP,美国),4EBP-1一抗(bs-0885G-HRP,美国),羊抗兔二抗(bs-0 195 A-HRP,美国),DAB显色试剂(KIT9710,中国)。
1.1.3实验仪器:骨密度仪(Straros DR,法国),光学显微镜(Nikon MODEL YS100,日本),酶标仪(Infinite F50,中国),脱水机(LEICA 300,德国),恒温箱(DHG-9 070 A,中国),电热恒温箱(101-0-BS,中国)。
1.2 实验方法
1.2.1动物模型制备及分组:大鼠称重后采取0.7%水合氯醛溶液(5 mL/kg)腹腔麻醉,麻醉成功后,消毒、备皮,剃除大鼠背部毛发约3 cm×3cm,碘伏消毒。采取纵向切口,切口起自大鼠双侧肋下缘连线中点,长约2 cm,将切口拉向左侧,于背部旁开2 cm、肋下1 cm处依次剪开筋膜、肌肉,进入腹腔,切口长约0.5 cm,暴露子宫角,组织镊夹持卵巢,缝合线结扎子宫角,剪除卵巢、缝合线,对侧操作同上。冲洗、消毒、逐层缝合。术后3日予头孢呋辛(70 mg/kg)每日一次肌注以预防感染。术后3日每日更换垫料。摘除大鼠双侧卵巢(图1a),造模成功6周后,腹腔注射麻药,采用双能X线骨密度仪测量大鼠股骨BMD(图1b)。结果见表1,说明造模成功。

图1 大鼠卵巢摘除及骨密度检查a.大鼠卵巢摘除, b.正常组、模型组、假手术组大鼠骨密度检查Fig.1 a, area of ovariectomy in rats, b, bone mineral density scan in rats (normal group, model group, and sham operation group)
Table1BMD was measured 6 weeks after removal of the ovary

组别数量BMD/(g/cm2)正常组 100.243±0.012△模型组 800.190±0.022假手术组100.242±0.009△
注:与模型组比较,△P<0.05。
将大鼠随机分为正常组、模型组、假手术组、中药组(高、中、低)、骨疏康、接骨七厘胶囊、雷帕霉素组(通路抑制剂组)、阿仑膦酸钠10组,每组10只。中药组以常规剂量作为中剂量,高∶中∶低=2∶1∶1/2,每日2次,雷帕霉素予8 mg/(kg.2 d)腹腔注射。骨疏康、接骨七厘胶囊予人体等效剂量为0.315 g、0.038 g,正常组、模型组、假手术组予等量蒸馏水灌胃。每周称重调整给药量。
1.2.2骨密度仪测量大鼠股骨BMD:大鼠造模成功后,按计划给药6周,予腹腔麻醉后测量大鼠股骨BMD。观察各组在用药后BMD差别。
1.2.3HE染色观察大鼠股骨组织形态计量学指标:取大鼠股骨组织,固定、脱水、封闭、切片。每组选择4张完整载玻片进行HE染色,选取合适大小盖玻片用树胶完成封片、镜检。
1.2.4ELISA检测法检测大鼠外周血血清中β-CTX、P1NP含量的影响:抽取大鼠腹主动脉血并制备血清。在96孔板上设置标A孔为标准品孔,依次在标准品孔加入标准品浓度为0、0.5、1、2、4、8倍浓度的标准品50 μL。设置B-G行为待测样品孔,分别为正常组、模型组、中药组(中)、骨疏康组、阿仑膦酸钠组、雷帕霉素组,H行为空白孔,每组12孔以保证可重复性。加稀释液40 μL、样品10 μL,除空白孔外,加入酶标试剂100 μL。通过标准曲线计算样品中CTX、P1NP含量。
1.2.5免疫组化测定大鼠胫骨组织中4EBP-1、p70S6K蛋白表达:组织脱蜡成功后行抗原修复、内源性过氧化物酶封闭、非特异性抗原封闭。以试剂2作为抗原稀释液一抗孵育,以试剂3行二抗孵育,以试剂4行过氧化物酶标记。显色剂显色后加入苏木素复染。树胶封片、镜检。
1.2.6Western-blot测定大鼠胫骨样本中蛋白含量:取150 mg大鼠胫骨组织样本,加入细胞裂解液提取蛋白,BCA法测定蛋白浓度。制备上样蛋白、配胶。20 μg蛋白样品进行电泳,电泳结束后调整电压至90 V转膜至PVDF膜上。37 ℃封闭1 h、一抗4 ℃孵育过夜。辣根过氧化物酶(HRP)标记的稀释二抗孵育。ECL发光法曝光成像,扫描入电脑。Image J软件测定平均灰度值。
1.2.7观察各组大鼠骨折愈合时间及骨痂密度:大鼠摘除卵巢6周后,进行骨折造模。给药后,大鼠腹腔麻醉后测量大鼠骨痂区的骨密度及骨折骨性愈合时间。观察各组在用药后骨痂区密度、愈合时间的差别。
1.3 统计学处理
2 结果
2.1 骨密度仪测量大鼠股骨BMD
股骨骨密度:与正常组相比,模型组、雷帕霉素组(通路抑制剂)骨密度明显降低,P<0.05;与模型组组相比,中药组骨密度明显上调,P<0.05;中药组中剂量骨密度高于高、低剂量组。

表2 给药后各组去卵巢大鼠骨密度Table 2 BMD after drug administration
注:与正常组比较,▲P<0.05;与模型组比较比较,△P<0.05;与阿仑膦酸钠组比较,★P>0.05,☆P<0.05。

图2 给药后各组去卵巢大鼠骨密度Fig.2 BMD after drug administration
股骨骨密度:与正常组相比,模型组、雷帕霉素组(通路抑制剂)骨密度明显降低,P<0.05;与模型组相比,中药组骨密度明显上调,P<0.05,;中药组中剂量骨密度高于高、低剂量;与阿仑膦酸钠组相比,中药组骨密度差异不具有统计学意义,P>0.05。
2.2 补正续骨丸对去势大鼠股骨组织形态计量学指标的影响
通过骨组织切片染色,比较各组骨小梁数量和形态。骨组织形态显微Mimics图像分析:制作股骨髁部松质骨的HE染色切片后(图3),每个切片随机选择一个视野,在Mimics图像处理与分析系统中进行骨小梁面积测量(表3)。
由图3可见,正常组骨小梁分布均匀、连续完整。模型组、雷帕霉素组骨小梁分布稀疏,且有部分连续性中断。中药组骨小梁分布较模型组密集、均匀,无明显断裂;较骨疏康组分布均匀,断裂少;较阿仑膦酸钠组,骨小梁宽度增宽。
由表3、图4可见,与正常组相比,模型组、雷帕霉素组(通路抑制剂)骨小梁面积明显降低,P<0.05;与模型组相比,中药组骨小梁面积明显上调,P<0.05;与阿仑膦酸钠组相比,中药组骨小梁面积明显上调,P<0.05。
2.3 ELISA法检测补正续骨丸对去势大鼠外周血血清中β-CTX、P1NP含量的影响
根据样品OD值计算标准曲线(图5)。
P1NP测量结果显示,模型组较正常组明显降低,P<0.05。各给药组与模型组比较差异无统计学意义(P>0.05),说明中药组对P1NP水平无明显影响。
β-CTX测量结果显示,正常组与假手术组差异无统计学意义(P>0.05),与正常组比较,模型组CTX显著升高。各给药组与模型组比较,β-CTX水平不同程度降低(P<0.05),说明各治疗组药物均能不同程度降低β-CTX水平。与模型组比较,中药组β-CTX水平显著降低,补正续骨丸高剂量组与中、低剂量组β-CTX水平差异有统计学意义。说明补正续骨丸中、低剂量组能够降低CTX水平,补正续骨丸高剂量组对β-CTX水平影响小于中低剂量。与骨疏康组比较,补正续骨丸中、低剂量组β-CTX水平升高,说明补正续骨丸中、低剂量对β-CTX水平抑制作用强于骨疏康(见表4、图6)。

图3 各组骨小梁HE染色(10×10)A正常组、B模型组、C中药中剂量组、D骨疏康组、E阿仑膦酸钠组、F雷帕霉素组。Fig.3 HE staining of trabecular bone in each group (10×10 times)A, normal group, B, model group, C, medium-dose Chinese medicine group, D, Gushukang group, E, Alendronate group, F, rapamycin group.
Table3Ratio of trabecular bone area after drug administration
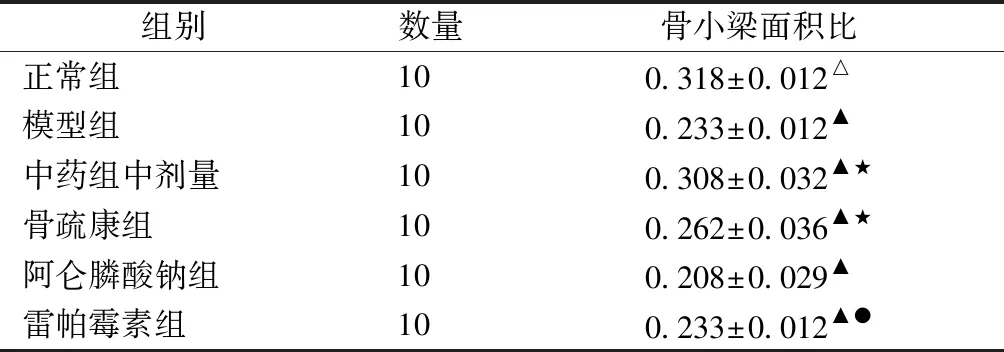
组别数量骨小梁面积比正常组100.318±0.012△模型组100.233±0.012▲中药组中剂量100.308±0.032▲★骨疏康组100.262±0.036▲★阿仑膦酸钠组100.208±0.029▲雷帕霉素组100.233±0.012▲●
注:与正常组比较,▲P<0.05,■P>0.05;与模型组比较,△P<0.01,●P>0.05;与西药组比较,★P>0.05,☆P<0.05。

图4 给药后各组骨小梁面积比Fig.4 Ratio of trabecular bone area after drug administration

图5 β-CTX、P1NP标准曲线β-CTX标准曲线(Y=2.6769X-0.1941)P1NP标准曲线(Y=1.9714X-0.063)Fig.5 The standard curve of β-CTX and P1NP



组别β-CTXP1NP正常组3.21±0.2110.96±0.22模型组3.58±0.18▲8.44±0.68▲中药组中剂量2.51±0.17△☆8.45±0.19△★骨疏康组3.04±0.33△☆8.89±0.61△★阿仑膦酸钠组3.56±0.20●10.74±0.29●雷帕霉素组3.06±0.37△8.78±0.48△

图6 大鼠外周血情中β-CTX、P1NP水平注:与正常组比较,▲P<0.05,■P>0.05;与模型组比较比较,△P <0.05,●P>0.05;与西药组比较,★P>0.05,☆P<0.05。Fig.6 The concentration of P1NP and beta -CTX in peripheral blood of rats
2.4 WB检测4EBP-1、p70S6K蛋白量
正常组的蛋白的相对含量为1,各实验组与正常组进行比较,计算得出比值。与正常组比较,模型组p70S6K、4EBP1相对灰度值表达显著升高(P<0.05),差异具有统计学意义,说明模型对照组p70S6K、4EBP1的表达显著升高。与模型组相比,补正续骨丸中剂量组相对灰度值降低(P<0.05),说明补正续骨丸能够降低p70S6K、4EBP1的表达。中药组与雷帕霉素组比较,补正续骨丸中剂量组p70S6K、4EBP1相对灰度值升高,说明补正续骨丸中剂量对p70S6K、4EBP1抑制作用弱于雷帕霉素(图7、表5)。

图7 4EBP1、p70S6K蛋白表达A正常组、B模型组、C中药中剂量组、D雷帕霉素组。Fig.7 4 EBP1,p70S6K expression from left to right, A, normal group, B, model group, C, medium-dose group, D, rapamycin group.
Table5Comparison of protein expressions of 4EBP1 and p70S6K (relative gray value)

组别4EBP1p70S6K正常组0.147±0.0120.145±0.017模型组0.418±0.072▲0.408±0.055▲补正续骨丸(中)0.308±0.033△★0.366±0.018△☆雷帕霉素组0.266±0.029△0.242±0.020△
注:与正常组比较,▲P<0.05;与模型组比较,△P<0.05;与雷帕霉素组比较,★P>0.05,☆P<0.05。
2.5 补正续骨丸对去势大鼠骨质疏松性骨折的影响
大鼠摘除卵巢6周后,进行骨折造模(图8、图9)。成功造模后,各组按计划连续给药6周,观察各组在用药后骨痂区密度、愈合时间的差别。

图8 A、B大鼠造模操作,C股骨DR,D内固定(取出)Fig.8 A, B, rat model operation, C, femur DR, D internal fixation (taken out)

图9 大鼠股骨骨折骨性愈合DR(箭头标记处A未拆除内固定,B拆除内固定)Fig.9 Bone-healing DR of rat femur fractures (A internal fixation not being removed, B internal fixation being removed)
与正常组相比,模型组骨痂密度明显降低,P<0.01;与模型组相比,中药组骨痂密度明显上调,P<0.05;与中药对照组相比,中药组骨痂密度差异不具有统计学意义,P>0.05,(表6)。
表6补正续骨丸对骨质疏松大鼠骨痂密度的影响
Table6Effect of Buzhengxug pill on osteophyte density in osteoporotic rats

组别数量BMD/(g/cm2)正常组90.218±0.012模型组80.190±0.020▲补正续骨丸(中)90.215±0.008△☆接骨七厘组90.211±0.010
注:与正常组比较,▲P<0.05;与模型组比较,△P<0.05;与接骨七厘组比较,★P>0.05,☆P<0.05。
与正常组相比,模型组骨折愈合时间明显延长,P<0.05;与模型组相比,中药组骨折愈合时间明显缩短,P<0.05,;与中药对照组相比,中药组骨折愈合时间差异不具有统计学意义,P>0.05,(表7)。
表7补正续骨丸对骨质疏松大鼠股骨骨折愈合时间的影响
Table7Effect of Buzhengxugu pill on the healing time of femoral fracture in osteoporotic rats

组别数量愈合时间/(d)正常组954±2.5模型组864±2.1▲补正续骨丸(中)960±1.4△☆接骨七厘组959±2.5★
注:与正常组比较,▲P<0.05;与模型组比较,△P<0.05;与接骨七厘组比较,★P>0.05,☆P<0.05。
3 讨论
骨形成作用和骨吸收作用之间的动态平衡是维持骨骼健康的关键因素[8]。雌激素分泌减少导致的骨吸收能力增强,是绝经后骨质疏松的主要因素[9-10]。雌激素通过调节自噬而调节骨折端血管内皮及成骨细胞增殖促进骨折愈合[11]。成骨细胞分泌骨保护素亦受到雌激素调控[12],雌激素可调节破骨细胞凋亡[13]。骨折愈合起初由破骨细胞吞噬坏死骨细胞,随后破骨细胞通过自噬活性逐步降低,成骨细胞活性升高。
研究发现抑制 mTOR1信号通路可对成骨及破骨细胞增殖有一定的影响[14]。自噬在代谢性骨病发病中发挥重要作用[15],与自噬影响细胞生长、存活、分化和细胞自身稳态密切相关,ROS-AKT-mTOR1信号轴在信号轴也参与调节细胞凋亡和增殖[16]。Alvarez-Garcia等[17]给4周70 g左右的雄性大鼠,腹腔注射Rapamycin [2 mg/(kg/day)]两周,发现通过雷帕霉素抑制mTOR1通路能明显减少生长板中破骨细胞的数量。与此同时,mTOR1通路亦可通过调节破骨细胞的数量促进软骨生成[18],也涉及促红细胞生成诱导成骨[19]。
本文通过实验证实补正续骨丸对PMOP有一定的防治作用。其能够降低大鼠血清中β-CTX水平从而抑制骨吸收。然而,其对P1NP无明显影响,说明补正续骨丸对骨形成无明显影响。PMOP的发生可升高mTOR1信号通路中p70S6K、4EBP1的表达,然而我们通过实验证实:补正续骨丸可以抑制mTOR1信号通路中p70S6K、4EBP1的表达,继而促进骨质疏松性骨折的愈合,提升骨痂密度。
综上所述,本研究对补正续骨丸治疗PMOP及骨质疏松性骨折进行研究,结果表明补正续骨丸对PMOP及骨质疏松性骨折有一定的防治作用,并且是通过调节自噬相关mTOR1信号通路p70S6K、4EBP1的表达来抑制骨吸收来实现的,为补正续骨丸用于临床防治PMOP提供新的理论基础。
