2,3,7,8-四氯二苯并对二噁英对骨代谢的影响及机制的研究进展
2019-08-07彭诗意郭晓英
彭诗意 郭晓英
1.中国医科大学第一临床学院,辽宁 沈阳 110122 2.中国医科大学公共卫生学院,辽宁 沈阳 110122
骨组织由骨祖细胞、成骨细胞、破骨细胞和骨细胞及骨基质构成,成骨细胞可通过分泌碱性磷酸酶(alkaline phosphatase,ALP)等调节骨组织的生成,而破骨细胞能释放多种有机酸、水解酶溶解和吸收骨组织,骨重建依赖于这两种细胞之间的动态平衡,从而保持正常的骨强度[1]。作为骨代谢的重要特征之一,骨重建受多种因素的调节,如甲状旁腺素、骨形成蛋白(bone morphogenetic protein,BMPs)、环境污染物[2]等,内分泌因子的缺乏以及内分泌干扰物的毒性作用可造成骨量丢失,引发如类风湿性关节炎、骨质疏松等骨疾病[3]。
二噁英是一类内分泌干扰物,主要来源于各种燃烧过程,如吸烟、城市和工业垃圾的焚烧等,广泛存在日常环境中。TCDD被认为是毒性最强的二噁英类化合物,研究发现,TCDD有肝毒性、致癌性、发育毒性、致畸性等[4],其生殖内分泌干扰毒性对调节骨的发育、矿化和重建也有重要意义[1]。本文将对TCDD对骨发育与代谢的影响及相关机制的研究进展进行综述。
1 TCDD对骨物理性质的影响
不同时期暴露于不同剂量的TCDD,可导致骨组织不同程度的病理改变,影响骨的物理特性。Herlin等[5]发现,成年小鼠暴露于200 μg/kg TCDD导致可AhR(+/+)小鼠骨基质变硬、皮质骨变薄、骨骼机械性变弱,并且最显著的是骨小梁骨化率增加。Fader等[6]证实,将产后25 d的幼鼠暴露于30 μg/kg TCDD 28 d,其股骨骨小梁体积分数(bone volume fraction,BVF)增加,这是TCDD损害骨吸收而成骨活动增强的结果。而Dobrzynski 等[9]的实验表明,5 μg/kg TCDD能增加骨吸收,同时伴随着成骨作用增强,但由于矿化不全,导致骨硬化,而矿化的不足也将使骨的机械结构性质发生改变。Yun等[7]通过体外实验发现TCDD能抑制ALP的活性与迁移能力以及骨基质细胞的趋化作用,减弱骨基质的矿化。Watson等[8]用0.15 nmol/L和0.3 nmol/L的TCDD对胚胎期的脊椎动物青鳉染毒,发现TCDD可减少其椎体的骨化。
上述研究结果均为TCDD导致骨形态畸形的佐证,但TCDD对骨吸收作用研究结果有差异,这可能是由于TCDD染毒剂量、实验对象和染毒时间不同造成的,具体原因还需研究证实。此外还有大量研究提供了TCDD影响骨物理性质的依据,相关参数和结果见表1。学者们还指出,AhR拮抗剂如α-萘黄酮、白藜芦醇、生育酚等能减轻TCDD对骨的毒害作用,这些结果提示,TCDD影响骨代谢的主要机制可能与AhR有关[7-8]。近年来,低浓度TCDD对生命早期骨骼系统的危害备受关注,研究表明,TCDD对成年骨的损害,在一定程度上是可逆的,但生命早期的致畸作用是否也能通过药物干预得到有效的控制,未来仍需更多的研究作进一步探讨。

表1 TCDD对骨物理及生化特性的影响Table 1 The effects of TCDD on bone physical and biochemical properties
注:CYP1A1,细胞色素P450 1A1;Cox-2,环氧化酶-2;Runx2,RUNT相关转录因子2;ALP,碱性磷酸酶。
2 TCDD影响骨代谢的机制
2.1 TCDD与AhR
TCDD对骨细胞有高亲和力,是AhR的强效激活剂[6]。AhR是一种环境污染物相关受体,是具有螺旋-环-螺旋结构的配体激活转录因子,广泛存在于全身脏器中[15]。活化的AhR可引起各种生物学效应,如致毒性、免疫应答、骨重建等[1]。TCDD可激活与AhR有关的RANKL、MAPK和Wnt等不同信号通路干扰骨代谢。
2.1.1AhR与RANKL信号通路
核因子κB 受体活化因子配体(RANKL)是一种II型跨膜蛋白,主要来源于骨细胞和成骨细胞等[16]。当成骨细胞表达的RANKL与破骨前体细胞上的核因子κB 受体活化因子(RANK)结合时,与破骨细胞形成有关的肿瘤坏死因子受体6(TRAF6)也与RANK结合,使核因子κB(NF-κB)活化并转运入核,核内活化的NF-κB与c-Fos和T细胞核因子(NFATc1)等发生一系列反应后,破骨细胞相关基因开始表达。Izawa等[15]发现,RANKL/AhR/c-Fos信号轴对破骨细胞的发生起关键作用。在破骨细胞生成的早期阶段,RANKL可上调AhR的表达,进而激活c-Fos,诱导破骨细胞终末分化调节因子NFATc1的表达,且AhR配体激动剂也可激活AhR/c-Fos通路,促进破骨细胞生成。而Yang等[17]证实,TCDD能上调RANKL的表达,而AhR拮抗剂能抑制此作用,说明TCDD对RANKL的调控与AhR有关,但具体机制尚不十分清楚。
此外,TCDD可激活细胞色素P450家族(cytochrome P450,CYP450)中的CYP1a/1b,CYP1是AhR的靶基因,其与AhR相互作用可诱导破骨细胞增生[17-18]。Iqba等[18]在野生型破骨细胞中观察到,RANKL可显著上调CYP1A1/2表达,但在AhR-/-的破骨细胞中无此变化,且在缺乏CYP1的细胞中,RANKL和TCDD对破骨细胞的诱导受到抑制,由此得知,TCDD-AhR可通过激活CYP1介导促进破骨细胞生成。
综上,TCDD与RANKL/AhR信号通路对骨重建的影响主要是通过调控破骨细胞的活动实现的,该信号通路可能对靶向AhR治疗骨代谢相关疾病有一定意义。
2.1.2AhR与MAPK信号通路
丝裂原活化蛋白激酶(MAPKs)是动物细胞内广泛存在的介导细胞反应的重要信号通路,主要包括ERK、JNK和P38。研究发现,内皮一氧化氮合酶(eNOS)分泌的NO可抑制骨吸收,而活化的ERK 1/2可上调eNOS的表达,下调RANKL的表达,从而促进骨形成,减少骨量丢失[19]。Ge等[20]称ERK1/2可诱导增强成骨细胞分化的主要转录因子Runx2的活化,促进成骨细胞增殖和分化,但Yu等[14]发现胶原诱导性关节炎(collagen-induced arthritis,CIA)小鼠的骨组织中AhR高表达,TCDD能通过激活AhR活化ERK通路,抑制成骨细胞增殖和分化,加速骨量丢失,而在加入ERK抑制剂后,TCDD对成骨细胞的抑制作用被逆转。学者还发现,TCDD激活MAPKs是诱导AhR依赖基因转录和CYP1A1表达的关键[22],活化的AhR可通过增强MAPK/ERK磷酸化显著抑制成骨细胞的增殖和分化[14],但机制尚未明确。
目前研究证实,TCDD对骨代谢的影响与MAPK信号通路密切相关,但TCDD-AhR介导的ERK信号通路在成骨细胞作用存在一定的争议,且具体的级联信号及其生物意义还待进一步探究。
2.1.3AhR与Wnt信号通路
Wnt信号通路可通过经典和非经典Wnt信号通路调控成骨细胞与破骨细胞分化[23]。Wnt3a是经典Wnt信号通路的重要组成部分,能诱导ALP表达,还可间接激活能诱导骨髓间充质干细胞向成骨细胞分化的BMPs[24]。R-spondin家族是Wnt信号通路的激活蛋白,Rspo1可与Wnt3a协同激活经典Wnt/β-catenin信号通路,诱导成骨细胞分化和骨保护素(osteoprotegerin,OPG)的表达,而后者可抑制破骨细胞的生成,但Rspo1单独对Wnt信号通路激活作用不明显[25]。早期研究称过度表达的Rspo2可促进成骨细胞生成[26],但在近期研究中,学者发现Rsop2可抑制成骨细胞生成和骨矿化,导致骨量丢失[27]。Wnt5a作为非经典Wnt通路的重要组成部分,可激活此通路,诱导RANK的表达,提高破骨细胞的活性[28]。Tong等[29]发现TCDD可通过激活AhR,下调CIA小鼠骨髓间充质干细胞中的β-catenin表达,抑制成骨细胞生成,而Wnt3a激活Wnt/β-catenin通路可在部分减轻TCDD对成骨细胞的抑制作用。但也有研究称,TCDD能增强β-catenin的表达[30]。此外,学者还证实,在小鼠腭发育过程中给予AhR激动剂TCDD,能抑制Wnt5a的活性,干扰腭骨发育,但是Wnt5a是否由TCDD-AhR途径发挥作用还有待研究[31]。
上述结果在一定程度上反映了TCDD激活AhR后可介导Wnts信号通路,调控成骨细胞和破骨细胞生成,但具体效应和作用机制还未明确。近年有报道称c-Myc可作为β-catenin靶点,以NFATc1依赖或非依赖方式参与RANKL/RANK信号通路对破骨细胞的调控[32],但是否与TCDD-AhR有关还有待探究。
2.2 TCDD的抗雌激素作用
雌激素可通过雌激素受体(estrogen receptor,ER)介导破骨细胞凋亡和成骨细胞增殖分化,从而调控骨代谢,其水平的下降是导致绝经妇女骨质疏松症的主要原因[33]。有研究指出,TCDD能介导CuL4BAhR复合物的形成,泛素化修饰ER,促进其降解[34]。另外,胰岛素样生长因子(IGFs)也受到雌激素调控。IGF-II在骨中含量丰富,能促进成骨细胞分化,而胰岛素样生长因子结合蛋白6(IGFBP6)能抑制IGF-II表达。郭磊等[35]发现雌激素可抑制MC-3T3-E1细胞中IGFBP-6的表达,上调IGF-II的表达,而TCDD可激活AhR干扰ER与IGFBP-6启动子区中雌激素受体作用元件ERE的结合,产生抗雌激素效应,抑制成骨细胞的增殖和分化。目前,有关TCDD对骨的抗雌激素作用报道尚少,且也有研究证实TCDD有类雌激素效应[36],但两者对骨代谢的影响和机制,以及其相互交叉作用还未十分清楚,希望今后的研究能进一步阐明。
3 结语
流行病学研究表明,TCDD有严重的致畸作用,长期暴露于TCDD的人群,其后代脊柱裂、腭裂等先天性缺陷病发病率增高[4]。动物实验及体外试验已经证实,TCDD可通过激活AhR介导不同的信号通路,对骨形态和代谢产生干扰作用,且MAPK、WnT与RANKL/RANK通路之间也有相互作用,具体机制见图1,但其中涉及到的信号级联及分子机制未来还需大量研究阐明。
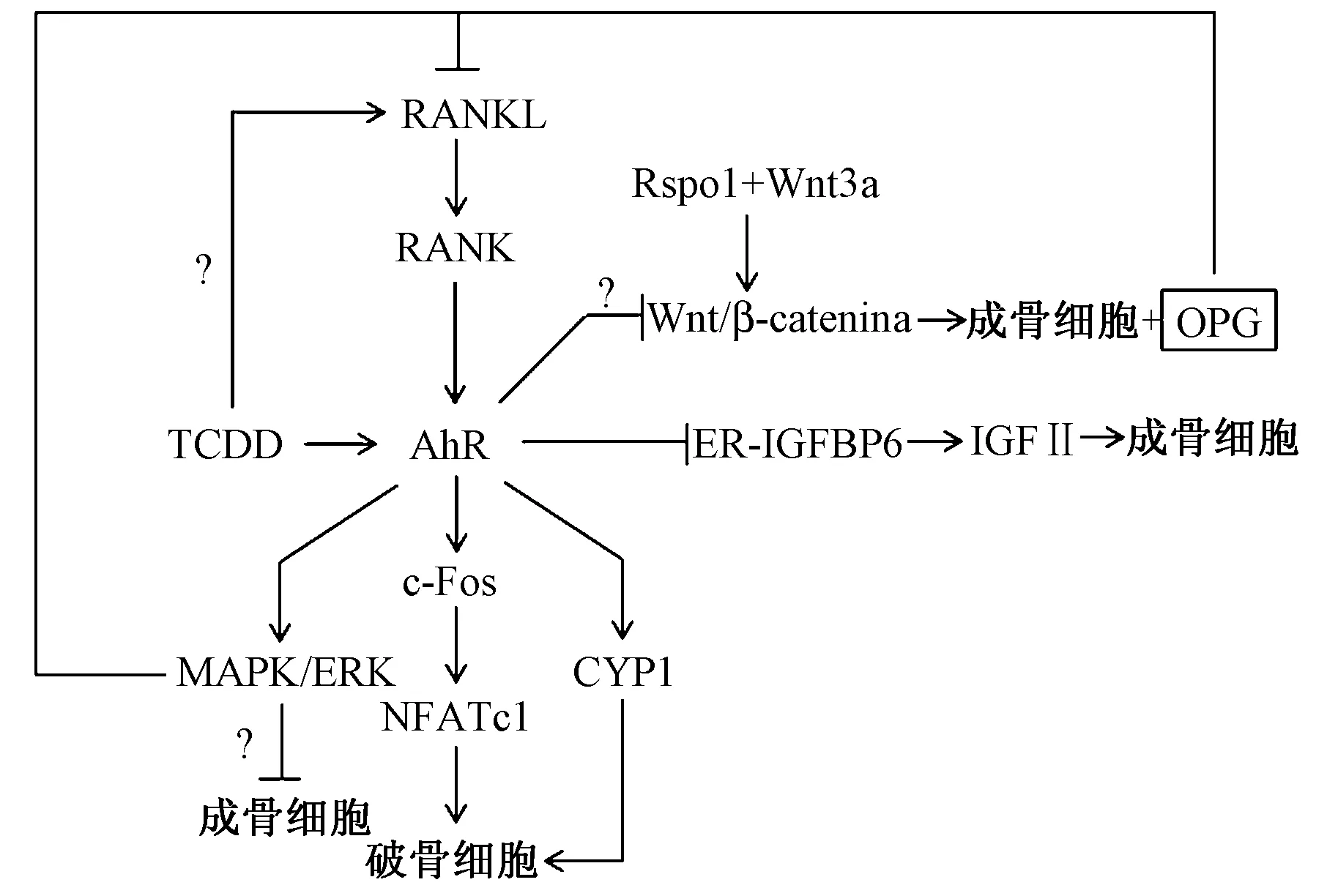
图1 TCDD介导骨代谢的机制Fig.1 Proposed mechanisms of TCDD-mediated bone metabolism
相关临床研究还发现,长期吸烟者骨折和患骨质疏松的概率大大增加[18],即使是暴露于低浓度TCDD,也可能增加罹患骨肿瘤的风险[17]。由于TCDD可呈剂量依赖性地干扰骨代谢,因此,不同性别的个体在不同生命阶段暴露于不同剂量的TCDD对骨产生的影响仍待研究。明确相关疾病发生的机制,可为未来靶向AhR疗法和利用AhR拮抗剂治疗骨代谢相关疾病提供正确且有效的理论依据。
