实体肿瘤治疗相关性白血病2例报告
2019-08-12洪燕英
王 岩,郝 铮,洪燕英
(首都医科大学附属北京中医医院 北京100010)
实体瘤治疗后继发白血病也称治疗相关性白血病(treatment-related leukemia,TRL),我院自2018年至2019年相继发现2例确诊实体瘤继发白血病患者,这两位患者由于不同原因未能进行免疫表型分析及遗传学等相关检查,但根据患者病例资料、外周血细胞数量及形态学分析初步诊断为TRL。现报告如下。
临床资料
1 病例一
患者,男,2018年6月1日无诱因出现咳嗽,偶有咳痰,痰中带少量鲜红色血丝,就诊于我院。查胸部CT提示:左下肺占位(3.8cm×2.8cm),肿瘤性病变可能,伴周围阻塞性炎症;纵隔及左肺门淋巴结肿大;慢性支气管炎伴肺气肿。2018年6月7日就诊于医学科学院肿瘤医院,查鳞状上皮细胞癌相关抗原SCC:4.5ng/mL,支气管镜检见左肺下叶背段新生物,活检病理为:(左肺下叶背段)中分化鳞状细胞癌。2018年6月29日在我院查胸部增强CT示:与2018年6月1日比较:左肺下叶占位(5.3cm×3.7cm),较前增大,考虑恶性肿瘤,伴周围阻塞性炎症;前纵隔淋巴结及两肺门淋巴结肿大(大者直径约2.6cm);慢性支气管炎伴肺气肿。从2018年7月17日至2018年11月1日行支气管动脉介入化疗+全身化疗,具体药物:吉西他滨动脉介入4次共6.0g,吉西他滨ivgtt 7次共11.2g,顺铂动脉介入4次共200mg,顺铂ivgtt 8次共380mg。2018年11月12日门诊复查血常规:白细胞13.69×109/L,红细胞4.22×109/L,血小板41×109/L,血小板数量减少。手工分类结果中性粒细胞18%,淋巴细胞15%,单核细胞4%,原始粒细胞60%,细胞形态胞体呈圆形或椭圆形,部分细胞核凹陷呈杯口样,染色质呈细颗粒状,核仁0~2个,胞质量少呈灰蓝色,部分细胞可见Auer小体或少量颗粒(图1)。从形态学初步诊断为AML-M2型白血病,建议转院做骨髓细胞学检查,免疫分型,染色体及RUNX1-RUNX1T1、NPM1融合基因等相关检查。患者病情较重拒绝转院。
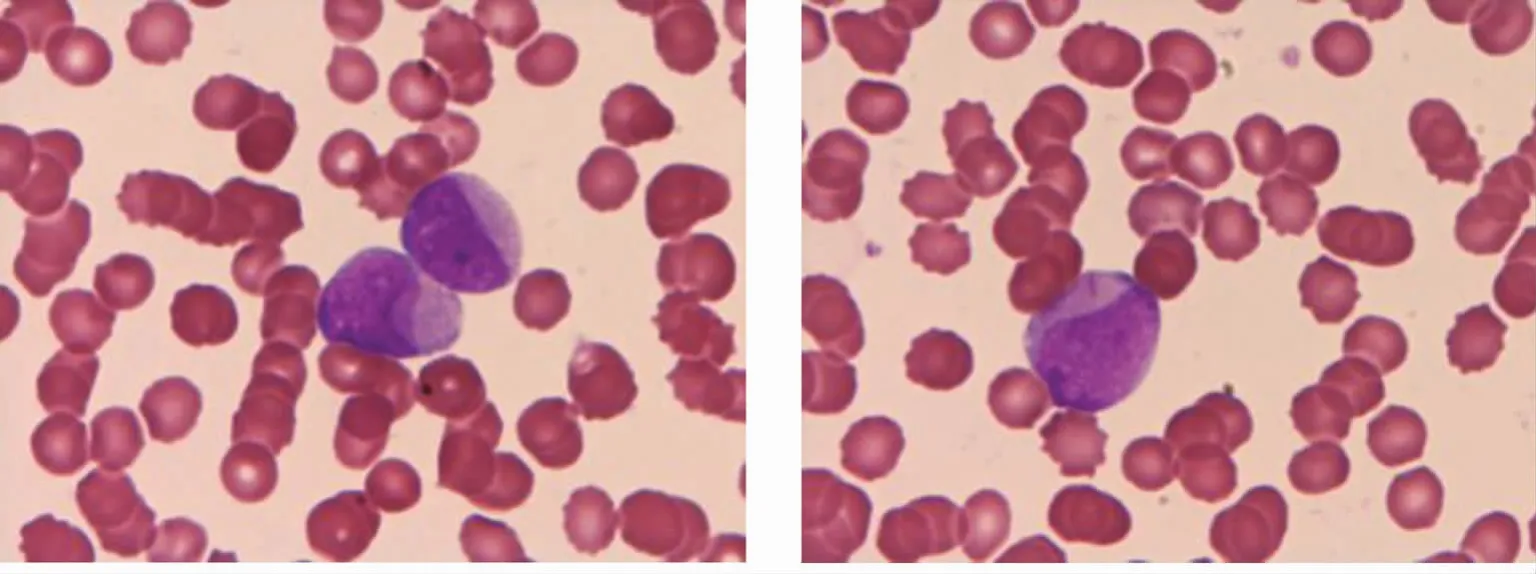
图1 原始粒细胞部分细胞核凹陷呈杯口样可见Auer小体
2 病例二
患者,男,患者2019年2月入院,2018年10月因胃癌于外院行全腹腔镜远端胃癌根治术,毕II式吻合。其父亲死于胃癌,三姐患肠癌。术后病理:胃凹陷型低分化腺癌,主要呈印戒细胞癌,淋巴结转移性癌(7/39),pT1bN3。术后予以奥沙利铂160mg ivgtt d1+替吉奥60mg po d1-d10。14d一周期,共3周期。2019年2月15日于我院行紫杉醇脂质体+注射用奥沙利铂+卡培他滨片化疗。1天前发热,白细胞1.1×109/L,考虑化疗后骨髓抑制,2019年2月27日以“发热,化疗后骨髓抑制”收住院,当日有危机值回报:白细胞1.32×109/L,中性粒细胞5.2%,中性粒细胞绝对值0.07×109/L,单核细胞60.8%,单核细胞绝对值0.8×109/L,红细胞计数3.21×1012/L,血小板计数181×109/L,计数50个白细胞中可见23%幼单核细胞,细胞胞体呈圆形,核质比大,染色质呈块状,胞核可见凹陷折叠,可见数个核仁,胞浆量少呈灰蓝色,可见核仁0~2个(图2)。形态学特征与急性单核细胞白血病AML-M5型相符合。建议做骨髓细胞学检查,免疫分型,细胞遗传学及BCR-ABL1融合基因等检查明确诊断。考虑为化疗后重度骨髓抑制合并感染,予瑞白注射液0.2mg ih Qd促进粒细胞恢复,头孢他啶2g ivgtt Bid抗感染治疗。后患者拒绝做骨髓细胞检查,要求出院。嘱其出院后复查血常规及肝肾功,不适随诊。

图2 幼单核细胞胞核可见凹陷折叠
2例实体肿瘤治疗相关性白血病总结见表1。

表1 实体肿瘤治疗相关性白血病2例
两例患者相同点:发病急,治疗半年内继发白血病,均使用铂类抗肿瘤药物。
讨 论
2018年3月,国家癌症中心发布了中国最新癌症数据,该数据汇总了全国449处癌症登记点的数据。中国癌症统计一般滞后3年,最新公布的是2014年的发病人数380.4万人,死亡人数299.6万人[1]。随着对于癌症患者治疗关注度提高,化疗药物的剂量、种类以及联合用药都在不断变化。癌症患者的生存率也有所提高。但随之TRL群体也在逐渐增多。2016年修订的世界卫生组织髓系肿瘤分类将与治疗相关的髓系肿瘤分为:治疗相关的急性髓系白血病(t-AML)、骨髓增生异常综合征(t-MDS)和MDS/MPN(t-MDS/MPN)。它们是此前因为肿瘤性或非肿瘤性疾病接受细胞毒药物化疗和/或放疗而发生的晚期并发症[2]。这类疾病占全部AML、MDS和MDS/MPN病例的10%~20%。这些继发性髓样肿瘤由于先前化疗中染色体畸变的累积而被认为预后不良,因为这些染色体异常赋予更具攻击性的生物学行为和治疗抵抗力[3]。
骨髓增生异常综合征或急性髓性白血病(TMDS/AML)虽然罕见,但通常是致命的化疗并发症,包括某些烷化剂、拓扑异构酶II抑制剂和铂化合物[4]。目前国内有研究发现与TRL高度相关的化疗药物以烷化剂和拓扑异构酶Ⅱ抑制剂为主。国外文献报道除这两类药物外铂化物抗肿瘤药物同样可以引起治疗相关的急性白血病。在SEER医疗保险数据库中,自2000以来,已知的致白血病药物,特别是铂化合物在初始化疗中的使用大幅增加,尤其是胃肠道癌症(食道癌、胃癌、结肠癌、和直肠癌)[4],上述两例病例在联合药物化疗中均使用铂类抗肿瘤药物。第一例为吉西他滨+顺铂联合使用;第二例使用了奥沙利铂。其中顺铂与奥沙利铂分别为第一代和第三代铂类抗肿瘤药物。铂类抗肿瘤药物的抗癌机制可分为4个步骤:跨膜转运、水和解离、靶向迁移、作用于DNA,引起DNA复制障碍,从而抑制癌细胞的分裂。顺铂为第一代铂类抗肿瘤药物,应用广泛,但不良反应亦最强。关于顺铂与其他药物联合化疗引起白血病的报道亦可查阅[5]。奥沙利铂为第三代铂类抗肿瘤药物,是第一个明显对结肠癌有效及在体内外均有广谱抗肿瘤活性的铂类抗肿瘤药物,对耐顺铂的肿瘤细胞亦有作用。两种药物均可导致骨髓抑制。TRL患者的潜伏期根据病因不同而不同。大部分使用烷化剂或放疗后的TRL患者潜伏期长,其余少部分患者及拓扑异构酶Ⅱ抑制剂导致的TRL潜伏期短[6]。这两例使用铂类化合物的患者都在6个月内发现骨髓异常,起病急且都为AML。铂类抗肿瘤药物导致急性白血病的潜伏期是否比其他两种短还有待研究。
美国癌症学会官方期刊发表了《2018年全球癌症统计数据》报告,这篇文章评估了185个国家36种癌症的发病率和死亡率。亚洲无论是发病率或死亡率均排首位。而据世界卫生组织报告显示,三分之一的癌症是可以治愈的[7]。对于这部分预后良好的癌症更需关注与治疗相关的并发症,努力减少治疗相关不良事件。提高癌症患者生存率及延长生存时间。
我院发现的两病例虽均未做免疫分型及细胞遗传学等相关检查,但根据细胞形态学特点+原始细胞数量(病例1原始粒细胞76%;病例2原幼单核细胞23%/50个细胞),已经可以初步判定为AMLM2、AML-M5。由于继发性髓系白血病发病率低、疗效差,目前无统一治疗方案,治疗策略包括化疗、造血干细胞移植、免疫调节、对症支持等治疗方案[8]。对于一些非血液病专科医院,关于血液病诊断的各种检查还有待完善,但遇到这种细胞形态学典型的病例,可尽早对疾病作出初步诊断,医生可根据诊断及医院相关诊治实力决定转院或自定治疗方案,为患者得到及时治疗争取宝贵时间。
