紫杉醇纳米复合物体内体外抗宫颈癌活性评价
2019-08-08朱彩英陈武炼徐丛剑
朱彩英 陈武炼 杜 明 徐丛剑,3
(1 复旦大学附属妇产科医院宫颈疾病诊疗中心 上海 200011;2 复旦大学聚合物分子工程国家重点实验室-高分子科学系 上海 200433;3 上海女性生殖内分泌相关疾病重点实验室 上海 200011)
宫颈癌是一种常见的女性恶性肿瘤,晚期和复发性宫颈癌是致命的,常常需要化疗和放疗。紫杉醇(paclitaxel,PTX)是一种被广泛使用的化疗药,用于治疗各种不同类型的恶性肿瘤,包括晚期卵巢癌、宫颈癌、肺癌和其他恶性肿瘤[1-2]。因为缺乏特异的肿瘤靶向性,紫杉醇不仅作用于肿瘤细胞,同时也作用于正常细胞。因此,伴随着PTX的使用,其毒性作用及不良反应也总是一并出现,如心血管毒性、过敏和神经毒性等。另外,PTX还有个很重要的缺点,即低水溶性。为改善其水溶性,PTX复合溶液中添加了某些助溶剂,但这又进一步增加了助溶剂本身带来的不良反应。
为减少PTX的不良反应、拓广PTX的应用,科学家们研究了许多更为安全的药物载体[1,3]。介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSN)于20世纪90年代[4]被首次提出,与传统载体相比,具有高度有序、高比表面积、良好生物相容性、易修饰性、无生理毒性等优势,其作为药物释放系统的潜能相继得到特殊关注[5-8]。然而,如果单纯将PTX包裹于MSNs内,不增加“释药阀门”,一旦进入体内,携带的药物尚未到达病灶部位,就会被快速释放和清除,致其不能发挥改善药物生物利用度的作用[9-10]。
我们先前的研究已经构建了一个以二硫键共价链接PTX的MSN[11-13],并对其释药性能做了初步评估。从材料学分类来讲,二硫键复合纳米粒属于刺激响应型聚合物,即能识别体内微环境,对刺激进行动态反应。二硫键在谷胱甘肽(glutathione,GSH)作用下,发生氧化还原反应,能快速裂解,从而获得氧化还原刺激响应。研究表明,肿瘤细胞内谷胱甘肽的浓度异常高于血浆(1~10 mmol/Lvs.1~2 μmol/L[14]),因此二硫键在轻微氧化环境如细胞外环境和血浆中十分稳定。利用二硫键负载药物的方式,可以选择性地将药物释放于细胞内,而不是血浆中,以此增强药物作用的靶向性,并减小非靶向部位的毒性作用及不良反应。为对其载药性能及抗肿瘤效果做全面评估,本文进行了一系列体内和体外研究。
材 料 和 方 法
主要试剂与材料PTX购自北京中化科技有限公司,纯度≥98%。青霉素/链霉素双抗溶液和细胞培养基购于美国海克隆实验室。胎牛血清(Fetal bovine serum,FBS)购自美国Gibico公司。异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)购自日本东京仁成工业株式会社。原硅酸四乙酯(Tetraethyl orthosilicate,TEOS)、3-氨丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,APS)、N-溴化十六烷基三甲铵(N-cetyltrimethylammonium bromide,CTAB)和三甲基苯(mesitylene,TMB)购自美国Sigma-Aldrich公司。Tunel检测试剂购于瑞士罗氏公司。苏木精-伊红染色试剂购于珠海贝索(Baso)生物技术有限公司。负载紫杉醇的荧光介孔二氧化硅纳米粒(Paclitaxel-loaded fluorescent mesoporous silica nanoparticles,PTX-FMSN)合成过程详见于本课题组之前的文献报导[11-12]。
细胞培养人宫颈癌HeLa细胞由中国科学院(上海)细胞库赠送。细胞放入培养基中培育,同时加入10%的胎牛血清、100 U/mL的青霉素和100 mg/mL的链霉素。细胞培养箱在充分湿化的5% CO2空气中维持37 ℃恒温。用于实验的细胞均处于对数生长期。
体外抗肿瘤实验将HeLa细胞接种于48孔培养皿中,每孔细胞密度2.4×105,37 ℃孵育24 h,接着放入不同浓度的PTX-FMSN (分别为0.01、0.1、1和5 μg/mL),利用Cell-IQ活细胞工作站连续观察60 h,分析总细胞数,稳定态细胞数,分裂态细胞数及死亡细胞数,自动计数计算得到细胞的生长曲线。 PTX(浓度分别为0.01、0.1、1和5 μg/mL)和未带药FMSN均相同处理。另取3组处于对数生长期的HeLa细胞,分别加入0.1 μg/mL的PTX和相同浓度的PTX-FMSN,以空白FMSN作为对照,37 ℃恒温孵育,分别于第8、16、24、32、40 h收集细胞,制成1×106/mL细胞悬液,PBS液洗2遍。加入5 mL Annexin V-FITC和碘化丙啶(propidium iodide,PI)混匀,室温、避光反应15 min,上流式细胞仪观察和检测细胞,各组重复3次。
宫颈癌动物模型实验用4~6周大雌性裸鼠(北京维通利华实验动物技术有限公司),饲养于南方模式生物SPF动物房,动物饲养环境、模型构建和取材过程均符合《关于善待实验动物的指导性意见》(科技部2006年9月13日)。0.2 mL内含有1×107个HeLa细胞的溶液经皮下注入裸鼠右侧腋下。3天后,可见瘤体形成。
体内抗肿瘤实验实验方案经复旦大学附属妇产科医院动物伦理委员会审核批准。裸鼠按实验方案分为4组,每组4只(表1)。成瘤方法如上所述。瘤体长到约100 mm3时,裸鼠按组分别经尾静脉注入生理盐水、PTX溶液、未带药FMSNs、PTX-FMSNs,每3天重复给药1次,药物浓度分别为4、8、12 mg/kg,同时用电子游标卡尺测量肿瘤直径,按照以下公式测算肿瘤大小:肿瘤体积=1/2×肿瘤长径×肿瘤短径。注入肿瘤细胞后21天,经全身生物发光成像后,以水合氯醛(浓度4%,剂量0.20 mL/20 g)镇静,1.5%异氟烷吸入麻醉,自裸鼠腹部正中线向上剖开,自下向上剪至剑突,沿两侧肋弓V字型打开胸廓,血管钳夹持左侧胸壁翻转,暴露心脏,以康德莱1 mL注射器刺入右心室,取静脉血,注入EDTA抗凝管中。自裸鼠体内取出瘤体、肺、肝、小肠、胃、心脏和肾,经4%甲醛溶液固定,制成石蜡块。
全身生物发光成像本实验采用全身生物发光成像监测药物分布。经尾静脉注入药物后15 min,裸鼠经1.5%异氟烷麻醉后成像。
组织染色用TUNEL法进行肿瘤组织染色[15]。肺、肝、小肠、胃、心脏和肾组织切片HE染色后,由病理学专家作出诊断。
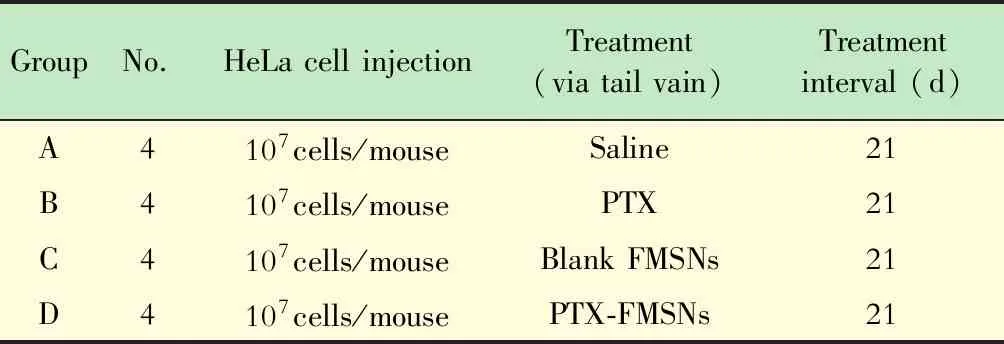
表1 体内实验给药方案Tab 1 Drug delivery protocol in vivo experiment
统计学方法使用STATA12.0软件对数据进行分析。多组间比较用单因素方差分析,两组间比较用Bonferroni 校正。P<0.05为差异有统计学意义。
结 果
药物投递系统的制备PTX-FMSN合成过程详见于之前本课题组发表的论文[11-13]。最终我们得到的FMSNs外观为规则的离散球形,平均直径约147 nm,其内部为有序的中空多孔状结构,载药效率为12%。
体外抗肿瘤评价图1显示的是在不同浓度药物和培育时间下的HeLa细胞活性。从图1A和1B可知,细胞活性与药物浓度密切相关,PTX溶液抑制细胞活性的作用稍强于PTX-FMSN。当药物浓度在0.1 μg/mL时,PTX-FMSN和PTX在抑制HeLa细胞生长及促进细胞死亡上无差异,提示PTX-FMSN能很好地释放药物。当药物浓度为0.01 μg/mL时,PTX-FMSN对HeLa细胞生长抑制和杀伤作用较PTX稍弱,可能是因为药物浓度低,释放量较少。

A:Cell viability of HeLa cells incubated with PTX and PTX-FMSN at different concentrations of drugs for 60 h.B:Cell viability of HeLa cells with different incubation time at 0.1 μg/mL of drug concentration.The cells treated with blank FMSN were used as a control.(1)vs.Control,P<0.05.
图1 经PTX和PTX-FMSN处理的HeLa细胞活性
Fig 1 Cell viability of HeLa cells with PTX and PTX-FMSN
为了进一步评估PTX-FMSN的抗肿瘤效应,我们通过Annexin V-FITC/PI试剂,用流式细胞仪分析细胞凋亡和坏死率。图2显示PTX和PTX-FMSN不同作用时间下,HeLa细胞的凋亡和坏死情况。结果表明,虽然细胞死亡率在PTX-FMSN组相对稍低,但差异无统计学意义,PTX和PTX-FMSN作用下的HeLa细胞凋亡和坏死率趋势一致。根据体外实验的结果,PTX-FMSN与PTX对HeLa细胞有相似的抑制作用。

A:HeLa cells counts at 16 h,24 h,32 h and 40 h.B:Apoptosis rate (left) and necrosis rate (right) of HeLa cells.The cells treated with blank FMSN were used as a control.The concentration of drug was 0.1 μg/mL.(1)vs.Control,P<0.05.
图2 经PTX和PTX-FMSN处理的HeLa细胞凋亡坏死情况
Fig 2 The apoptosis and necrosis of HeLa cells treated with PTX and PTX-FMS
体内抗肿瘤评价因为纳米复合物在合成过程中添加了荧光分子FITC,可以通过发光成像观察PTX-FMSN在体内的分布。从图3A可以看出,裸鼠注射空白FMSN作为对照组,在其身上未发现集中的荧光信号。而PTX-FMSNs通过尾静脉注入裸鼠4 h后,肿瘤部位即显示强烈荧光,表明PTX-FMSN能高效富集于肿瘤部位。
在裸鼠成瘤给药后21天,所有的实验裸鼠在麻醉下处死。肿瘤的生长曲线显示(图3B),未带药的FMSNs组与生理盐水组相似,对肿瘤的生长无抑制作用。PTX溶液组和PTX-FMSN组显示明显的肿瘤生长抑制效果,其效果随着药物浓度增加而增强,在肿瘤生长抑制效果上,PTX-FMSN和PTX两组差异无统计学意义。

A:The whole-body bioluminescence imaging of tumor-bearing mice after blank FMSN (left) and PTX-FMSN (right) administration for 4 h.B:The growth curves of tumors treated with different drug doses.(1)P<0.05,(2)P<0.01.
图3 裸鼠荧光成像和肿瘤生长曲线
Fig 3 Bioluminescence imaging and the growth curves of tumors in nude mice
为了进一步研究纳米复合物对肿瘤生长的抑制作用,本研究将肿瘤组织制成病理切片。TUNEL染色后,肿瘤中的坏死组织在光学显微镜下显示为浅棕色。从图4A-H中可以看出,不考虑药物浓度因素,PTX和PTX-FMSN两组之间差异无统计学意义。在低浓度药物作用下,PTX和PTX-FMSN组和对照组(生理盐水和未带药FMSN)差异无统计学意义。当药物浓度增加(8和12 mg/kg),PTX和PTX-FMSN组有大量的癌细胞凋亡。这些结果也与图3 B的结果一致,充分表明PTX-FMSN能在肿瘤部位充分释放PTX,发挥出与同等剂量游离PTX相同的抗肿瘤效果。

Tumor tissue necrosis stained by TUNEL (×200).A:Untreated mice (saline);B:Untreated mice (blank FMSNs);C:PTX treated mice at 4 mg/mL concentration;D:PTX-FMSN treated mice at 4 mg/mL concentration;E:PTX treated mice at 8 mg/mL concentration;F:PTX-FMSN treated mice at 8 mg/mL concentration;G:PTX treated mice at 12 mg/mL concentration;H:PTX-FMSN treated mice at 12 mg/mL concentration;I:Comparison of tumor tissue necrosis rates.(1)P<0.05,(2)P<0.01.
图4 裸鼠宫颈癌标本病理切片(TUNEL染色)
Fig 4 Pathological section of cervical cancer speciments in nude mice (stained by TUNEL)
体内药物不良反应首先,本研究检查了4个血常规指标,包括白细胞计数、中性粒细胞计数、红细胞计数和血小板计数,两个对照组4个血指标均在正常范围内(图5)。当药物浓度为8 mg/kg时,所有指数均是正常的。当药物浓度为12 mg/mL时,PTX组血白细胞和中性粒细胞的数量显著下降,而PTX-FMSN组血白细胞和中性粒细胞仅略有下降,这表明随着药物浓度升高,PTX-FMSN对血液毒性低于PTX。
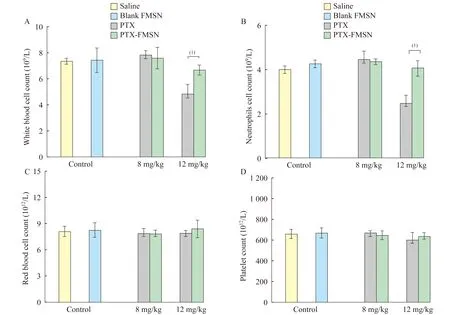
A:White blood cell count;B:Neutrophils count;C:Red blood cell count;D:Platelet count.(1)P<0.05.
图5 不同药物处理的小鼠血细胞计数
Fig 5 Blood cells counts in mice treated by different drugs
随后,本研究将裸鼠的脏器制成切片,通过组织学检查观察有无病理变化。结果如图6及表2所示,PTX和PTX-FMSN两组在低药物浓度时,对肝、肺和小肠组织损伤程度的差异不显著,但随着药物浓度的增加,PTX组对上述脏器组织的损伤程度明显大于PTX-FMSN组。
讨 论
MSNs是具有均匀可调节孔径的中空立体载物体,可在2~50 nm范围内任意调整孔径大小,具有稳定的骨骼结构、较高的表面积和载药率,并且微粒本身无生理毒性,非常适合携带药物。此外,MSNs的内部和外部表面有大量的活性硅氧基,可以被不同的功能基团或功能聚合物改性。纳米技术有望能改善药物的生物利用率,减小药物毒性作用及不良反应,并提高药物水溶性。因此,在药物载体的研发中,MSNs受到了越来越多的关注。
YU等[16]报道的PTX纳米复合物结构稳定,因减少了从肾小管的滤除,从而增加了血循环留存时间,并利用纳米颗粒的高渗透长滞留效应,在肿瘤部位有较好的聚集性,PTX纳米复合物联合放疗与单纯PTX或单纯放疗相比,对宫颈癌具有更好的抗肿瘤效果,其抑制肿瘤增生的机制可能是通过调节Ki-67,降低微血管密度、CD31和血管内皮生长因子实现的,一定程度上增加了放化疗敏感性。
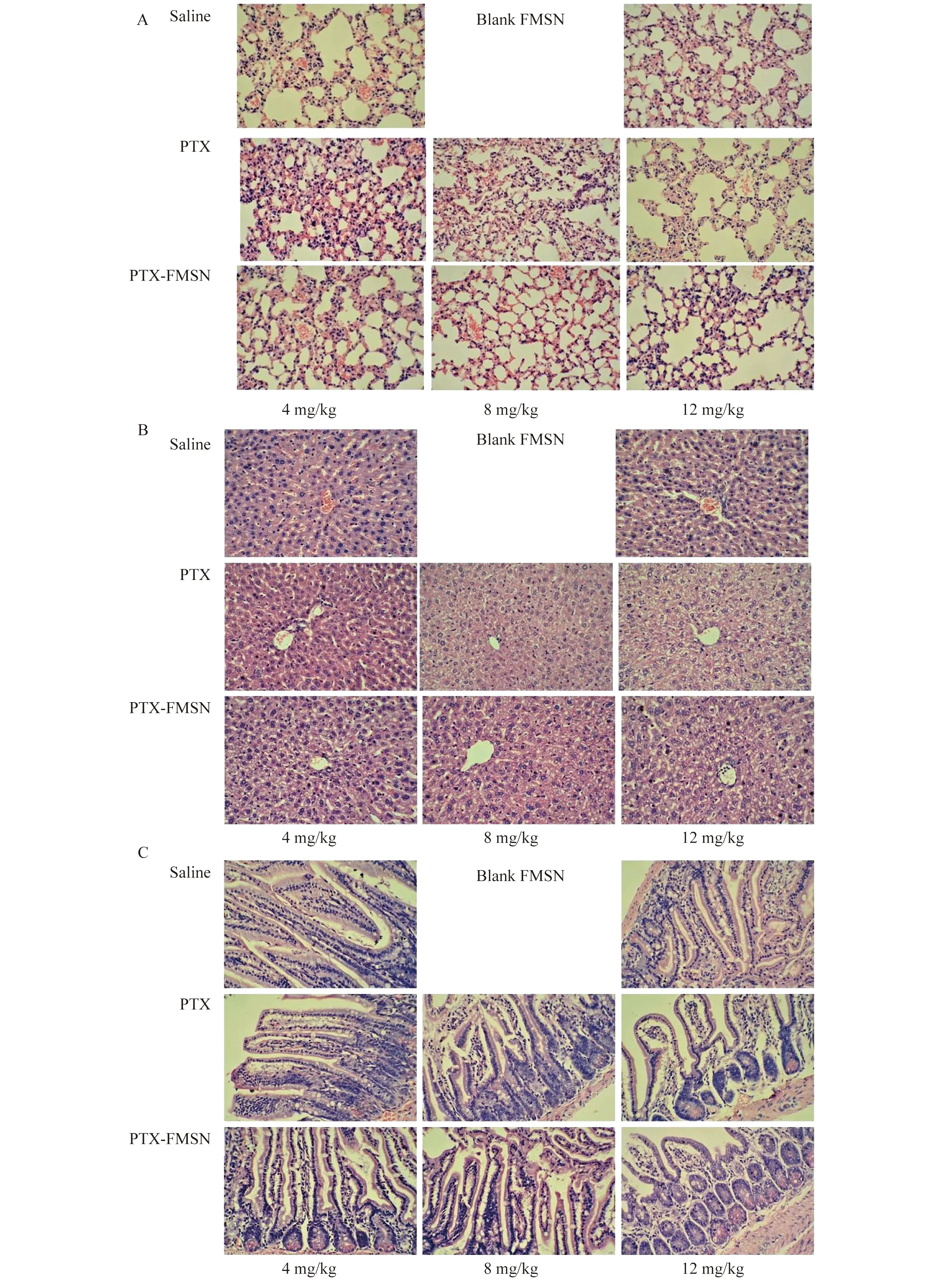
A:Lung;B:Liver;C:Small intestinal villi.HE stain (×200).

图6 各组小鼠肺、肝和小肠组织改变的染色结果Fig 6 Histology stain of lung,liver and small intestinal villi changes in different mice groups
根据肿瘤组织中表达的特殊抗原或配体,可以制作相匹配的MSNs药物靶向复合体,以提高抗肿瘤药物作用的靶向性。实验结果表明,抗肿瘤药物纳米复合物在肿瘤组织中具有良好的聚集性,从而发挥了更高效的抗肿瘤作用[17-19]。研究报道[17,20],因肿瘤细胞具有高速代谢特点,其表面较正常细胞配备更多叶酸受体,故含有叶酸配体的纳米复合物可用于肿瘤靶向治疗,实验结果证实此类纳米复合物发挥了良好的抗肿瘤效果,且减小了药物的毒性作用及不良反应。
另有研究表明,在肿瘤细胞中谷胱甘肽的浓度远远高于正常[21],二硫键可以在谷胱甘肽的作用下分离,通过二硫键共价联合抗肿瘤药物和纳米颗粒的应用已有报道[22]。Luo等[23]通过二硫键将PTX链接于纳米颗粒上,然后对荷瘤小鼠(人表皮癌)给予相当于8 mg/kg剂量的PTX治疗,结果提示PTX纳米复合物与单纯PTX相比,前者的肿瘤聚集性更加明显,在其他脏器的积聚更少。在观察终末,经PTX纳米复合物治疗的负荷小鼠,肿瘤完全消退。但此类纳米复合物用于治疗宫颈癌的相关报道甚少,尤其是体内实验的资料匮乏。
在本研究中,课题组通过二硫键共价链接合成PTX-FMSN复合物。体外细胞实验表明,PTX-FMSN显示出与PTX相似的对HeLa细胞增殖抑制和促凋亡作用。空白FMSN作为细胞试验对照组,结果显示对细胞活性基本无影响,这也说明FMSN作为药物载体是安全的。
通过全身生物荧光成像,表明PTX-FMSN具有较好的肿瘤靶向性。体内抗肿瘤实验表明,经PTX溶液和PTX-FMSN处理的裸鼠,其肿瘤生长曲线无显著差异,两组的细胞坏死率也无显著差异。血液检测结果表明,PTX-FMSN组中血白细胞和中性粒细胞计数显著高于PTX组。通过病理评估,可以看到PTX和PTX-FMSN治疗组裸鼠肺、肝、小肠有组织学变化,但同剂量下的PTX组病变较PTX-FMSN组更为严重。
本研究通过上述一系列体内体外实验,提示PTX-FMSN对宫颈癌有抑制作用,其效果与单纯PTX相当;通过二硫键共价链接,使PTX充分释放在肿瘤组织内,同时减小了药物对其他脏器的毒性作用及不良反应。这些结果与Luo等[23]的实验结果相吻合,进一步验证了二硫键这一阀门在控制药物释放中是安全有效的,其对于宫颈癌的治疗前景值得肯定。当然,我们的实验尚不完善,需进一步改进实验设计,比如增加药代学方面的研究。对PTX复合物的设计也可进一步完善,如增加其他抗肿瘤药物研究联合抗癌效应,增加靶向标记让其更具肿瘤靶向性等。我们也可以尝试在其他肿瘤中做相应的抗癌评价实验,这些都有待进一步实验去考证。
