长链非编码RNA Beta2.7通过上调eNOS/NO通路影响内皮细胞功能
2019-08-08叶楠龚辉王昕
叶 楠 龚 辉 王 昕
(复旦大学附属金山医院心内科 上海 201508)
心血管疾病是目前世界范围内威胁人类健康、导致人类死亡的第一大疾病,严重影响我国居民健康[1-2]。血管内皮损伤与功能障碍是心血管事件链上最重要的病理机制,与高血压、冠心病等严重危害人类健康的心血管疾病的发生发展及其危险因素互为因果,彼此促进[3]。血管内皮能够合成、释放多种生物活性物质,其中一氧化氮(nitric oxide,NO)由左旋精氨酸在内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的催化下合成,具有舒张血管、保护血管内皮、抗炎抗氧化及阻止血栓形成等作用[4]。eNOS是一氧化氮合酶同工酶中的一种亚型,在血管内皮细胞中特异性表达,其生物学活性在被磷酸化后显著增强,从而促进内皮细胞产生并释放NO[5]。eNOS/NO信号通路在调节和维持血管内皮功能方面发挥重要的作用,eNOS活性降低和NO生成减少均可引起血管内皮功能障碍[6-7]。
非编码RNA (non-coding RNA,ncRNA)是指不编码蛋白质的RNA,包括rRNA、tRNA、snRNA、microRNA 等多种已知功能和未知功能的RNA。众所周知,人类基因组中可转录的部分超过90%,但其中仅有不足2%的部分编码为蛋白质[8-10]。通常认为,ncRNA不翻译为蛋白质,在RNA 水平即能行使其生物学功能。其中,长度超过200个碱基的ncRNA分子占大多数,被称为长链非编码RNA(long non-coding RNA,LncRNA);它能够和DNA、RNA或蛋白质结合,在多个层面实现对基因表达的调控[11]。LncRNA广泛参与机体的生理和病理过程,与各心血管疾病的发生发展密切相关[12-13]。近年来,多项研究报道揭示了LncRNA与心血管疾病发生发展之间的联系[14-15]。我们归纳了其中可能与血管内皮损伤相关的LncRNA,概况见表1。

表1 相关LncRNA的生物学功能及其病理意义Tab 1 Biological function and pathological significance of related LncRNA
EC:Endothelial cells;I/R:Ischemia/reperfusion;VSMC:Vascular smooth muscle cell;AS:Atherosclerosis.
然而,LncRNA在血管内皮细胞eNOS/NO信号通路中的作用仍不明确。仅有个别研究指出,LncRNA-uc001pwg.1可以在由人诱导多能干细胞分化而来的内皮细胞中上调eNOS/NO通路[27];STEEL(splicedtranscriptendothelial-enriched lncRNA)与LEENE(lncRNA that enhances eNOS expression)能够上调eNOS的表达[28-29]。因此,本研究结合既往发现并以此为基础,寻找并验证心血管疾病相关LncRNA中调控eNOS/NO的分子,为今后以eNOS/NO为靶点进一步探究防治心血管疾病的新策略提供实验依据。
材 料 和 方 法
主要材料小鼠主动脉内皮细胞(mouse aorta endothelial cells,MAECs)购于江苏齐氏生物科技有限公司;内皮细胞专用培养基(endothelial cell medium,ECM)购于美国ScienCell公司;OptiMEM培养基购于美国Gibco公司;生物基质胶(BD356234 Matrigel)购于美国Corning公司;Trizol试剂、逆转录试剂(RrimeScript RT Master Mix)、PCR试剂(SYBR Premix Ex Taq)购于日本Takara公司;PCR相关引物由上海生工生物工程股份有限公司构建并完成测序;eNOS与p-eNOS单克隆抗体购于美国Cell Signaling Technology公司;GAPDH内参抗体以及二抗购于美国Proteintech公司;RIPA裂解液、细胞与组织裂解液(NO检测用,S3090)、总NO检测试剂盒购于上海碧云天生物技术有限公司。
慢病毒质粒构建慢病毒质粒由上海吉满生物科技有限公司构建,并完成测序、PCR验证与滴度测定。慢病毒作为载体携带有包括:空白质粒(Negative control,NC)、LncRNA-Beta2.7过表达质粒(LncRNA-Beta2.7)、LincRNA-p21干扰质粒(shLincRNA-p21)、LncRNA-ANRIL干扰质粒(shLncRNA-ANRIL)和LncRNA-H19过表达质粒(LncRNA-H19)。其中,空白质粒、LincRNA-p21干扰质粒与LncRNA-ANRIL干扰质粒携带有绿色荧光蛋白(green fluorescent protein,GFP)和嘌呤霉素抗性基因;LncRNA-Beta2.7过表达质粒和LncRNA-H19过表达质粒携带有嘌呤霉素抗性基因。
细胞培养与稳定感染MAECs由含5%胎牛血清、1%内皮细胞生长补充剂和1%青/链霉素双抗的ECM培养基培养于37 ℃、5%CO2的细胞培养箱中,待细胞融合度达到80%~90%时按1∶3进行传代,取第3~7代细胞用于后续实验。取部分第3代细胞在细胞融合度达到30%~40%时,将培养基置换为预先混匀有携带相应基因序列的慢病毒原液的新鲜培养基,48 h后换液;再经24 h后传代,并在培养基中加入2 ng/mL的嘌呤霉素进行细胞筛选,从而构建稳定感染的细胞株。
荧光定量PCRTrizol法提取内皮细胞总RNA,测定样品浓度与纯度后应用RrimeScript RT Master Mix (配成反应体系逆转录总RNA为cDNA,反应条件为37 ℃ 15 min,85 ℃ 5 s。得到cDNA样品经适当稀释后(1∶3)应用SYBR Premix Ex Taq 配成RCP体系,上机。eNOS上游引物:5’-CAGTGTCCAACATGCTGCTGGAAATTG-3’,下游引物:5’-TAAAGGTCTTCTTCCTGGTGATG-CC-3’;GAPDH上游引物:5’-TGAAGGTCGGTG-TGAACGGATT-3’,下游引物:5’-CGTGAGTGG-AGTCATACTGGAACA-3’。扩增条件为:第一阶段:95 ℃ 30 s;第二阶段:95 ℃ 5 s,60 ℃ 31 s,共40个循环。eNOS mRNA的表达水平以GAPDH为内参进行标准化,以2-△△CT值进行统计分析。
Western blotRIPA裂解液(添加1∶100 PMSF、1∶100 PI)提取细胞总蛋白,取上清加入上样缓冲液煮沸变性。得到总蛋白样品经BCA测定浓度后取10 μg经SDS-聚丙烯酰胺凝胶电泳,70 V恒压湿转至PVDF膜。而后使用5%脱脂牛奶室温封闭2 h,一抗(eNOS:1∶2 000;p-eNOS:1∶1 000;GAPDH:1∶5 000) 4 ℃孵育过夜,二抗(1∶5 000)室温孵育45~60 min后曝光显色。目的蛋白的表达水平以GAPDH为内参进行标准化。
间接法检测NO收集细胞培养液上清,每组60 μL;S3090裂解液裂解细胞所得样品,每组取20 μL经1∶3稀释。按照总NO检测试剂盒说明书的流程,采用还原比色法检测NO的含量。
划痕实验取6孔板,预先在背面用马克笔做好标记。完成慢病毒稳定转染的MAECs,取对数生长状态的细胞,再次传代并将细胞铺板。在细胞密度达到80%~90%时,使用200 μL无菌枪头在各孔底面划出竖直且平行的划痕。稳定培养2 h (作为0 h),之后每隔12 h在倒置显微镜下观察一次。参考马克笔所做的标记于固定位置观察,并拍照记录。
小管形成实验预先在冰浴条件下,于96孔板中均匀加入用OptiMEM培养基1∶1稀释的生物基质胶(BD Matrigel) 100 μL,37 ℃孵育30 min。完成慢病毒稳定转染的MAECs,取对数生长状态的细胞。终止消化后稀释为1×105个/mL的细胞悬液,取100 μL覆盖于基质胶表面,放入细胞培养箱孵育。3 h后在Olympus BX43倒置荧光显微镜下观察,并拍照记录。应用Image J Angiogenesis analyzer软件对所得图像进行分析,采用小管数目(Nb branches)、小管总长度(Tot.length)、分支点数(Nb Junctions)作为量化指标。

结 果
稳定转染小鼠主动脉内皮细胞原代培养小鼠主动脉内皮细胞生长状态良好,呈不规则的梭形。通过嘌呤霉素筛选、传代后,在倒置荧光显微镜下可以观察到细胞内GFP表达率高,病毒转染效率可达90%以上。荧光定量PCR的结果显示:与对照组相比,LncRNA-Beta2.7过表达组LncRNA-Beta2.7的表达显著升高(P=0.047),LincRNA-p21敲低组LincRNA-p21的表达显著降低(P=0.032),LncRNA-ANRIL敲低组LncRNA-ANRIL的表达显著降低(P=0.009),LncRNA-H19过表达组LncRNA-H19的表达显著升高(P=0.029),差异均具有统计学意义(图1)。

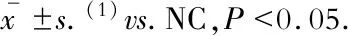
图1 稳定转染小鼠主动脉内皮细胞及其
LncRNA过表达/敲低效率
Fig 1 Stably transfected MAECs and the LncRNAoverexpression/knockdown efficiency
LncRNA对内皮细胞eNOS mRNA表达的影响荧光定量PCR的结果显示:与空白组相比,阴性对照组、LincRNA-p21敲低组、LncRNA-ANRIL敲低组的eNOS mRNA的表达水平无明显改变;LncRNA-Beta2.7过表达组eNOS mRNA表达显著升高(P=0.002),差异具有统计学意义;LncRNA-H19过表达组的eNOS mRNA表达下降(P=0.007),差异具有统计学意义(图2)。


图2 小鼠主动脉内皮细胞eNOS mRNA的表达水平
Fig 2 The mRNA expression of eNOS in MAECs
LncRNA对内皮细胞eNOS/p-eNOS蛋白表达的影响Western blot结果显示:与空白组相比,阴性对照组、LincRNA-p21敲低组、LncRNA-ANRIL敲低组、LncRNA-H19过表达组的eNOS蛋白的表达水平无明显改变,而LncRNA-Beta2.7过表达组eNOS 蛋白的表达显著升高(P=0.036);另外,与空白组相比,阴性对照组、LncRNA-Beta2.7过表达组、LncRNA-ANRIL敲低组、LncRNA-H19过表达组的p-eNOS/eNOS比值无明显改变,而LincRNA-p21敲低组的p-eNOS/eNOS比值则显著升高(P=0.008)(图3)。
LncRNA对内皮细胞内NO含量及其分泌水平的影响各组内皮细胞内的NO水平均无明显差异;而与空白组相比,LncRNA-Beta2.7过表达组中培养基上清液中的NO水平则有显著升高(P=0.019),差异具有统计学意义(图4)。
LncRNA-Beta2.7对内皮细胞迁移与血管形成能力的影响划痕实验结果显示:相比于对照组,LncRNA-Beta2.7过表达组的MAECs伤口愈合速率在12 h和24 h都有显著提高(P均<0.001);小管形成实验的结果显示:相比于对照组,LncRNA-Beta2.7过表达组的MAECs在单位视野内形成的小管分支数无明显改变(P=0.970),而在小管的总长度和分支点数上显著升高(P=0.009,P=0.020)(图5)。


图3 小鼠主动脉内皮细胞eNOS、p-eNOS蛋白的表达水平
Fig 3 The protein expression of eNOS and p-eNOS in MAECs


图4 小鼠主动脉内皮细胞内NO含量以及NO的分泌水平
Fig 4 The NO production and secretion in MAECs


图5 划痕实验和小管形成实验
Fig 5 Wound healing assay and tube formation assay
讨 论
本研究结合既往发现并以此为基础,筛选动脉粥样硬化相关的LncRNA。在获得可靠的LncRNA全长序列后,结合慢病毒构建可行性,构建了相应LncRNA的干扰与过表达载体。未能获得可靠的Tie-1-AS全长序列,MALAT1全长序列过长无法插入质粒等原因使得我们无法考察其对内皮细胞eNOS表达的影响。基于动静脉不同的生理组成,为了使细胞实验更接近体内的生理病理状态,本研究选用了原代的MAECs。
本研究首先发现LncRNA-Beta2.7能够上调内皮细胞eNOS/NO信号通路。通过慢病毒稳定转染实现的过表达LncRNA-Beta2.7上调了eNOS mRNA与蛋白的表达,且同步上调eNOS的磷酸化,使得p-eNOS/eNOS比值保持不变,从而上调NO的产量。既往研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)的许多生物学功能依赖于eNOS的活性被激活[30],包括诱导血管内皮细胞的增殖、迁移、分化和血管形成等[31-32]。为了进一步验证LncRNA-Beta2.7上调eNOS/NO通路在内皮细胞中发挥的作用,我们使用稳定过表达LncRNA-Beta2.7的内皮细胞进行功能学实验,包括划痕实验与小管形成实验。发现过表达LncRNA-Beta2.7上调了内皮细胞划痕愈合速率和小管形成水平,表明LncRNA-Beta2.7能够影响内皮细胞的迁移与血管形成能力,这与其对eNOS/NO信号通路的调控作用相符合。而在既往研究中有学者发现LncRNA-Beta2.7可以帮助内皮细胞抵御缺血再灌注损伤,是一种保护性分子[17,33],与本研究结果基本一致。
除此之外,我们还发现了敲低LincRNA-p21在不影响eNOS mRNA和蛋白表达水平的情况下,能够上调eNOS的磷酸化水平,这与既往研究中LincRNA-p21促进细胞凋亡、抑制细胞增殖的表现相符合[22,34]。但在后续实验中,敲低LincRNA-p21上调NO分泌水平的表现却并不稳定,缺乏统计学意义。既往研究指出LncRNA-H19能够促进血管平滑肌细胞增殖,引起血管重构[20-21],而我们发现过表达LncRNA-H19能够下调内皮细胞内eNOS的mRNA水平,但在后续实验中LncRNA-H19并没有影响eNOS蛋白的表达、磷酸化以及NO的含量。我们推测这可能是由于在生理状态即非病理模型中改变LncRNA的表达水平对eNOS/NO的调控作用有限。在本研究中,LncRNA-ANRIL对内皮细胞eNOS的表达、NO的含量及其分泌水平没有产生显著的影响。
综上所述,本研究发现了LncRNA-Beta2.7在内皮细胞可以上调eNOS/NO的表达以及内皮细胞的迁移和血管形成能力。这提示了LncRNA-Beta2.7可能起到保护血管内皮、阻止动脉粥样硬化等心血管疾病发生发展的的作用,为今后进一步探究如何保护内皮功能障碍,防治心血管疾病提供了新的思路和实验依据。此外,LncRNA-Beta2.7如何实现对eNOS的表达及其磷酸化的调控,是否还有其他靶基因参与了血管内皮功能的调节,均值得进一步研究和探讨。
