非诺贝特对DDC诱导小鼠原发性硬化性胆管炎的治疗作用与机制*
2019-08-08罗怡爽林韩特代曼云胡潇威刘爱明
罗怡爽 林韩特 代曼云 胡潇威 刘爱明
宁波大学医学院药理学研究室 (浙江 宁波, 315211)
胆汁淤积是由于胆汁形成和分布障碍而在肝细胞、胆管中蓄积。临床主要包括原发性胆汁性胆管炎(PBC)、原发性硬化性胆管炎(PSC)以及各型病毒性肝炎所致的胆汁淤积;若得不到有效治疗,各种胆汁淤积性肝病均有可能进展为肝纤维化、肝硬化、肝肿瘤[1]。目前,胆汁淤积性肝病尚无有效的治疗药物,即使是有30多年应用历史的熊去氧胆酸(UDCA)也有50%患者不产生药效学反应,且腹泻、皮肤瘙痒等不良反应也被报道[2]。而2016年通过FDA批准的奥贝胆酸(OCA)目前仍处于Ⅳ期临床试验阶段,临床效果还有待时间检验,因此寻求有效治疗PBC和PSC等胆汁淤积性肝病的新策略具有积极意义。在近期实验中我们明确了非诺贝特激活过氧化物酶体增殖物激活受体a (PPARa),进一步抑制JNK炎症通路预防α-荼基异硫氰酸盐(ANIT)诱导PBC[3],但非诺贝特对PSC的治疗作用尚不清楚。本研究通过3,5-二乙氧基羰基-1,4-二氢-2,4,6-三甲基吡啶(DDC)诱导PSC小鼠模型,探讨非诺贝特对小鼠PSC的治疗作用及可能机制。
1 材料与方法
1.1 实验动物 20只6~8周龄SPF级129/Sv雄性小鼠,体质量(23.0±2.0)g,购自南京模式动物中心,饲养于宁波大学实验动物中心,动物研究方案及操作流程由宁波大学动物实验伦理委员会批准。
1.2 试剂与仪器 试剂:非诺贝特(湖南千金湘江药业);玉米油(上海阿拉丁);DDC(Sigma公司);Trizol(Ambion Invitrogen公司),RT试剂和qPCR试剂(北京康为世纪生物科技公司);定量PCR试剂(SYBR Green PCR Master Mix,Roche公司);血清生物化学检测试剂盒(宁波瑞源生物科技有限公司)。仪器:石蜡包埋机(BM-Ⅶ,湖北孝感宏业医用仪器),切片机(HM-325,德国LEICA公司),酶标仪(美国Thermo公司),定量PCR仪(LightCycle 480,Roche公司)。
1.3 动物分组与给药 将实验小鼠随机分为正常对照组(Nomal control组)、模型组(Model组),治疗组(Model+feno组)和非诺贝特组(Feno组),每组5只。参考相关报道,除正常对照组和非诺贝特组外,其余各组动物均给予0.1% DDC饲料喂养[4,5]。根据我国与欧洲肝病学专家共识,血清酶学的升高作为对诊断PSC有重大意义[6],通过监测实验小鼠血清酶学变化,确定DDC干预5 d后成功诱导PSC模型。第6天起,给予治疗组及非诺贝特组小鼠25 mg/kg非诺贝特(玉米油超声溶解)灌胃,2次/d,持续8 d。
1.4 血样采集及生化分析 在非诺贝特灌胃的第1、3、6、9天,尾静脉采血检测小鼠血清ALT、AST水平。实验结束后,通过眼球取血,4℃、3 600 r/min离心15 min分离血清,检测ALP、TBA等生化指标。
1.5 肝脏病理学检测 小鼠肝脏放于10% 中性福尔马林缓冲溶液固定24 h后,脱水,石蜡包埋。常规切片,HE染色,显微镜下观察肝脏病理形态学变化。
1.6 肝脏胆汁酸排泄基因和炎症基因mRNA表达检测 qPCR实验方法及步骤参考本课题组已发表文章[3]。引物序列信息来自公共数据(http://mouseprimerdepot.nci.nih.gov/),见表1。

表1 引物序列信息
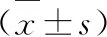
2 结果
2.1 4组小鼠血清胆汁淤积指标检测结果 见图1。 在DDC诱导PSC模型后,给予非诺贝特治疗8 d,与正常对照组相比,模型组小鼠血清ALP、TBA水平明显升高(P<0.01),胆囊系数增大(P<0.01);与模型组相比,治疗组小鼠血清ALP、TBA均明显降低(P<0.01),胆囊系数下降至正常(P<0.01),肝系数有所上升(P<0.05)。
与正常对照组比较,** P< 0.01;与模型组比较,## P< 0.01
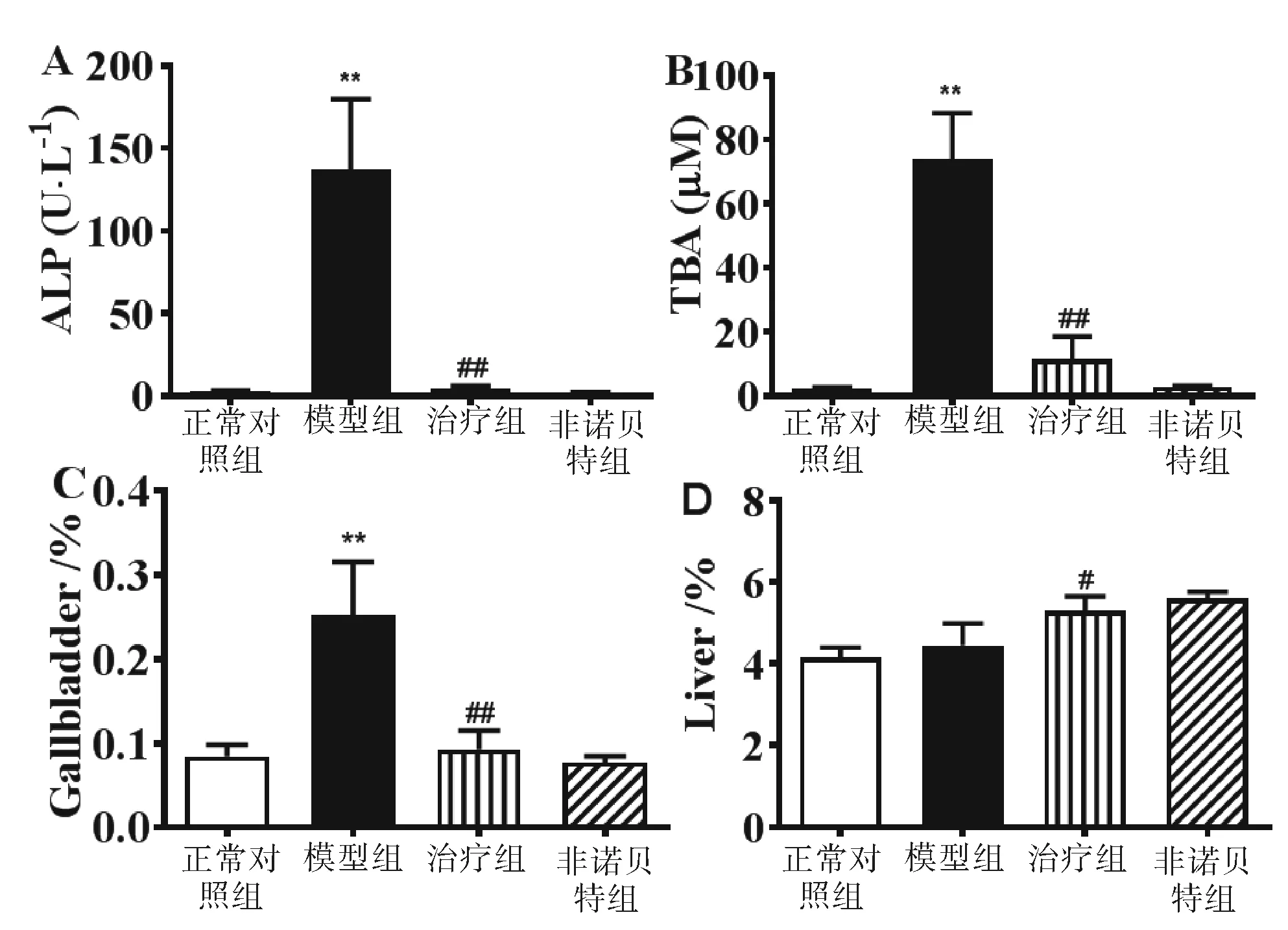
2.2 4组小鼠不同时段肝功能指标检测结果 见图2。 给予非诺贝特治疗3~6 d后小鼠ALT、AST水平开始呈下降趋势(P<0.05或P<0.01),在第6~9天治疗组小鼠肝功能恢复接近正常对照组。见图2。
与正常对照组比较,** P< 0.01;与模型组比较,## P< 0.01
2.3 4组小鼠肝组织病理情况 镜下观察,正常对照组小鼠肝脏外观正常;肝小叶结构清晰、细胞核大而圆,核膜清晰,胞浆丰富、淡染。模型组小鼠肝脏外观呈现暗红色,胆囊肿大,胆汁呈深褐色;细胞着色有加深,提示有可能发生凋亡;肝小叶轮廓不清,炎细胞浸润,组织轻度坏死,胆汁淤积严重,胆管增生。治疗组小鼠肝组织上述病理变化均明显减轻。非诺贝特组小鼠肝脏病理无明显病理学改变。见插页图3。
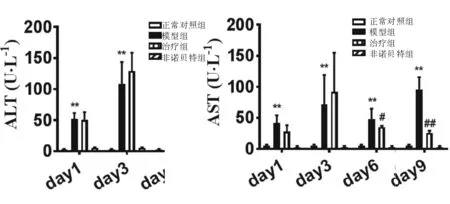
2.4 4组小鼠肝脏胆汁酸代谢基因 见图4。 与正常对照组相比,模型组小鼠肝脏胆汁酸合成酶Cyp8b1和Cyp7a1与摄取基因Oatp2和Oatp1表达分别下降86%、44%和52%、99%(P<0.05或P<0.01),胆汁酸排泄基因Ostb和Mdr1a表达升高47倍和5倍(P<0.01);与模型组相比,治疗组小鼠Cyp8b1转录水平上调504%(P<0.05),并下调排泄基因Ostb和Mdr1a转录表达水平82%和48%(P<0.01)。非诺贝特组小鼠上述基因转录水平与正常对照组相当。
与正常对照组比较,* P< 0.05, ** P< 0.01;与模型组比较,# P< 0.05, ## P< 0.01
2.5 4组小鼠肝脏炎症因子和基因检测情况 与正常对照组相比,模型组小鼠炎症基因Il1β、Il6、c-Jun和c-Fos表达升高4~8倍(P<0.05或P<0.01);与模型组相比,治疗组小鼠Il1β、Il6、c-Jun和c-Fos mRNAs分别下降42%、65%、66%和73%(P<0.05或P<0.01),甚至逆转至正常组水平。见图5。
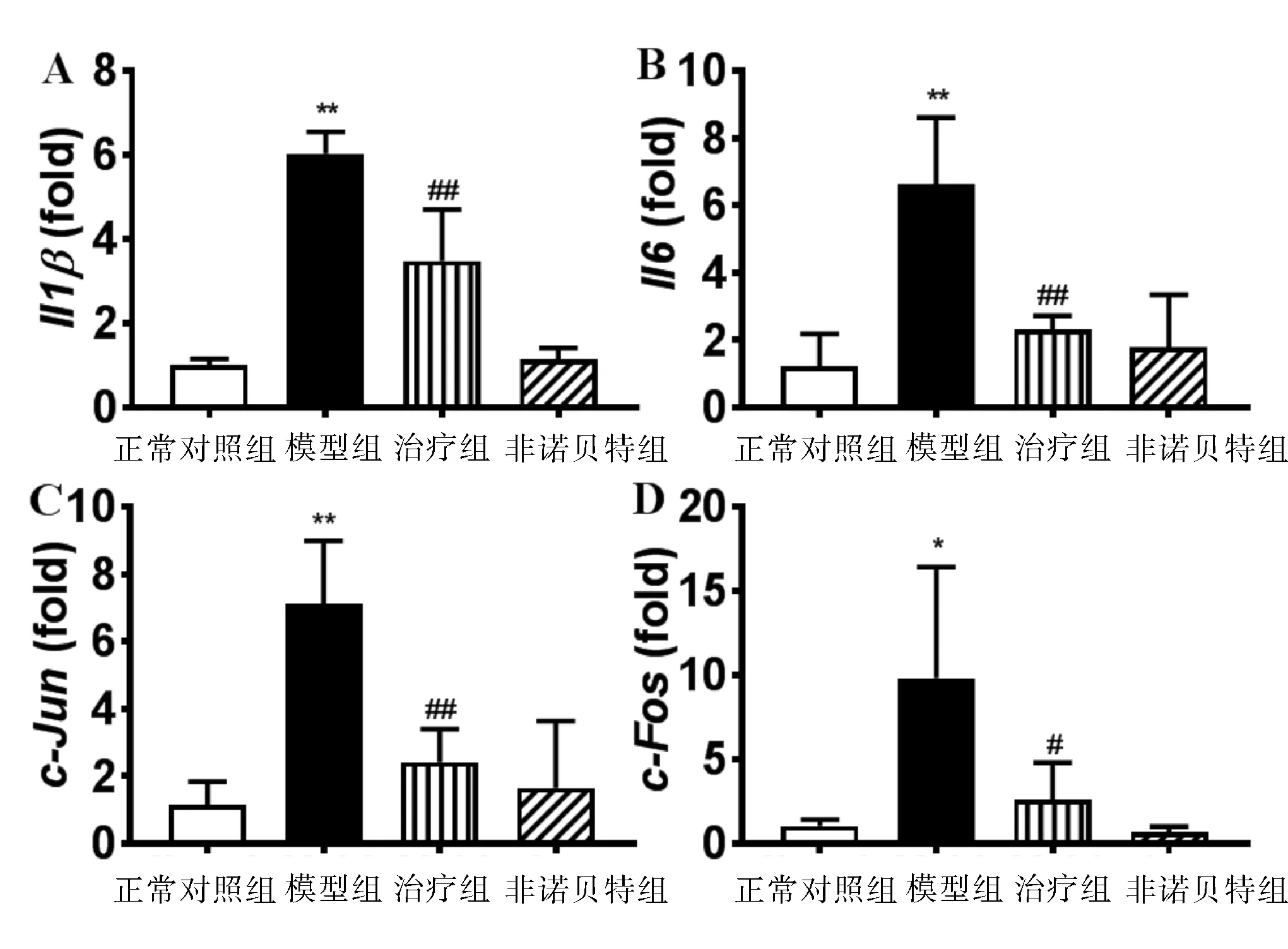
与正常对照组比较,* P< 0.05, ** P< 0.01;与模型组比较,# P< 0.05, ## P< 0.01
3 讨论
胆汁淤积性肝病发病率高。PSC是胆汁淤积性肝病的主要病症之一,表现为肝内外胆管进行性炎症,病情进行性发展,最终将进展为肝硬化和肝衰竭,患者生存将依赖于肝脏移植[7]。DDC开发为PSC模型的工具药,多项研究肯定DDC诱导PSC模型的可行性,以血清酶学指标和组织病理学分析PSC模型的建立,这与本研究分析基本一致[8]。
多项研究证实PPARa是一个多功能的核受体,它可以直接或者间接介导破坏胆汁酸合成和转运的平衡,如野生型和基因敲除小鼠食饲吉非罗齐饲料的不同表现,也可以正面维持体内胆汁酸稳态,如硫酸钠诱导的结肠炎模型的研究[9];胆汁淤积性肝病中,PPARa可以介导致炎和抗炎,如全氟癸酸基于PPARa诱导了胆汁酸稳态破坏激发炎症,同时基于抗炎发挥了对抗作用[10]。
非诺贝特是核受体PPARα激动剂,在我们之前的研究中,非诺贝特可明显预防PBC,本研究探讨了相同的给药方案治疗DDC诱导PSC的作用与机制。给予非诺贝特治疗后,DDC诱导的PSC小鼠胆汁酸合成酶Cyp8b1转录水平上调接近正常,排泄基因Ostb和Mdr1a表达下调;并下调了炎症基因Il-1β、Il-6、c-Fos和c-Jun的表达。这些结果说明药物治疗PSC与抑制炎症有关,而胆汁酸代谢排泄的改变属于代偿性改变。
临床实践中,非诺贝特用于治疗高脂血症的剂量为150~300 mg/d,而贝特类药物用于治疗胆汁淤积性肝病的临床研究多采用此剂量[11,12]。文献报告在大鼠、小鼠等模型中研究非诺贝特防治胆汁淤积性肝病时,药物剂量多为50~200 mg/kg[13,14]。在本研究中,我们采用的25 mg/kg、2次/d的给药方案,结果表明该剂量仍然可以完全抑制DDC诱导的PSC,提示低剂量非诺贝特可能对各种胆汁淤积性肝病都具有良好的治疗作用。
综上所述,本研究通过DDC诱导的PSC小鼠模型评估了非诺贝特对PSC的治疗作用,并从药物干预下的胆汁酸代谢代偿性改变和PPARa介导的抑制炎症等方面进行了分析,提示低剂量非诺贝特能有效治疗胆汁淤积性肝病,值得进一步研究。
