热休克蛋白72(HSP72)对大鼠青光眼模型视网膜神经节细胞和视神经的保护作用△
2019-08-07孔凡女李清林
孔凡女 李清林
青光眼是一组以视盘萎缩及凹陷,视网膜神经节细胞(retinal ganglial cells,RGCs)丢失并伴有视力下降为特征的眼科疾病[1]。视神经供血不足及病理性眼压增高是青光眼发病的主要危险因素;此外,视神经对压力损害的耐受性也与青光眼的发生存在密切联系[2]。目前,关于RGCs损伤的机制尚未明确,相关研究指出[3],RGCs进行性死亡所致的青光眼性视神经病变主要由RGCs凋亡引起,因此保护RGCs避免视神经受损对治疗青光眼具有重要意义。热休克蛋白(heat shock protein,HSP)是一类存在于生物细胞体内的热应激蛋白质,其在机体内参与细胞的正常生长、发育和分化[4]。国内相关研究结果证实[5],HSP72抗体具有促进RGCs凋亡的作用。目前关于HSP72对大鼠青光眼模型RGCs和视神经的保护作用的研究报道仍较少,本研究利用Wistar大鼠制作青光眼动物模型,探究HSP72对青光眼模型大鼠RGCs和视神经的保护作用。
1 材料与方法
1.1 实验动物及分组选取Wistar大鼠46只,体质量200~250 g,采用随机数字表法将大鼠分为正常对照组(6只)和实验组(共40只,全部建立青光眼模型)。建模后取实验组8只大鼠作为实验对照组,不做处理;16只作为热休克反应组,2 d后给予热休克反应处理;另外16只作为硫酸锌注射组,2 d后给予硫酸锌腹腔注射处理。
1.2 方法
1.2.1 大鼠青光眼模型建立于大鼠腿部按照1 mL·kg-1体质量肌肉注射速眠新Ⅱ注射液,右眼滴入一滴1 g·L-1地卡因。设置激光机(澳大利亚Ellex公司)参数为0.7 s/0.4 W,光斑直径200 μm。通过角膜缘,激光束以锐角直接射入小梁网,每眼光凝360° 80~100个点。所有建模大鼠均给予右眼2次激光光凝,每2次光凝相隔7 d。
1.2.2 实验处理热休克反应:按照0.02 mL·kg-1体质量标准进行腹腔注射100 g·L-1水合氯醛进行麻醉,将大鼠置于无盖铝盒并漂浮于恒温为43 ℃水中,测量大鼠肛温,大鼠肛温保持在40~42 ℃,15 min后将大鼠取出,待其自行恢复。硫酸锌注射:取24.6 mg·kg-1硫酸锌粉剂溶于2 mL浓度为0.01 mol·L-1的磷酸盐缓冲液,抽取硫酸锌溶液注入大鼠腹腔内,30 min后如无异常反应将大鼠送回鼠舍。
1.2.3 眼压测定分别于激光前及激光后3 d、7 d、14 d、28 d测量实验对照组、硫酸锌注射组及热休克反应组大鼠的双眼眼压。检查方法:按照0.02 mL·kg-1体质量标准进行腹腔注射100 g·L-1水合氯醛进行麻醉,待麻醉显效后给予大鼠双眼滴入5 g·L-1丁卡因眼液,采用Tono-Pen XL眼压计笔尖轻轻接触角膜,读取3次眼压值,取平均值。
1.2.4 Western blot检测实验对照组给予大鼠右眼前房内加压灌注,分别于激光后3 d、7 d、14 d、28 d 各时间点处死大鼠;硫酸锌注射组给予大鼠腹腔硫酸锌注射,分别于相同时间点处死大鼠;热休克反应组给予大鼠热休克反应处理,分别于相同时间点处死大鼠。处死后,即刻行右眼摘除及视网膜剥离,采用0.01 mol·L-1的PBS缓冲液进行2次漂洗。取出视网膜并碾碎置于离心管内,将体积约5倍的预冷悬浮缓冲液迅速加入离心管内,置于沸水浴中加热10 min。待其冷却后4500 r·min-1离心10 min,获取上清液并保存于-20 ℃冰箱。完成样本采集后采用紫外分光光度仪检测蛋白质浓度,进行Western blot分析。均按照1500稀释单克隆鼠抗体以及羊抗鼠多克隆抗体,温育1 h。二氨基联苯胺化学反应显色及辣根过氧化物酶联合抗体染色。
1.2.5 RGCs计数400倍光镜下,在视网膜鼻上、鼻下、颞上、颞下四个象限内,分别距离视盘中心1 mm、2 mm、3 mm处各取一个矩形(0.078 mm×0.058 mm)染色照相。根据RGCs染色特点,采用图像分析软件统计每张照片RGCs数并计算细胞密度。取12个矩形内RGCs密度的均值作为整个视网膜的RGCs平均密度。

2 结果
2.1 激光处理前后大鼠眼压的比较各组建模大鼠均成功建立青光眼模型,激光后3 d、7 d、14 d、28 d,各组大鼠右眼眼压均较激光处理前有所上升,且各组间差异均无统计学意义(均为P>0.05)。见表1。
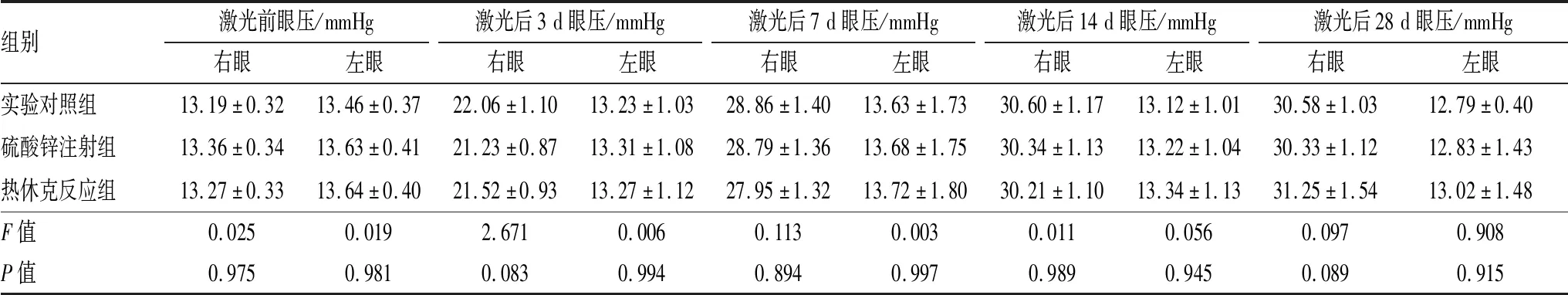
表1 各组激光处理前后大鼠眼压的比较
注:1 kPa=7.5 mmHg
2.2 不同时间点各组RGCs中HSP72抗体含量正常对照组在不同时间点RGCs中HSP72抗体均无表达,激光后3 d实验组各组RGCs中HSP72抗体含量缓慢上升,激光7 d、14 d达高峰,此后逐渐下降至接近正常水平。激光后实验组各组RGCs中HSP72抗体含量显著高于正常对照组,且热休克反应组RGCs HSP72抗体含量均高于实验对照组,低于硫酸锌注射组,差异均有统计学意义(均为P<0.05)。见表2。
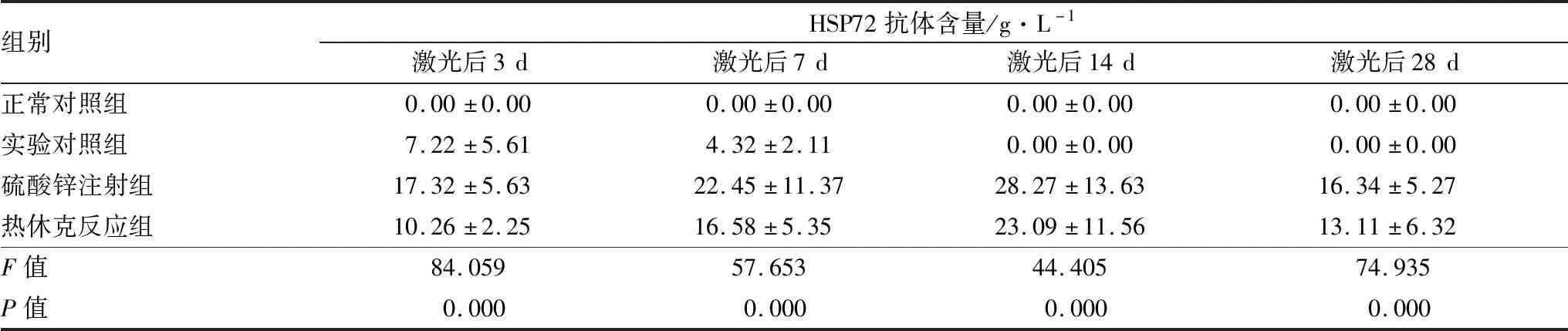
表2 各组不同时间点RGCs中HSP72抗体含量的比较
2.3 各组RGCs平均密度的比较激光后3 d、7 d、14 d、28 d实验组各组大鼠RGCs平均密度均明显低于正常对照组(均为P<0.05),且热休克反应组RGCs平均密度均显著高于实验对照组和硫酸锌注射组,差异均有统计学意义(均为P<0.05)。见表3。
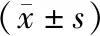
表3 各组RGCs平均密度的比较
注:P1,2值表示实验对照组与正常对照组比较,P1,3值表示热休克反应组与正常对照组比较,P1,4值表示硫酸锌注射组与正常对照组比较。与实验对照组比较,*P<0.05;与热休克反应组比较,#P<0.05
3 讨论
青光眼是全球三大致盲眼病之一,其发病机制尚未明确,因此仍无确切有效的治疗方法。多数青光眼患者在接受治疗后无法阻断视神经病变的发展,从而导致视力减退。研究认为[6],引起青光眼视神经受损的主要原因为视网膜缺血、机械性损伤、神经营养因子丢失以及兴奋性毒素谷氨酸的释放等。目前,临床上治疗青光眼的主要方法为降低眼压,缓解视神经损害的发展等[7-8]。但该治疗方法对于压力依赖性青光眼有效,而无法阻断非压力依赖性青光眼患者视神经病变的进展。有报道指出[9],青光眼性视神经病变主要由RGCs进行性凋亡引起,因此保护RGCs及视神经受损为目前主要治疗原则。HSP是一类存在于所有生物细胞体内的热应激蛋白质,当机体受到缺血、组织损伤、高温及兴奋性毒素时,该蛋白能通过在神经元细胞中改变基因表达方式,进而引起内源性保护机制的应激反应来发挥神经保护作用[10-11]。相关研究发现[12],含有HSP72基因的大鼠体内随着HSP72的表达上升,其机体神经元会对损伤和缺血的耐受性增强。实验研究证实[13-14],正常组大鼠视网膜无HSP72的表达,当其受到高温、感染、缺氧等应急状况,其体内HSP72蛋白浓度上升,视网膜的抗损伤能力就会增强。大量研究显示[8],锌离子能够诱导HSP72在各组织中表达,而且无显著不良反应发生。
HSP72包含两个结构域,一个为N端ATP酶活性的高度保守序列,另一结构域为C端的可结合热休克转录因子的识别序列。热休克反应过程中,损害机体细胞内蛋白质结构,使外露的疏水结构域结合HSP702,从而导致HSP被游离出来形成三聚体。后者移位核内后,结合热休克基因上游的转录启动序列,快速转录HSP702,从而使细胞内的HSP72浓度上升。本实验中的热休克反应组,升高Wistar大鼠体温使其处于热应激状态下,从而可以增加HSP72在各组织细胞中的表达。大鼠腹腔内行硫酸锌注射可诱导RGCs产生HSP72,神经元细胞注入高浓度锌离子,抑制磷酸甘油醛脱氢酶,从而降低细胞内烟酰胺腺嘌呤含量,进而抑制糖酵解过程,最终造成神经元细胞能量代谢出现障碍,降低细胞内ATP水平。本实验中,硫酸锌注射组升高锌离子在大鼠体液中的浓度,抑制神经元细胞能量代谢,最终诱导RGCs产生HSP72。研究结果显示,热休克反应组在不同时间点RGCs中HSP72抗体含量显著低于硫酸锌注射组,提示HSP可有效减缓RGCs凋亡。Wang等[15]采用硫酸锌和槲皮素对Wistar大鼠行腹腔内注射,结果显示大鼠腹腔内行槲皮素注射后,其RGCs存活率与注射前无显著差异,而硫酸锌组的RGCs存活率显著高于未接受注射组。本研究结果发现,激光后不同时间点实验组各组RGCs平均密度均显著低于正常对照组,且不同时期的热休克反应组RGCs平均密度均显著高于实验对照组和硫酸锌注射组,提示高眼压之前给予大鼠热休克反应处理和硫酸锌腹腔内注射,能够诱使其组织中生成HSP72,从而增加RGCs的存活率,最终达到保护RGCs的作用。
