复合手术治疗症状性颅内动脉狭窄合并近端血管迂曲病变二例
2019-08-01李龙杨斌陆夏马妍
李龙 杨斌 陆夏 马妍
颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是导致缺血性卒中的重要原因,尤其好发于亚洲人群[1]。在我国,33%~50%的卒中及50%以上的短暂性脑缺血发作患者存在ICAS[2-3]。对于经过规范药物治疗仍有症状反复发作的ICAS患者,颅内动脉支架或血管成形术是安全、有效的治疗方式[4]。然而,当ICAS合并近端颈动脉或椎动脉迂曲时,介入治疗的难度和风险增加,甚至可因介入器械无法到位而致手术失败。我们分析2例经药物治疗无效的症状性颅内动脉重度狭窄合并近端血管迂曲患者,通过复合手术改善或创造介入路径,同期行远端狭窄介入治疗的效果,并复习相关文献,以期为神经外科医师对该类患者治疗策略的选择提供参考。
患者1女,73岁,因右侧肢体无力伴言语不清1个月余于2015年9月25日入住首都医科大学宣武医院神经外科。入院前1个多月,患者无明显诱因出现右侧肢体无力伴言语不清。发病后曾在当地医院行头部MRI检查,示左侧放射冠区腔隙性脑梗死(图1a),头部MR血管成像示左侧大脑中动脉M1段重度狭窄。给予双重抗血小板聚集及降脂药物治疗,症状无明显改善。既往高血压病史2年,规律服用缬沙坦氨氯地平,血压控制在120~140/70~80 mmHg。入院时体格检查:血压130/75 mmHg,左侧鼻唇沟略浅,右侧肢体肌力Ⅴ-级,病理征阴性。入院诊断:症状性左侧大脑中动脉重度狭窄,脑梗死,高血压病1级。术前MRI示左侧放射冠区及半卵圆中心陈旧性脑梗死。主动脉弓及全脑DSA显示:左侧大脑中动脉M1段重度狭窄(图1b)。拟行左侧大脑中动脉支架置入术。因患者左侧颈内动脉起始段严重迂曲(图1b,1c),介入术中将6 F血管鞘(Cook,90 cm,美国)头端置于迂曲血管近端,0.0889 cm超滑导丝(Terumo,日本)导引6 F Navien导管(Medtronic,美国)通过近端迂曲,但经反复尝试,导丝头端难以到达岩骨段,Navien导管无法通过远端迂曲,介入手术失败。
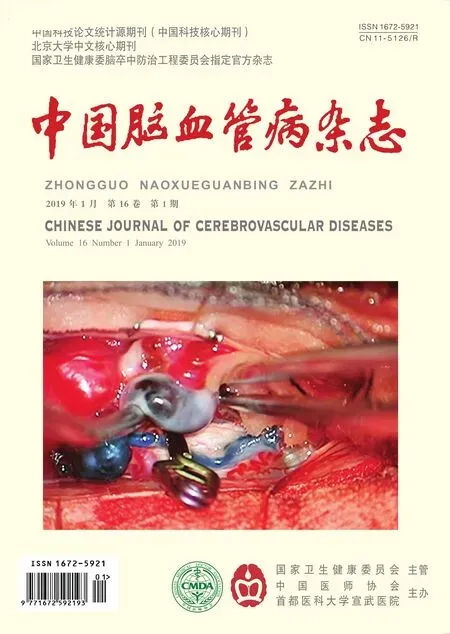
复合手术过程:在复合手术室进行手术,采用气管插管全身麻醉。患者取仰卧位。采用Seldinger技术穿刺右侧股动脉留置6 F动脉鞘(Terumo,日本)备用。头后仰20°、右偏约60°固定,术中经颅多普勒超声持续监测脑血流量变化。取左侧胸锁乳突肌前缘切口,按常规颈动脉内膜切除术步骤显露并切开左颈动脉鞘。颈内动脉起始段呈“S”型闭环式迂曲(图1d),与DSA所见相符。充分游离松解后切除迂曲部分颈内动脉,行端-端吻合,采用“降落伞”连续缝合技术,使血管对合整齐,恢复颈内动脉正常走形及血运(图1e,1f)。即刻造影示,左侧颈动脉走形良好,血流通畅(1g)。经右侧股动脉鞘进行介入部分,使用0.0889 cm加硬超滑导丝(Terumo,日本),在路图引导下6 F导引导管顺利通过术区。微导管携带微导丝通过左侧大脑中动脉狭窄处,撤回微导管,沿微导丝将2.5~9.0 mm Gateway球囊(Stryker,美国)置于M1段狭窄处,6标准大气压预扩张,成功置入1枚3.0~9.0 mm Wingspan支架(Stryker,美国)。复查DSA显示,与术前相比左侧大脑中动脉狭窄消失,远端灌注改善(图1h)。患者术后第2天复查MR扩散加权成像未见新发梗死灶,术后第4天出院时右侧肢体无力症状消失,言语不清较前明显改善。常规予以阿司匹林100 mg/d联合氯吡格雷75 mg/d双联抗血小板聚集药物治疗,阿托伐他汀钙20 mg/d调脂稳定斑块。术后3个月超声复查提示大脑中动脉血流通畅,停用氯吡格雷。随访12个月,期间症状无复发,12个月时CT血管成像提示颈动脉走形良好,吻合口处无明显狭窄(图1i),左侧大脑中动脉无明显再狭窄(图1j)。

患者2男,70岁,因阵发性眩晕5个月于2016年12月12日入住首都医科大学宣武医院神经外科。患者5个月前无明显诱因出现阵发性眩晕,就诊于当地医院,行头部MRI检查未见明显异常,头部MR血管成像示基底动脉重度狭窄。规律服用阿司匹林100 mg 1次/d、氯吡格雷 75 mg 1次/d、阿托伐他汀 20 mg 1次/d,4个月后症状仍反复发作。既往高血压病史20余年,最高达170/100 mmHg,间断服用硝苯地平缓释片40 mg 1次/d,血压控制尚可。冠心病史6年。入院时体格检查:血压130/80 mmHg,神经系统未见明显阳性体征。入院诊断:症状性基底动脉狭窄,冠心病,高血压病2级。术前高分辨率MRI示:与左侧相比,右侧椎动脉V4段管径较小,局部管壁无明显强化(图2a)。术前DSA显示:左侧椎动脉V1段严重迂曲(图2b);右侧椎动脉-小脑后下动脉以远显影不佳(图2c);基底动脉重度狭窄(图2d)。结合高分辨率MRI、DSA结果,考虑右椎动脉V4段生理性纤细,拟经左侧椎动脉行基底动脉支架置入术。介入术中0.0889 cm超滑导丝(Terumo,日本)顺利通过迂曲,但6 F导引导管通过左椎动脉开口困难(图2e),反复尝试未能成功,征得患者家属同意后遂改行复合手术。
复合手术过程:麻醉方式、体位摆放同“患者1”。左颈锁骨上1 cm做楔型切口,暴露左锁骨下动脉及椎动脉起始部,向远端分离椎动脉V1段。临时阻断椎动脉近心端及V1远端,在迂曲远端较平直部分,沿椎动脉长轴做纵行小口,经术野直视下小心置入6 F导引导管,确保其位于真腔内(图2f,2g)。在路图引导下,将0.0356 cm微导丝(Synchro,Stryker,美国)小心通过基底动脉狭窄段,最终置入1枚2.5~8.0 mm Apollo支架[微创医疗器械(上海)有限公司,中国]。即刻DSA显示,基底动脉血流及远端灌注较前改善(图2h)。术后第2天MR扩散加权成像示左侧小脑半球少量新发梗死灶,但患者无神经功能缺损症状。第4天痊愈出院,期间眩晕未再发作。常规予以阿司匹林100 mg/d联合氯吡格雷75 mg/d双联抗血小板聚集药物治疗,阿托伐他汀钙20 mg/d调脂稳定斑块。术后3个月复查超声提示基底动脉血流通畅,停用氯吡格雷。随访9个月,症状无复发,术后6个月时超声提示基底动脉支架内血流通畅,远端轻度狭窄。

讨论颅外段颈动脉、椎动脉迂曲的发生率可达25%~40%,其发生机制目前尚不明确,可能与动脉管壁中肌纤维发育异常、动脉粥样硬化等因素有关[5-6]。单纯颈动脉、椎动脉严重迂曲即可导致远端灌注区血流动力学障碍,出现短暂性脑缺血发作及脑梗死等大脑缺血性表现,有时甚至需要外科手术或血管内介入治疗加以纠正。合并ICAS时,可进一步加重缺血症状。
按照当前指南推荐,ICAS首选药物治疗,仅对重度狭窄且药物治疗无效的患者,可考虑行介入手术[7]。有研究显示,严重的颅外段血管迂曲是导致ICAS介入手术失败或手术风险增加的主要因素[8-9]。因此,ICAS血管内治疗术前应充分评估手术路径。对于血管路径较迂曲的患者,一般可根据病变需要,选择不同型号的导管鞘或导引导管给予合适的近端支撑,进而应用同轴操作技术,借助头端柔顺的支撑导管,如Navien等尝试建立介入通路。但如经反复尝试不能到位,可以适时终止手术[10],以避免导致术中血管痉挛、导丝穿破血管、栓子脱落等并发症。
复合手术方法打破了传统手术和血管内治疗的界限,可有效治疗单一方法完成困难的复杂的动脉狭窄性病变,如串联病变、长节段闭塞再通、支架术后再狭窄等[11-12]。针对部分经严格筛选的、单纯介入治疗失败或难度较大的、症状性ICAS合并近端血管严重迂曲的患者,可应用复合手术技术实施更合理、更安全的治疗方案。本组2例患者,分别对颈动脉、椎动脉颅外段进行重建或暴露,在外科显微镜下通过手术改善介入路径,有效降低了介入风险和难度,提高了手术成功率,获得了满意效果。
与单纯介入相比,此类复合手术包含更多的有创性操作,因此在技术上更应强调严谨、规范,以减少并发症发生。如患者1中,为减少颈动脉重建后吻合口狭窄对后续治疗的影响,本中心在进行端-端吻合时,采用“降落伞”连续缝合技术,使血管对合整齐,保证吻合质量;患者2中,经术野直视下置入动脉鞘时,严格采用Seldinger技术,首先直视下经椎动脉壁上的小切口置入导丝,进而沿导丝小心置入动脉鞘,置入长度不宜过长以减少置鞘相关夹层的产生。
总之,复合手术可用于治疗颅内动脉狭窄合并近端血管迂曲病变,建议由经验丰富的术者有选择性地进行开展。