颈内动脉床突旁动脉瘤复合手术的球囊阻断技术分析
2019-08-01伍聪骆明涛张昌伟马潞孙鸿贺民
伍聪 骆明涛 张昌伟 马潞 孙鸿 贺民
床突旁动脉瘤(paraclinoid aneurysms,PA)主要指位于颈内动脉海绵窦上壁至后交通动脉起始部之间的动脉瘤,其发病率占前循环动脉瘤的5%~9%,PA可由动脉瘤占位效应引起的视野缺损就诊[1]。PA的治疗方式选择存在争议,开颅夹闭的瘤颈治愈率高、复发率低,还可明显解除占位效应,改善患者眼部症状,但很难建立近端控制,且分离和解剖暴露的风险较高;而血管内介入治疗虽然较易到达动脉瘤部位,但瘤颈完全闭塞率较低、复发率高,且无法明确减少占位效应[2]。血流导向装置提高了血管内治疗PA的治愈率,有部分缓解眼部症状的比率,但仍有发生致死性破裂出血的风险[3-5]。
复合手术可有效结合开颅夹闭和血管内介入治疗的优点[6],利用血管内途径输送球囊阻断血流,辅助开颅夹闭动脉瘤,克服开颅夹闭近端控制困难的缺点。笔者拟分析复合手术治疗PA的临床资料,以评估复合手术中球囊的安全性及有效性,总结球囊技术的价值与应用特点。
1 对象与方法
1.1 对象
回顾性连续纳入2011年 7月至2018年7月于四川大学华西医院复合手术室完成复合手术的119例PA患者,其中男25例,女94例;年龄27~82岁,平均(57±15)岁;29例(24.4%)患者表现为视力下降,62例(52.1%)有头晕、头痛症状,余28例(23.5%)无明显症状;Hunt-Hess Ⅲ级3例(2.5%)、Ⅰ~Ⅱ 级42例(35.3%),余74例(62.2%)为未破裂动脉瘤;床突段动脉瘤21例(17.6%),眼段动脉瘤82例(68.9%),后交通动脉动脉瘤16例(13.4%);动脉瘤最大直径5~35 mm,平均(19±7) mm,112例(94.1%)动脉瘤直径>10 mm,仅7例动脉瘤最大径<10 mm。本研究方案经本院伦理委员会审核批准,患者或其家属均签署了知情同意书。
1.2 纳入与排除标准
纳入标准:(1)于复合手术室完成的颅内动脉瘤手术;(2)术中使用球囊辅助动脉瘤夹闭;(3)目标动脉瘤位于颈内动脉床突旁段。排除标准:(1)复合手术室单纯造影未行球囊辅助;(2)非床突旁动脉瘤;(3)合并其他颅内相关病变。
1.3 资料收集
由3名神经外科专业医师,收集年龄、性别、Hunt-Hess分级、入院眼部症状、动脉瘤部位及大小、球囊类型、手术过程及出院时状态等资料。
1.4 手术操作过程
Leica OH5手术显微镜(莱卡,美国)、东芝800D数字血管造影系统(东芝,日本)及其他相关仪器设备。患者全身麻醉后采取翼点体位,安置电生理监测电极,行右侧股动脉置血管鞘(6 F或8 F)。开颅完成后,指引导管(6 F或8 F,Envoy,强生,美国)加压袋持续滴注,在导丝指引下至患侧颈内动脉。根据球囊类型,将球囊导管置于颈内动脉海绵窦段,或骑跨瘤颈。继续开颅手术,磨除前床突,分离侧裂,充分暴露瘤颈。夹闭动脉瘤前,充起球囊,阻断血流,还可选择以临时阻断夹阻断远端血流,从而孤立动脉瘤,降低动脉瘤壁张力。选择合适动脉瘤夹夹闭,再行DSA确认,根据情况调整动脉瘤夹位置至满意。常规关颅后拔除股动脉鞘。
1.5 球囊类型
(1)Magic可解脱球囊(Balt,法国):早期复合手术采用,在体外和超滑导丝导管(Balt,法国)组装后,经8 F指引导管置入颈内动脉海绵窦段,在PA的近心端完成阻断,随后撤出体外。(2)Hyperglide封堵球囊(EV3,美国):近2年来使用,经6 F指引导管在导丝指引下整体骑跨动脉瘤颈,充盈球囊后完全阻断动脉瘤腔内血流。
1.6 随访
出院后6个月,由1名神经专业研究生电话随访出院时有神经功能缺损的患者,评估其术后意识、肢体肌力等恢复情况。
2 结果
本组PA病例中95例采用Magic可解脱球囊近端阻断血流,24例使用Hyperglide封堵球囊在动脉瘤颈骑跨阻断瘤腔内血流。
2.1 术中结果及相应处理
119例中,1例患者因瘤颈部钙化明显,无法夹闭,以碎纱包裹加固处理;5例患者夹闭时瘤颈及颈内动脉撕裂,以动脉瘤夹孤立颈内动脉,其中1例术中造影示对侧代偿良好,术后恢复良好,另4例出现大面积脑梗死,以去骨瓣减压,3例死亡,1例出院时仍昏迷;1例Hyperglide球囊骑跨阻断后,在穿刺抽吸瘤腔时发生球囊破裂,考虑为穿刺针刺入太深,刺破球囊,随后及时夹闭动脉瘤,患者恢复良好;1例球囊骑跨阻断时,球囊在反复充盈调整动脉瘤夹时发生移位,远端脱入动脉瘤腔被动脉瘤夹夹闭,因近端球囊仍充盈,在松动动脉瘤夹退出球囊后顺利夹闭,患者恢复良好。余111例(93.3%)均顺利夹闭动脉瘤。
2.2 术后结果及并发症
119例中,3例死亡,均为瘤颈及颈内动脉撕裂,孤立后梗死患者;5例出院时处于昏迷状态,转当地医院继续治疗;6例出院时有偏瘫症状;余105 例(88.2%)出院时均无明显神经功能缺损。
2.3 随访结果
出院后6个月对出院时神经功能缺损的11例患者进行电话随访,5例昏迷患者中,3例于出院后1周内死亡,2例意识由昏迷转为淡漠,左侧肢体肌力Ⅲ级,视物模糊同术前;6例出院时偏瘫患者中,1例于出院后3个月死亡,其余5例意识均清楚,视物模糊同术前,均有肢体偏瘫,肌力Ⅰ~Ⅱ级。
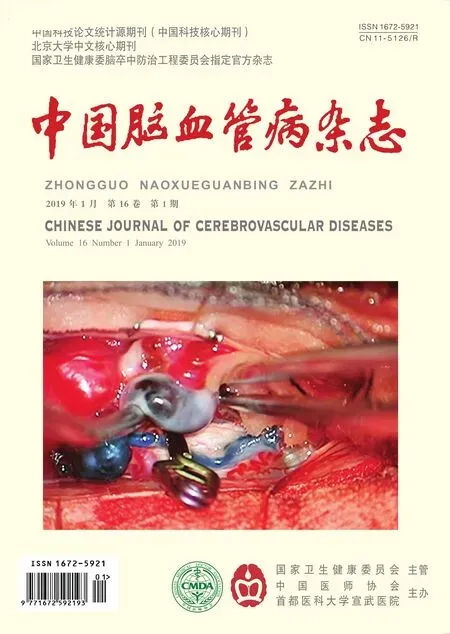
典型病例1女,48岁,因“右眼渐进性视物模糊1年,突发头痛1 d”于2013年7月31日就诊于四川大学华西医院神经外科。既往高血压病史2年,未规律服药,无卒中病史。入院体格检查:右眼视力较左侧明显下降,视野未见明显缺损。入院后脑血管造影示右侧颈内动脉PA,直径1.7 cm×2.5 cm(图1a)。完善相关检查后行复合手术开颅夹闭手术。术中介入下球囊阻断右侧颈内动脉近端血供(图1b),然后以动脉瘤夹夹闭瘤颈,夹闭后即时造影显示瘤颈完全夹闭,载瘤动脉通畅(图1c)。术后3个月门诊随访,右眼视物模糊较术前无明显变化,头痛基本消失。复查头颈部CT血管成像示:右侧颈内动脉床突上段管腔结构不清,远端分支显影良好,余血管未见异常。术后6个月电话随访,患者右眼视物模糊无明显改变,余未诉异常症状。
典型病例2女,63岁,因“头痛1周”于2018年4月8日就诊于四川大学华西医院神经外科。患者患2型糖尿病6年,规律口服降糖药物,血糖控制可。高脂血症20余年,口服他汀类降脂药物。入院前1周患者头部胀痛,右侧眶后胀痛明显。入院后体格检查:双眼白内障术后,视力无明显改善。入院后头部CT血管成像示:右侧颈内动脉巨大动脉瘤,管壁见血栓形成。完善相关检查后行复合手术开颅夹闭术。夹闭前造影示右侧床突旁一2.6 cm×1.8 cm

动脉瘤(图2a),瘤颈宽约1.2 cm,术中球囊骑跨瘤颈充盈阻断(图2b),穿刺抽吸瘤内血液,瘤体缩小后动脉瘤夹夹闭瘤颈,夹闭后即时造影示瘤颈完全夹闭,载瘤动脉通畅(图2c)。术后3个月门诊随访,患者头痛基本消失,眶后疼痛未复发。头颈部CT血管成像示:右侧床突旁金属伪影,远端通畅。术后6个月电话随访,患者情况稳定,无新发不适。
3 讨论
因床突旁大动脉瘤瘤体大、瘤颈宽,且与周围骨质、神经、血管结构的关系复杂,因而处理具有很大挑战性[1,7-8]。手术夹闭PA过程中,有效控制近端血流可减少瘤壁张力,降低术中破裂风险。但很多时候即使磨除前床突骨质,我们仍难以实现近端控制,而增加了瘤颈分离的难度和风险,使得夹闭变得更加困难[9]。尽管进行了临时阻断,由于海绵窦段侧支循环及眼动脉的逆向返流,动脉瘤壁张力依然很高,夹闭难度增加[9-10]。为了更好地控制近端血流降低瘤壁张力,Flamm[11]报道了6例直接穿刺抽吸动脉瘤顶来降低瘤壁张力的病例,其中2例为眼段动脉瘤。该研究者采用21号头皮针穿刺瘤顶,抽吸后成功夹闭动脉瘤,但此法仅适用于瘤体大瘤壁厚的动脉瘤。瘤壁薄的动脉瘤无法承受穿刺损伤,出血风险高。Batjer和Samson[12]报道颈部切开钳夹颈内动脉近心端,颅内临时阻断载瘤动脉远心端,同时以18号血管针穿刺颈部颈内动脉,接负压吸引,抽吸孤立后来源于眼动脉和海绵窦段的代偿血流,从而达到有效近端控制且降低PA瘤壁张力的作用。该方法相对Flamm[11]方法增加了近心端的血流控制,相对更加安全,但因颈部切口而使患者手术创伤增加。
引入血管内介入方法放置球囊,可达到开颅手术难以到达的区域,起到近端血流控制的作用,使动脉瘤夹闭变得更加可行,又可颈部切开暴露颈内动脉。Scott等[13]首先报道,采用介入方法将球囊置于颈内动脉颈段,充盈后临时阻断载瘤动脉,然后穿刺动脉瘤壁,夹闭床突旁眼段动脉瘤。随后,Thorell等[14]报道了4例球囊骑跨瘤颈阻断,从而辅助夹闭床突旁大动脉瘤案例,患者均成功夹闭动脉瘤,未观察到与血管内手术有关的并发症。Steiger等[15]报道2 例球囊骑跨瘤颈阻断辅助夹闭床突旁巨大动脉瘤,均成功夹闭动脉瘤,且视力缺陷得到改善。其中1 例患者在手术后15 h出现术后症状性血管痉挛,经抗高血压治疗后症状消退。
本组病例是典型的难治性复杂颅内动脉瘤。手术结果显示,利用复合手术球囊辅助夹闭可使88.2%的患者取得良好预后。因此,复合手术球囊辅助夹闭可有效治疗复杂床突旁大动脉瘤。其中,球囊的使用技术应注意以下几点[6]:(1)复合手术血管内操作前的全身肝素化用量应减半(0.33 mg/kg),可既抗凝又不影响手术止血。(2)术中随时注意指引导管加压袋的持续滴注状态,尤其在球囊充盈时,血流减缓,若无持续滴注极易形成血栓。(3)动脉瘤近端球囊阻断配合远端临时阻断夹闭并不能完全孤立PA的血流,来自海绵窦段侧支循环及眼动脉的逆向返流仍可让瘤体充盈。因此,近端球囊应尽量靠近眼动脉起始部,如瘤壁张力仍影响夹闭,还可考虑临时夹闭眼动脉阻断部分返流。(4)封堵球囊骑跨过整个动脉瘤颈,可完全阻断血流,做到在无血状况下操作。充盈时对载瘤动脉有支撑作用,可辅助动脉瘤夹对血管进行塑形。但球囊位置已进入手术操作区域,且高顺应性球囊充盈时部分侧壁可能突入动脉瘤腔,要注意保护球囊,避免破裂或误夹。首先,对载瘤动脉直径和球囊充盈剂量要有预判,避免过度充盈;其次,阻断后穿刺瘤体时进针要尽量浅,避免刺破球囊壁;再次,可先与载瘤动脉一定距离处暂时夹闭瘤体,适当缩小球囊体积后再夹闭瘤颈及重塑颈内动脉。
复合手术中,除上述两种球囊阻断方法外,文献报道利用球囊指引导管(Stryker,美国)达到近端控制作用[16]。这种指引导管头端管壁外侧附有球囊,可独立充盈,不影响导管通过性。将其放于颈内动脉颈段,充盈球囊阻断近端血流,同时可通过导管抽吸代偿的返流,有效达到降低瘤壁张力作用。国内报道复合手术治疗床突旁大动脉瘤8例,其中5 例采用球囊导管控制载瘤动脉,动脉瘤均成功夹闭,且患者预后良好[16]。该方法虽不能完全阻断动脉瘤腔内血流,但可降低瘤壁张力辅助夹闭,更便于经导管造影,为复合手术球囊阻断提供了新的选择。
综上所述,在复合手术治疗复杂PA时,利用各种血管内球囊阻断技术,可以更简单地到达开颅手术难以暴露的区域,建立PA的近端血流控制,增加手术安全性,拓宽了开颅夹闭术的应用范围,使得原本难以夹闭的动脉瘤通过夹闭方式得到根治。另外,球囊阻断结合瘤壁或者颈内动脉近端的抽吸减压,可以更好地降低张力,更利于夹闭时进行血管塑形。最后,复合手术的球囊应用也有其技术特点,我们应该不断地总结,避免并发症,为难治性复杂PA患者提供更好的治疗效果。