经鼻肠内营养对食管癌患者术后并发症、免疫功能及康复进程的影响
2019-07-31李岩
李岩
菏泽市立医院胸外科,山东菏泽 274000
食管癌典型症状为吞咽障碍,进食难度大,机体多出现不同程度营养减退情况,免疫功能有所下降[1]。加上手术创伤引发的高代谢、应激反应及免疫损伤会进一步加重营养减退,不利于患者预后,且严重时可能引发感染等相关并发症,威胁患者性命[2]。为此术后早期加强营养支持至关重要。临床上营养支持主要分为肠内营养与肠外营养,不同营养支持方式、营养物质可能对患者肠道恢复、预后的影响不一。该研究对该院2016年2月—2018年2月行食管癌根治术的90例患者相关资料进行回顾性分析,探讨经鼻肠内营养对食管癌患者术后并发症、免疫功能及康复进程的影响。现报道如下。
1 资料与方法
1.1 一般资料
收集该院收治的食管癌患者90例。入选条件:①均经病理检查证实,且均行食管癌根治术;②符合《中国肿瘤营养治疗指南(2015年版)》中营养支持适应证;③知情并同意实施相关营养支持方案;④相关资料完整;⑤经过伦理委员会的批准。排除标准:①合并严重高血压等慢性疾病;②器质性病变、其他恶性肿瘤;③手术或营养支持禁忌证;④精神障碍;⑤中途更换成其他营养干预手段;⑥有对营养指标影响相关疾病。其中男54例,女36例;年龄 36~83 岁,平均(54.16±6.50)岁;TNM 分期:I期 6 例,II期23例,III期44例,IV期17例;分化程度:高分化61例,中分化21例,低分化8例;肿瘤位置:中段70例,下段20例。根据不同营养方式将患者分为观察组(n=50)与对照组(n=40)。性别、年龄、TNM分期、分化程度等基线资料两组比较差异无统计学意义(P>0.05),见表1。
1.2 方法
两组患者均择期行食管癌根治术,术前8 h禁饮食,术中鼻胃管留置。由专业、资深医生主刀。所有患者术后早期接受营养支持,观察组术后给予经鼻肠内营养支持方案:术中螺旋型鼻肠管留置,术后4 h指导患者口服温水,对口腔湿润,术后6~8 h经鼻注入温生理盐水0.5 L。术后第1天开始鼻饲糖盐水0.2 L,佰通肠内营养泵泵入肠内营养液百普力[规格:500 mL(1Kcal/mL)/瓶,国药准字H20010285] 或瑞能 (规格:500 mL/袋,国药准字J20090045),第1天泵入目标热量的1/4,第2天泵入目标热量的1/2,术后第3天到1周泵入全量,之后慢慢减少泵入量,到过渡至正常饮食。对照组则行肠外营养支持:术后第1天开始输注葡萄糖、维生素、氨基酸、电解质混合液,总热量依据125.52 kH/kg计算,使用8~10 d后慢慢过渡到正常饮食。
1.3 观察指标
统计两组患者首次排气时间、排便时间、创口愈合时间、住院时间及术后并发症(如吻合口瘘、切口感染、肺部感染)发生率。术后第1天(营养干预前)、术后第8天抽血测定相关指标,营养指标——血清白蛋白(ALB)、前白蛋白(PA)、血清总蛋白(TP)通过迈瑞BS-350全自动生化分析仪测定;细胞免疫指标——CD3+、CD4+、CD8+通过迈瑞BriCyte E6流式细胞仪测定,计算CD4+/CD8+;体液免疫指标——IgA、IgM、IgG通过免疫比浊法测定。
1.4 统计方法
采用SPSS 17.0统计学软件分析数据。计数资料以[n(%)] 描述,行χ2检验或连续性校正χ2检验;计量资料以(±s)表示,行t检验;P<0.05 为差异有统计学意义。
2 结果
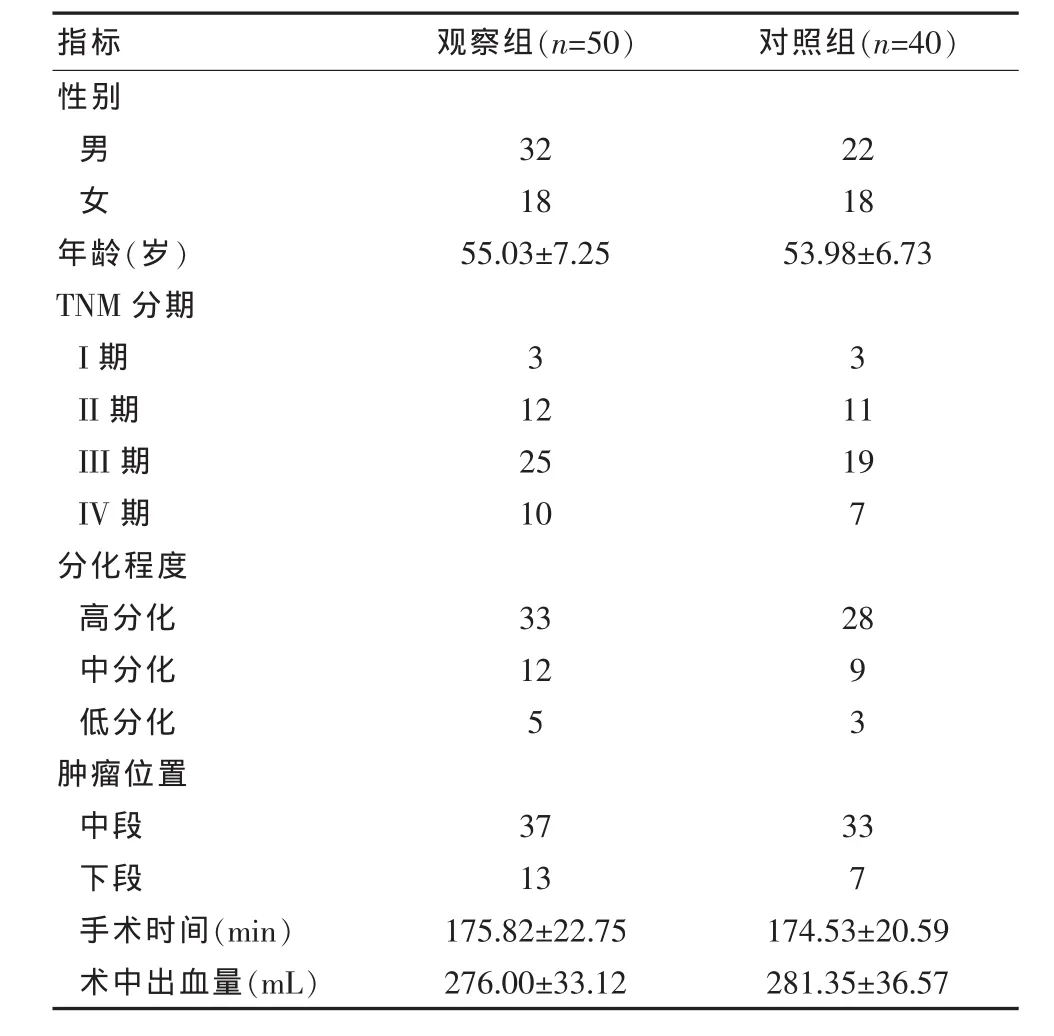
表1 两组患者基线资料比较
2.1 首次排气时间等指标
观察组首次排气时间、排便时间、创口愈合时间、住院时间比对照组均显著短(P<0.05)。见表2。
表2 两组患者首次排气时间等相关指标比较(±s)
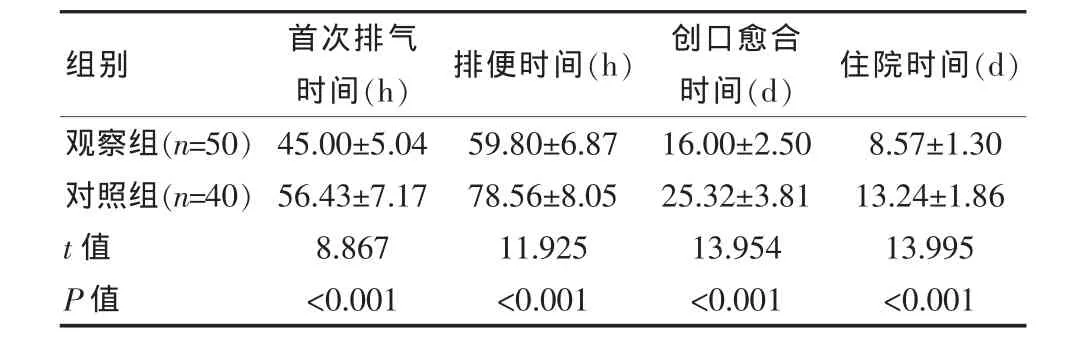
表2 两组患者首次排气时间等相关指标比较(±s)
组别 首次排气时间(h) 排便时间(h) 创口愈合时间(d) 住院时间(d)观察组(n=5 0)对照组(n=4 0)t值 P值4 5.0 0±5.0 4 5 6.4 3±7.1 7 8.8 6 7<0.0 0 1 5 9.8 0±6.8 7 7 8.5 6±8.0 5 1 1.9 2 5<0.0 0 1 1 6.0 0±2.5 0 2 5.3 2±3.8 1 1 3.9 5 4<0.0 0 1 8.5 7±1.3 0 1 3.2 4±1.8 6 1 3.9 9 5<0.0 0 1
2.2 并发症情况
吻合口瘘、切口感染、肺部感染、消化道不适方面两组比较差异无统计学意义(P>0.05)。见表3。
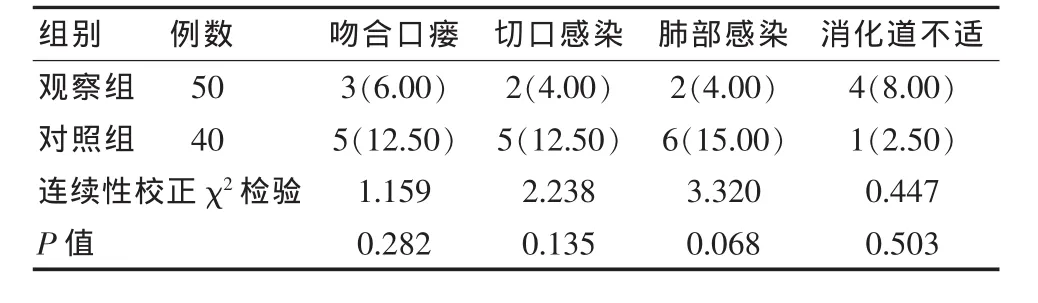
表3 两组患者术后并发症比较[n(%)]
2.3 营养指标
术后第1天,两组ALB、PA、TP水平比较差异无统计学意义(P>0.05);术后第 8 天,两组 ALB、PA、TP 水平比术后第1天均明显上升,且观察组均明显高于对照组,差异有统计学意义(P<0.05)。 见表 4。
表4 两组患者治疗前后营养指标比较(±s)
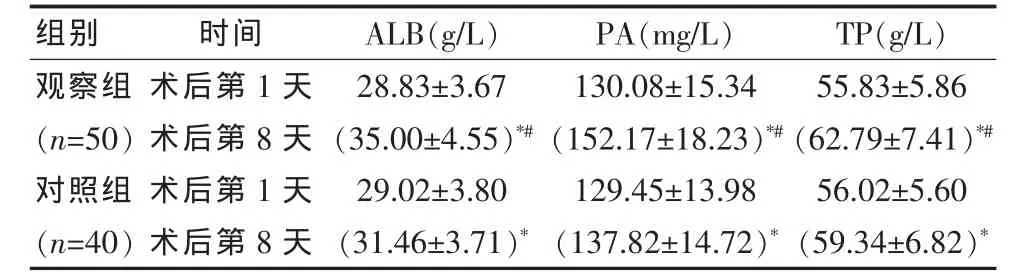
表4 两组患者治疗前后营养指标比较(±s)
注:与同组术后第 1 天比较,*P<0.05;与对照组比较,#P<0.05。
组别 时间 A L B(g/L) P A(m g/L) T P(g/L)观察组(n=5 0)对照组(n=4 0)术后第1天术后第8天术后第1天术后第8天2 8.8 3±3.6 7(3 5.0 0±4.5 5)*#2 9.0 2±3.8 0(3 1.4 6±3.7 1)*1 3 0.0 8±1 5.3 4(1 5 2.1 7±1 8.2 3)*#1 2 9.4 5±1 3.9 8(1 3 7.8 2±1 4.7 2)*5 5.8 3±5.8 6(6 2.7 9±7.4 1)*#5 6.0 2±5.6 0(5 9.3 4±6.8 2)*
2.4 免疫功能
术后第1天,两组细胞及体液免疫功能指标比较差异无统计学意义(P>0.05);术后第 8 天,两组 CD3+、CD4+、CD4+/CD8+、IgA、IgM、IgG水平比术后第1天均明显上升,CD8+明显下降,且观察组上升或下降幅度均明显大于对照组,差异有统计学意义(P<0.05)。 见表 5。
3 讨论
受肿瘤自身、年龄、手术创伤、术后饮食控制等多种因素影响,食管癌患者机体营养状态较差,免疫功能低下[3-4]。为此术后需加强患者营养支持,便于患者康复[5]。
表5 两组患者治疗前后免疫功能指标比较(±s)
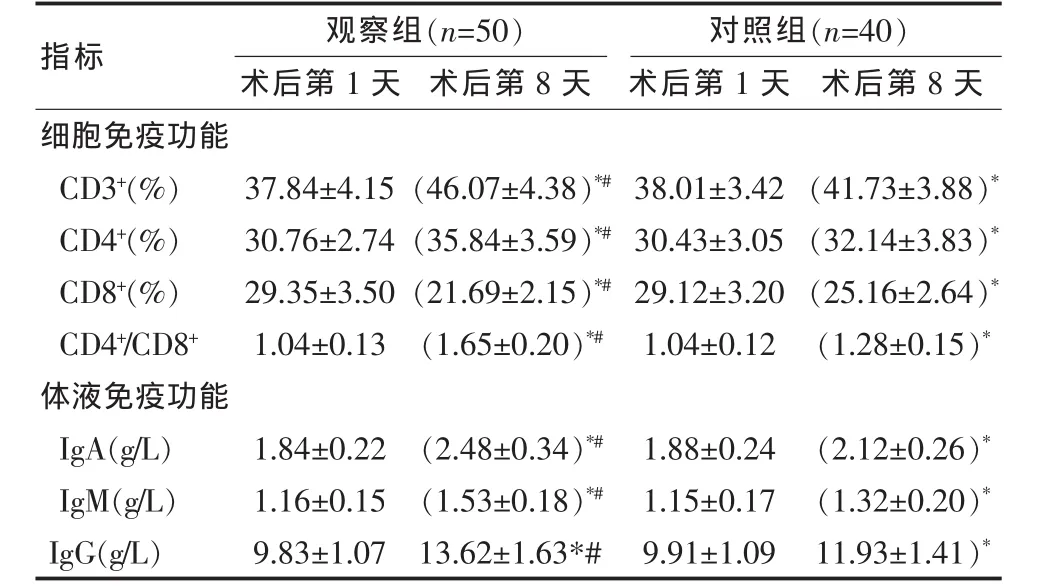
表5 两组患者治疗前后免疫功能指标比较(±s)
注:与同组术后第 1 天比较,*P<0.05;与对照组比较,#P<0.05。
指标细胞免疫功能C D 3+(%)C D 4+(%)C D 8+(%)C D 4+/C D 8+体液免疫功能I g A(g/L)I g M(g/L)I g G(g/L)观察组(n=5 0)术后第1天 术后第8天对照组(n=4 0)术后第1天 术后第8天3 7.8 4±4.1 5 3 0.7 6±2.7 4 2 9.3 5±3.5 0 1.0 4±0.1 3(4 6.0 7±4.3 8)*#(3 5.8 4±3.5 9)*#(2 1.6 9±2.1 5)*#(1.6 5±0.2 0)*#3 8.0 1±3.4 2 3 0.4 3±3.0 5 2 9.1 2±3.2 0 1.0 4±0.1 2(4 1.7 3±3.8 8)*(3 2.1 4±3.8 3)*(2 5.1 6±2.6 4)*(1.2 8±0.1 5)*1.8 4±0.2 2 1.1 6±0.1 5 9.8 3±1.0 7(2.4 8±0.3 4)*#(1.5 3±0.1 8)*#1 3.6 2±1.6 3*#1.8 8±0.2 4 1.1 5±0.1 7 9.9 1±1.0 9(2.1 2±0.2 6)*(1.3 2±0.2 0)*1 1.9 3±1.4 1)*
“静脉高营养”于1968年第一次被提出,之后关于外科营养干预的研究不断,营养干预方式或营养物质不断更新,目前认为外科营养支持不仅需为机体提供能量,维持氮平衡等,而且还要促胃肠功能恢复,调整免疫功能,减轻炎症反应,对细胞、组织器官功能保护,以最终促患者康复[6]。肠外营养即静脉营养,通过静脉注射为患者提供热量、电解质等营养物质,可改善营养减退患者营养状况,或维持进食难度大患者营养状况,有利于创伤愈合。肠内营养指的是通过胃肠道为患者提供代谢所需营养物质,由于食管癌患者多吞咽困难,为此临床上对该类患者行肠内营养干预时选择鼻饲。张邦辉等[7]研究发现早期肠内营养相比肠外营养不仅能明显改善老年食管癌患者营养状况,而且能明显降低并发症发生率,调节体液免疫功能。何通等[8]研究发现相比常规肠内营养,肠内免疫营养能明显增强食管癌患者术后抗肿瘤免疫引发,促机体肠黏膜屏障功能恢复。该研究以肠外营养为对照,结果显示早期经鼻肠内营养支持能明显缩短食管癌患者术后胃肠功能恢复时间,加快创伤愈合,促其早日出院。这可能与早期肠内营养通过胃肠道直接提供相关营养物质,有利于胃肠道激素分泌,改善肠黏膜功能,促肠蠕动有关。而创伤愈合时间短可能与早期肠内营养明显改善机体营养状况及免疫功能有关,该研究早期肠内营养支持后观察组 ALB、PA、TP (35.00 ±4.55)g/L、 (152.17 ±18.23)mg/L、(62.79±7.41)g/L均显著上升,对照组也显著上升,差异有统计学意义(P<0.05)。与雕丽琼等[9]研究结果相符,其指出了,营养组患者放疗前血红蛋白、白蛋白、前白蛋白和体质量等营养学指标(122.3±14.1)g/L、(66.8±0.5)g/L、(37.2±3.9)g/L、(209.1±6.0)mg/L、(62.2±0.7)kg 对比放疗后差异无统计学意义(P>0.05)。常规组患者放疗后营养学相关指标 (78.2±12.9)g/L、(57.2±1.0)g/L、(29.6±3.3)g/L、(136.0±4.8)mg/L、(55.1±0.6)kg 较放疗前降低,差异有统计学意义(P<0.05)。并发症方面,肠内营养可能引发消化道不适、吻合口瘘等,该研究结果显示观察组消化道不适比对照组多,但其吻合口瘘、切口感染、肺部感染3例(6.00%)、2例(4.00%)、2例 (4.00%), 较对照组 5 例 (12.50%)、5例(12.50%)、6 例(15.00%)少,分析其原因:吻合口瘘发生可能与术后切口张力变大有关,而早期肠内营养能更早的恢复胃肠功能,有利于切口张力减少,进而减少吻合口瘘出现;切口感染、肺部感染可能与机体营养状况、免疫功能有关,早期肠内营养在这些方面相比肠外营养有优势,术后可早期下床活动。但两组并发症发生率比较均无显著差异,这可能与该研究样本例数少或并发症发生原因多(其他要素占主导)有关。
免疫功能在肿瘤发病、营养状况、功能康复等方面发挥不同程度的作用[10],近年来关于免疫功能与肿瘤的关系相关报道较多。机体免疫功能有体液与细胞功能两种,其中细胞免疫功能与T淋巴细胞亚群相关,CD3+主要对整体免疫情况反映(即总T细胞);CD4+对免疫应答正调节,CD8+则对免疫应答负调节,而CD4+/CD8+对免疫系统内环境稳定与否反映,其值显著下降表示免疫功能下降,增加感染风险,且会加重病情[11]。体液免疫功能通过免疫球蛋白评价,其中IgA对即时免疫功能状况反映,对黏膜屏障防护中一定的作用;IgM能二次免疫;IgG在抗菌、抗病毒过程中发挥重要作用,也能反映机体免疫功能状况。该研究结果显示早期肠内营养相比肠外营养能明显改善机体细胞及体液免疫功能。肠道在免疫防护中占据重要作用[12]。肠外营养虽能短时间内帮助患者补充热量、氮等营养物质,但长时间应用可能对机体免疫功能影响,不利于其改善。早期肠内营养对正常生理状态模拟,可维持黏膜屏障功能,改善免疫抑制,促免疫功能调节。有研究发现,肠内免疫营养相比普通肠内营养能进一步增强食管癌患者免疫功能,减少术后感染发生。该研究以肠外营养为对照组,CD3+、CD4+、CD4+/CD8+、IgA、IgM、IgG (46.07±4.38)%、(35.84±3.59)%、(1.65±0.20)、(2.48±0.34)g/L、(1.53±0.18)g/L、(13.62±1.63)g/L 均显著上升,CD8+(21.69±2.15)%显著下降; 观察组术后第 8 天 CD3+、CD4+、CD4+/CD8+、IgA、IgM、IgG 均显著高于、CD8+显著低于对照组(P<0.05)。 但是,未对肠内营养方式细分,探讨肠内营养最佳方式,关于这一点受到该研究样本例数少影响,对此有待日后通过大样本、多中心研究进一步分析。
综上所述,鼻肠内营养支持能有效促食管癌患者术后肠道功能恢复,缩短切口愈合时间、住院时间,能明显改善患者营养状况及免疫功能。
