铜绿假单胞菌对烟曲霉菌不同时期的抑制作用观察
2019-07-31李更森孔晋亮罗劲
李更森 孔晋亮 罗劲
对于各种原因导致的呼吸道慢性感染患者而言,长期反复及经久不愈的感染不仅会增加病死率、降低生活质量、加重心理负担,亦会大大增加医疗资源的消耗。在众多呼吸道慢性感染的常见致病菌中,铜绿假单胞菌及烟曲霉菌是最常见的条件致病菌,且两者常常混合存在,尤其见于老年慢性感染患者中[1]。既往的相关研究已经明确,铜绿假单胞菌及其产生的小分子物质如葵醇、葵酸、十二醇等能够抑制烟曲霉生物被膜的形成[2]。但其对烟曲霉孢子期及菌丝期、早期生物被膜的作用研究目前尚未涉及。烟曲霉在生长过程中经历的几个阶段各有特点:在第4小时孢子黏附;8h孢子开始萌芽;10~12h菌丝延长形成单细胞层;16~20h菌丝缠绕形成多层立体结构;24h形成早期生物被膜;48~72h生物膜逐渐成熟[3]。为观察铜绿假单胞菌对烟曲霉不同时期(孢子期、菌丝期、早期生物被膜)的作用特点,从而进一步了解铜绿假单胞菌对烟曲霉菌的抑制作用及机制,为临床用药时限及治疗铜绿假单胞菌、烟曲霉菌的混合感染提供参考依据。本实验通过体外建立铜绿假单胞菌分别与烟曲霉孢子、烟曲霉菌丝期及烟曲霉早期生物被膜混合的三种模型检测所形成的生物被膜量,用结晶紫半定量法、二甲氧唑黄(XTT)比色法、正置电子显微镜,从半定量角度和形态学比较这三种混合模型的差异及差异形成的具体机制。
1 材料与方法
1.1 菌株及主要实验材料野生型铜绿假单胞菌菌株PAO1(本实验室保存);烟曲霉菌株(我院检验科2017年7~9月临床分离烟曲霉共3株)。马铃薯葡萄糖琼脂培养基(PDA,中国路桥技术责任有限公司);RMPI-1640粉(Gibico公司);3-(N-吗啉基)丙磺酸-4-吗啉丙磺酸(MOPS,美国Sigma公司);结晶紫粉末(天津红岩试剂厂)溶解于灭菌去离子水配制成浓度为0.5%的结晶紫溶液;XTT细菌增殖及细菌毒性检测试剂盒(美国Sigma公司)。圆形玻璃细胞爬片(直径13mm,天津博泰克科技公司)作为生物被膜载体,高压灭菌备用;智能生化培养箱(常州市伟嘉仪器制造有限公司SPX250);酶标仪(美国 Thermo Multiskan MK3);正置荧光相差显微成像系统(OL YMPUS BX53F)。
1.2 铜绿假单胞菌菌液及不同时期烟曲霉菌的制备
1.2.1 铜绿假单胞菌野生菌株菌液的制备 挑取PAO1单菌落,接种于20ml MOPS缓冲后pH为7.0的RPMI-1640液中,37℃恒温摇床孵育20~24h(转速220r/min)后,分别用MOPS缓冲后pH为7.0的RPMI-1640液稀释10倍,使其终浓度均为1×106CFU/ml。
1.2.2 烟曲霉孢子悬液的制备 受试烟曲霉菌株接种至PDA斜面培养基,37℃恒温复苏72h,转接种于另一PDA斜面培养基37℃活化72h,用8ml含0.025%Tween-20的PBS冲洗PDA斜面收集孢子,20ml MOPS缓冲后pH为7.0的RPMI-1640重悬孢子,血细胞计数板调节孢子浓度为1×106CFU/ml,作为建立体外混合菌液孢子悬液。
1.2.3 烟曲霉菌丝期的制备 受试烟曲霉菌株接种至PDA斜面培养基,37℃恒温复苏72h,转接种于另一PDA斜面培养基37℃活化72h,用8ml含0.025%Tween-20的PBS冲洗PDA斜面收集孢子,20ml MOPS缓冲后pH为7.0的RPMI-1640重悬孢子,血细胞计数板调节孢子浓度为1×106CFU/ml,于预混前16h接种于灭菌24孔细胞培养板。
1.2.4 烟曲霉早期生物被膜的制备 受试烟曲霉菌株接种至PDA斜面培养基,37℃恒温复苏72h,转接种于另一PDA斜面培养基37℃活化72h,用8ml含0.025%Tween-20的PBS冲洗PDA斜面收集孢子,20ml MOPS缓冲后pH为7.0的RPMI-1640重悬孢子,血细胞计数板调节孢子浓度为1×106CFU/ml,于预混前24h接种于灭菌24孔细胞培养板。
1.3 菌株分组及处理每孔已事先各放置一枚灭菌圆形玻璃细胞爬片。各孔液体总量为1 000μl。实验分为4组:PAO1+烟曲霉孢子(孢子组);PAO1+烟曲霉菌丝(菌丝组);PAO1+烟曲霉早期生物被膜(早期生物被膜组);空白组。其中菌丝组中已于16h前将制备好的烟曲霉孢子悬液放置于相应孔中,早期生物被膜组中已于24h前将制备好的烟曲霉孢子悬液放置于相应孔中,并于37℃恒温箱中孵育。16h或24h后用灭菌PBS轻轻漂洗去除相应组中浮游菌。
1.4 烟曲霉生物被膜厚度观察按照上述方法混合24h后,弃去培养基,用灭菌PBS轻轻漂洗各孔3次以去除浮游菌,并尽量抽净各孔内剩余PBS。于各孔加入2%戊二醛溶液1ml室温固定2h。吸净戊二醛后室温干燥。各孔加入0.5%结晶紫1ml染色15min,再轻轻漂洗每孔内未粘附的结晶紫,室温干燥后每孔加入1ml 95%乙醇溶液脱色10min。各孔吸取100μl洗脱液加入96孔板。酶标仪590nm波长测定各孔吸光度值。每组每次分别设置3个复孔取其平均值,实验独立重复3次。
1.5 烟曲霉生长动力学检测按照上述方法混合24h后,弃去培养基,用灭菌PBS轻轻漂洗各孔3次以去除浮游菌,并尽量抽净各孔内剩余PBS。各孔加入 500μl XTT和维生素 K3混合溶液,于35℃~37℃避光静止孵育2~3h。吸取100μl孔内的XTT和维生素K3混合液,置于96孔酶标板中,用多功能酶标仪测定每孔在波长490 nm处的OD值。采用XTT比色法,490nm处测得各组平均OD值后计算各组内活菌的百分率(XTT%)=OD490处理组/OD490空白组×100%。
1.6 烟曲霉菌丝生长观察按照上述方法混合24h后,弃去培养基,用灭菌PBS轻轻漂洗各孔3次以去除浮游菌,并尽量抽净各孔内剩余PBS。于各孔加入2%戊二醛溶液1ml室温固定2h。吸净戊二醛后室温干燥。各孔加入0.5%结晶紫1ml染色15min,室温干燥后分别于放大5倍、10倍显微镜镜下观察。
1.7 统计学方法采用SPSS 18.0统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,多组间比较用单因素方差分析及LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 结晶紫法半定量检测结果混合后共同培养24h测得的OD值进行比较,肉眼可见:早期生物被膜组较菌丝组厚度增加且染色明显加深,菌丝组较孢子组厚度增加且染色加深。三组OD值两两比较差异均有统计学意义(P<0.05)。见表1。

表1 590nm处测得各组平均OD值(结晶紫原位染色法)
2.2 XTT比色法对三组生长动力学检测结果混合后共同培养24h测得的OD值进行比较,肉眼可见:早期生物被膜组较菌丝组橙红色明显加深,菌丝组较孢子组橙红色加深。三组OD值两两比较差异均有统计学意义(P<0.05)。见图1。
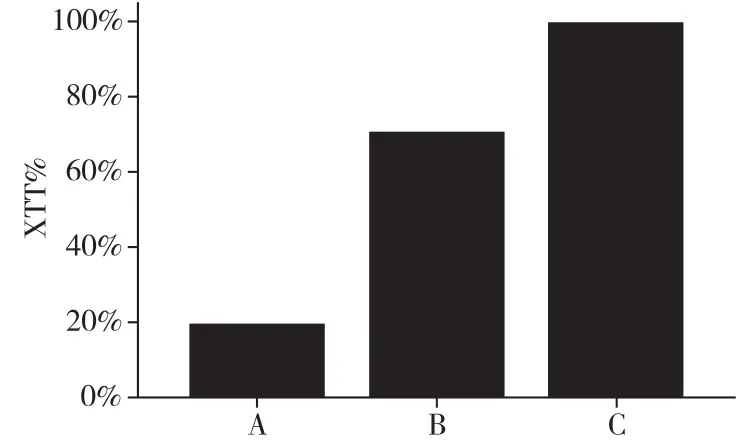
图1 XTT比色法对三组生长动力学检测结果
2.3 正置显微镜观察各组结构早期生物被膜组菌丝密度高,较致密。菌丝组所形成的菌丝密度及数量均较早期生物被膜组减低。孢子组几乎未见完整菌丝形成。见图2。

图2 显微镜下各组结构
3 讨论
临床中呼吸系统疾病如支气管扩张、慢性阻塞性肺疾病继发肺感染、肺结核等常见疾病,其患者的肺部是受复杂微生物生态影响的独特环境。但目前为止,对于如支气管扩张继发感染的肺内常见细菌-真菌混合感染的相关研究相对较少。在这种细菌-真菌的混合感染中,细胞-细胞之间的信号传导系统被认为起着主要作用。细菌与真菌在该种微环境中相互竞争及协作的关系有助于其在肺内持续存在的能力。铜绿假单胞菌及烟曲霉菌经常会被从支气管扩张的患者深部痰液分离出来,通常,年满18岁的支气管扩张患者,会有80%左右感染铜绿假单胞菌,而这部分患者中烟曲霉菌的感染率会有些变化[4,5]。但一项关于临床抗真菌及抗细菌药物对于支扩患者感染铜绿假单胞菌及烟曲霉菌的作用研究表明,铜绿假单胞菌不能完全抑制烟曲霉菌[6]。以上这些数据显示铜绿假单胞菌和烟曲霉菌之间存在拮抗关系,这种拮抗关系与烟曲霉菌的状态及不同时期阶段有关。在烟曲霉孢子期加入铜绿假单胞菌混合24h后,可见烟曲霉仍呈孢子状态,几乎很少萌发成菌丝,说明铜绿假单胞菌对孢子期的烟曲霉均有明显的抑制作用。这种情况可能与烟曲霉菌受到铜绿假单胞菌分泌的一些小分子物质如葵醇、葵酸、十二醇等所形成的抑制作用有关。对于烟曲霉菌丝期加入铜绿假单胞菌混合作用24h后,可见有较多烟曲霉菌丝形成,但有些菌丝的萌发能力不全即不能形成完整的菌丝结构,菌丝胞壁厚度相对较薄。说明铜绿假单胞菌对菌丝期的烟曲霉仍具有一定的抑制其生长萌发的作用,但相对于孢子期的抑制作用则大大减弱。这可能与此时烟曲霉菌丝所形成的胞外基质中已含有较多的β-1,3-葡聚糖,铜绿假单胞菌通过分泌其自身的密度感应信号分子las、rhl、pqs来抑制烟曲霉中的β-1,3-葡聚糖,从而抑制烟曲霉菌丝的生长有关。但是这种抑制作用远不及烟曲霉本身萌发成菌丝及菌丝继续生长的能力。对于烟曲霉早期生物被膜形成后加入铜绿假单胞菌混合作用24h后,无论从结晶紫半定量检测还是XTT比色法生长动力学检测,亦或是显微镜下直观观察烟曲霉菌所形成的状态,均证实,此期加入的铜绿假单胞菌对于烟曲霉菌所形成的早期生物被膜相对于前两组而言均无明显的抑制作用,烟曲霉菌丝密度大,菌丝胞壁较厚,可见满视野的成熟完整菌丝结构。众所周知,生物被膜的特性完全不同于浮游菌的生物学特性,混合菌形成的混合生物被膜中,细菌和细菌或细菌和真菌之间的相互作用是通过密度感应分子来相互作用的。对于铜绿假单胞菌而言,其主要的密度感应系统包括las、rhl、pqs三个系统。而对于烟曲霉而言,其主要的密度感应系统目前还没有明确定论。此时除了烟曲霉菌丝所形成的胞外基质中已含相当多的β-1,3-葡聚糖外,有研究表明,烟曲霉在形成生物被膜过程中会产生胶霉毒素[7],胶霉毒素(gliotoxin,GT)是一种重要的疏水性真菌代谢产物,属于表聚硫代哌嗪二酮类化合物(Epidithiodiketopiperazines,ETPs)[8]。已有研究表明,与传统培养条件(低氧、室温)相比,37℃条件下培养的烟曲霉生成GT的速度明显加快,培养24h即可检测到GT,培养48~72h达到峰值,且烟曲霉生成GT具有氧气依赖性[9,10]。两者均会对铜绿假单胞菌产生抵抗作用,从而削弱了铜绿假单胞菌对烟曲霉菌生物被膜的抑制作用。
综上所述,铜绿假单胞菌对于烟曲霉菌孢子期及菌丝期均有抑制作用,而对烟曲霉已经形成的早期生物被膜而言这种抑制作用明显减弱。预示着在生物体内定植的铜绿假单胞菌会对烟曲霉菌具有抑制作用,在临床药物研究中可研发一些与铜绿假单胞菌相关的小分子物质来抑制烟曲霉菌,产生一种新的疗法,以更有效地管理曲霉菌病。
