乳酸菌代谢低聚糖机理的研究进展
2019-07-30卢艳青于海燕田怀香
陈 臣 卢艳青 于海燕 田怀香
(上海应用技术大学 香料香精技术与工程学院 上海201418)
乳酸菌是一类革兰氏染色呈阳性、 发酵己糖以乳酸为主要代谢终产物的兼性厌氧细菌的总称[1],常见的包括乳杆菌属(Lactobacillus)、乳球菌属(lactococcus)、双歧杆菌属(Bifidobacterium)等。乳酸菌分布广泛, 包括营养丰富的食品, 如乳制品、肉制品、果蔬中,也包括土壤、肠道等营养贫瘠的环境。在这些环境中,乳酸菌主要通过糖酵解途径(Glycolytic pathway)、Leloir 途径(Leloir pathway)、磷酸戊糖途径(Phosphopentose pathway)及磷酸乙酮醇酶途径 (Phosphoketolase pathway)等对糖类进行分解代谢[2],代谢能量来自于同型乳酸发酵和异型乳酸发酵[3]。大部分乳酸菌是肠道中的土著菌群,主要分布在肠道的空肠、盲肠以及结肠部位, 对于宿主的健康起着非常重要的促进作用[4-5]。大量研究表明,乳酸菌在肠道中定殖数量对于其功能的发挥至关重要, 然而由于肠道的蠕动和肠道菌群的相互竞争, 大部分乳酸菌难以长期定殖。为了保证乳酸菌高效地发挥益生作用,除了要求必备粘附能力外, 利用肠道中存在的低聚糖也是其定殖的必要条件。
低聚糖(Oligosaccharides)又名寡聚糖,是由2~10 个相同或不同的单糖残基通过糖苷键连接起来的具有直链或支链结构的小分子物质。 低聚糖进入人体后, 其特殊的糖苷键组成使得不能被人体吸收而直达大肠, 选择性地供给肠道中的有益菌,如双歧杆菌和乳杆菌[6-7]。 近年来,乳酸菌如何在肠道内利用低聚糖已成为肠道微生态学研究的热点问题[8]。对微生物代谢低聚糖进行体外研究发现,并不是所有乳酸菌都能利用低聚糖,乳酸菌和低聚糖之间存在着特异性的对应关系[9]。体内情况则更加复杂。研究表明,一些肠道内存在的其它微生物, 如拟杆菌(Bacteroides)、 大肠杆菌(Escherichia coli)也可以利用低聚糖,而且肠道内不同菌群间还存在“交叉喂养(Cross feeding)”现象[10],这使得低聚糖在肠道中发挥作用的机制还不明晰。 需要通过解析乳酸菌代谢低聚糖过程中的变化和糖代谢调控方式, 进一步了解肠道微生物与低聚糖间的相互作用情况, 从而为选择合适的益生元、益生菌组合提供参考[11],为人类的肠道健康做出更大贡献。
本文主要综述乳酸菌代谢常见低聚糖分子机理的研究进展,包括低聚果糖(FOS)、低聚半乳糖(GOS)、低聚木糖(XOS)、低聚异麦芽糖(IMO)、棉籽糖系列低聚糖(RFO)及其它常见的低聚糖,分别从糖转运系统、 糖基水解酶类和代谢调控等方面进行分析和讨论,并展望未来的研究热点。
1 乳酸菌对低聚果糖的代谢
低聚果糖(Fructo-oligosaccharides,FOS)又称蔗果低聚糖,是指以2~10 个果糖基为链节,以1个葡萄糖基为链的端基, 以果糖基和果糖连接键[β-(2-1)键或β-(2-6)键)]为主体骨架连结形成的碳水化合物[12]。 FOS 广泛存在于雪莲果、朝鲜蓟、洋葱和菊苣根中[13-14]。 除具有一般功能性低聚糖的物理化学性质外[15],FOS 最引人注目的生理特性就是它能明显改善肠道内微生物种群比例,是肠道内乳酸菌活化增殖因子[11-12]。
研究表明, 乳酸菌主要通过两种方式对FOS进行分解代谢(图1):一是FOS 完整的转运进胞内后再由胞内的果糖苷酶进行水解成单糖, 然后分别进入糖酵解过程,包括植物乳杆菌(Lb. plantarum)、嗜酸乳杆菌(Lb. acidophilus)[8]、唾液乳杆菌(Lb. salivarius)和大部分双歧杆菌;另一种是先由胞外的酶对FOS 进行水解再将水解产物运输入胞内,例如在副干酪乳杆菌(Lb. paracasei)1195[16]和戊糖乳杆菌(Lb. pentosus)中,FOS 是先由胞外的果糖苷酶进行水解,形成果糖和葡萄糖,再分别将水解产物通过运输到胞内,分别转化成果糖-6-磷酸和葡萄糖-6-磷酸,进入糖酵解[6,12]。 一般编码低聚糖代谢相关功能的基因均位于同一个基因簇中,主要由编码转运系统,水解酶系及相应调控蛋白的基因组成。 例如,加利福尼亚大学的Barrangou 等[2,8]在对嗜酸乳杆菌NCFM 研究中发现一个大小为10kb 的基因簇 (msm)参与NCFM 代谢FOS 的过程,该基因簇分别编码1 个LacI 阻遏蛋白家族的转录调控子 (MsmR)、ABC 转运蛋白(MsmEFGK)、1 个果糖苷酶(BfrA)和1 个蔗糖磷酸化酶(GtfA)。 本课题组在利用转录组学技术和基因敲除手段对植物乳杆菌ST-III 利用FOS 的代谢通路进行研究时发现, 有两个大小分别为7.5 kb 和4.5 kb 的基因簇sacPTS1 和sacPTS2 均参与到植物乳杆菌对FOS 的代谢过程。 FOS 是通过sacPTS1 和sacPTS2 两个PTS 系统转运进胞内后,被胞内的果糖苷酶(SacA)水解成单糖[17]。
在乳酸菌代谢FOS 的过程中, 负责转运FOS的蛋白主要有3 种(图1):①ABC 转运系统(ATPbinding cassette), 该系统主要存在于嗜酸乳杆菌和弯曲乳杆菌(Lb. curvatus)中[18]。 它是一组跨膜蛋白, 一些不能通过扩散作用进入到细胞内的物质,可通过ABC 转运蛋白,以主动转运方式完成多种分子的跨膜转运。 ABC 转运系统大多是单向转运,可通过高保守性的ABC 结合框进行识别[18-19]。②磷酸转移酶系统 (Phosphotransferase system,PTS),属于基团移位的一种,是原核生物与古生菌独有的系统模式。 磷酸烯醇式丙酮酸(Phosphoenolpyruvic acid,PEP)将磷酰基转移至其糖类底物同时伴有PTS 糖类易位穿过细菌膜转移至胞内,该系统在杆菌、乳球菌中比较常见[20-21]。③透性酶系统,属于主动运输的一种。透性酶在细胞膜外与底物之间以高亲和力的方式牢固结合, 在能量供给的条件下,逆浓度差将物质转运到菌体内,该转运系统主要在双歧杆菌中发现[2,12]。在FOS 水解的过程中有多种酶参与,包括果糖苷酶、菊粉酶、果聚糖酶、 果聚糖β-果糖苷酶和2,6-β-果聚糖6-果聚糖水解酶等,他们都属于糖苷水解酶32 家族和68 家族[8]。 这些酶有一个共同点是结构中均含有保守域NDPNG、FRDP 和ECP,催化中心含有Asp,Glu、Cys 等[22]。
研究表明,乳酸菌的FOS 代谢过程受到宿主糖代谢调控的控制,FOS 代谢相关的基因簇在蔗糖或者FOS 存在条件下是共转录的,但是葡萄糖会抑制它们的转录和表达[23]。 近年来,各国科学家对于乳酸菌糖代谢过程中的转录调控机制做了大量的研究工作, 研究表明乳酸菌的糖代谢过程常常会受到全局调控和局部调控的双重效应, 全局调控通常由一种易被宿主所利用的糖(如葡萄糖)所诱导的代谢控制蛋白A(Catabolite control protein A,CcpA)与代谢反应元件 (Catabolite response element,Cre)的结合来完成,CcpA 与位于启动子区域或其下游的Cre 位点相结合而阻止该结构基因的转录[24]。 局部调控则是局部转录因子(也称阻遏蛋白)在无诱导物存在时,与相应的结合位点结合使得结构基因不能正常转录; 诱导物存在时,转录因子与之结合,转录因子从结合位点上脱离,RNA 聚合酶启动结构基因的正常转录[25]。在对FOS 代谢调控的研究中,Goh 等[16,23]在副干酪乳杆菌1195 代谢FOS 的相关基因簇中发现了局部调控因子fosR, 同时也发现了潜在的CcpA 结合位点Cre,表明该基因簇的表达受到了CcpA 和fosR 因子的双重调控;Barrangou 等[8]在研究参与嗜酸乳杆菌NCFM 代谢FOS 的msm 基因簇中发现,转录调控子SacR 对该基因簇起调控作用。 本课题组在研究植物乳杆菌ST-III 的FOS 代谢调控中发现,sacPTS1 和sacPTS2 基因簇中发现两个基因sacR1 和sacR2 编码GalR-LacI 家族类型的转录蛋白;同时在两个基因簇中均发现潜在的Cre位点和局部调控因子结合位点[12,17]。后续正在利用基于亲和力筛选的生物学策略包括凝胶迁移实验(Electrophoretic mobility shift assay,EMSA)染色质免疫共沉淀 (Chromatin immunoprecipitation,ChIP)等来鉴定转录因子与结合位点的相互作用。
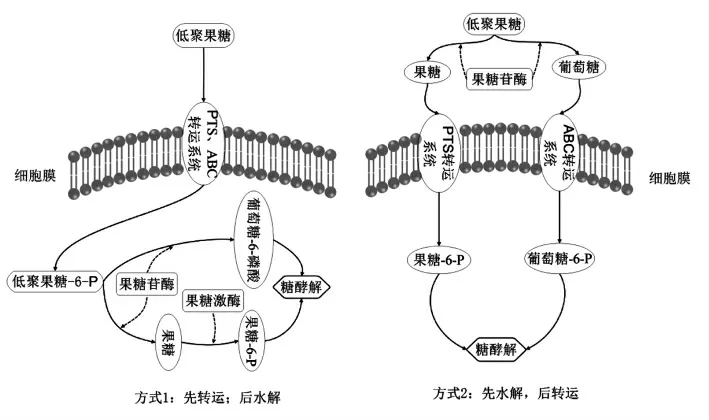
图1 乳酸菌代谢FOS 的基本途径Fig.1 Metabolic pathway of fructo-oligosaccharides in Lactic acid bacteria
2 乳酸菌对低聚半乳糖的代谢
低聚半乳糖(Galacto-oligosaccharides,GOS),是一种具有天然属性的功能性低聚糖, 其分子结构一般是在半乳糖或葡萄糖分子上连接2~8 个半乳糖基,即Gal-(Gal)n-Glc/Gal(n 为1~6)[26]。在自然界中,动物乳汁中含有微量的GOS,而人母乳中含量较多, 婴儿体内的双歧杆菌菌群的建立在很大程度上依赖母乳中的GOS 成分[27]。
研究表明, 乳酸菌主要通过两种途径对GOS进行代谢(图2):一是乳糖渗透酶(LacS)的转运和半乳糖苷酶的水解作用[3]。GOS 由LacS 进行转运,被β-半乳糖苷酶(LacZ、LacLM)水解转化为葡萄糖和半乳糖, 随后分别进入Lelior 途径和糖酵解过程[2-3,28]。 二是磷酸转移酶(LacEF)转运、磷酸化作用和磷酸半乳糖苷酶的水解作用。 GOS 可以通过LacEF 磷酸转移酶系统进行转运, 伴随着磷酸化作用PEP 转化为丙酮酸盐, 生成半乳糖-6-磷酸,随后被LacG 水解,转化成葡萄糖和半乳糖,随后进入上述代谢过程, 在乳酸乳球菌乳酸亚种(Lc. lactis subsp. lactis)和变异链球菌(Streptococcus mutans)中均发现这种代谢途径[3,28]。
LacEF/LacG 代谢途径与LacS/LacZ (或LacLM)的代谢途径有两点不同:①机体中的LacEF/LacG 代谢途径对GOS 代谢具有高度专一性[29],能同时利用葡萄糖和半乳糖, 而LacS/LacZ (或LacLM)的代谢途径是优先利用葡萄糖再利用半乳糖[9,30]。 ②LacEF/LacG 被乳糖诱导表达,而LacS/LacZ(或LacLM)在乳酸菌中的表达是组成型的,通常作为α-半乳糖苷的代谢酶,位于同一遗传基因座[30]。
参与乳酸菌代谢GOS 的基因一般也位于一个基因簇内,例如Andersen 等[21]在研究嗜酸乳杆菌NCFM 对GOS 的代谢调控中,发现一个大小为16.6kbp 的基因簇lac 参与GOS 代谢的调控,在相对复杂的乳酸菌中如弯曲乳杆菌、 约氏乳杆菌(Lb. johnsonii)和瑞士乳杆菌(Lb. helveticus)中均能发现相似基因簇的存在[31-32]。对其调控的研究表明,当嗜酸乳杆菌NCFM 分别以GOS 和葡萄糖作为唯一碳源生长时,GOS 诱导lac 基因簇基因上调,葡萄糖则抑制该基因簇的表达[21]。 通过转录水平的分析表明,嗜酸乳杆菌NCFM 对GOS 代谢可能受到3 个调控蛋白CcpA、HPrK/P 和HPr 的调控,该基因簇上共发现7 个Cre 结合位点。 此外发现了两个基因编码潜在的局部调控蛋白LacR 和LBA1461。
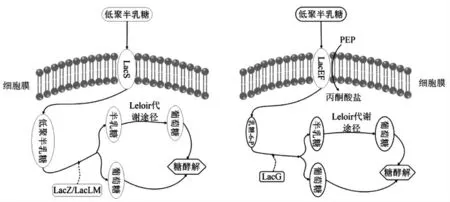
图2 乳酸菌代谢GOS 的基本途径Fig.2 Metabolic pathway of galacto-oligosaccharides in Lactic acid bacteria
3 乳酸菌对低聚木糖的代谢
低聚木糖(Xylo-oligosaccharides,XOS)又称木寡糖,是由2~7 个木糖分子以β-(1,4)糖苷键结合而成的功能性低聚糖。 低聚木糖一般是从富含木聚糖的植物(水果、蔬菜)细胞壁中提取,再通过木聚糖酶水解分离出一类非消化性低聚糖[33-34]。低聚木糖作为“肠动力源”[35],较之其他低聚糖,有效用量最少,功能最强,到达结肠后,被宿主在结肠中的微生物利用,极大改善了胃肠功能,促进了食物的消化、吸收及肠道废物的排出[36]。
XOS 主要由肠道内的双歧杆菌所利用 (图3),代谢途径包括ABC 转运蛋白的转运和胞内酶的水解作用。XOS 与细胞表面的α-阿拉伯呋喃糖酶和β-阿拉伯木糖苷酶等糖蛋白结合,通过ABC转运蛋白将XOS 转移到细胞内,随后被胞内的β-(1,4)-木聚糖酶和β-木糖苷酶水解成D-木糖,然后由木糖异构酶转化成木桐糖, 最后在木桐糖激酶的作用下再转化成木桐糖-5-磷酸[33,37]。 双歧杆菌BB-12 (B. animalis subsp. lactis BB-12)和双歧杆菌BL-04 (B.animalis subsp. lactis Bl-04)都是通过这种方式进行分解代谢, 丹麦科技大学的研究团队分别从转录组学和蛋白质组学角度对双歧杆菌BB-12 和BL-04 进行研究时发现,一个由编码ABC 转运蛋白、水解酶、转录因子和一些起媒介作用的酶组成的基因簇参与这两株双歧杆菌对XOS 对的代谢,然而其基因簇组成存在一定的差异。 在双歧杆菌BB-12 中,基因簇是由XOS降解酶、转运蛋白、D-木糖代谢酶和转录调控因子等共17 个操纵子组成的, 位于该基因簇上的BIF00212 转录子对其进行调控, 而在双歧杆菌BL-04 中, 基因簇分别编码转运蛋白、GH43 家族的β-木糖苷酶和阿拉伯呋喃糖酶、酯酶及一些起媒介作用的酶, 转录调控蛋白Reg 对该基因簇起调控作用。 当双歧杆菌BB-12 和双歧杆菌BL-04分别以XOS 和葡萄糖作为唯一碳源生长时,XOS诱导相关基因的表达, 而葡萄糖则起到抑制作用[22,33,37-38]。
4 乳酸菌对低聚异麦芽糖的代谢
低聚异麦芽糖 (Isomalto-oligosaccharides,IMO), 也称异麦芽寡糖或分枝麦芽低聚糖, 是由α-(1,6)和α-(1,4)糖苷键将葡萄糖单体进行连接而成[39-40]。IMO 广泛分布于大麦、小麦、马铃薯等植物中。 商品化的IMO 主要成分是异麦芽糖、异麦芽三糖、异麦芽四糖和潘糖,大部分在人体中不能被消化, 但可以被人体结肠中的微生物发酵所利用[41]。
乳酸菌对IMO 的代谢存在两个途径: 一是ABC 转运蛋白的转运和糖苷酶的水解作用 (图4)。在嗜酸乳杆菌和干酪乳杆菌中,IMO 通过转运蛋白(MalE,MalF,MalG 和MsmK)转运,在细胞内被3 个糖苷酶(MalN,MalL 和DexB)[42-44]水解转化成葡萄糖和异麦芽糖, 然后后者由麦芽糖磷酸化酶(MalP)转化成葡萄糖-1-磷酸,再经葡萄糖磷酸变位酶(PgmB)转化成葡萄糖-6-磷酸,随后葡萄糖进入糖酵解途径,葡萄糖-6-磷酸则进入磷酸戊糖途径[3,39,43]。MalEFG-MsmK 蛋白转运系统广泛分布在乳酸菌中, 但是加拿大阿尔伯塔大学Gnazle发现以麦芽糖作为唯一碳源所生长的乳酸菌缺少该转运系统[3]。 二是麦芽糖H+质子同向转运和糖苷酶的水解作用。 嗜酸乳杆菌中也分布着H+质子转运系统, 可以调解与代谢产物结构相关的前体物质的转化[45]。 但是关于H+质子的同向转运方式代谢IMO 的通路还不明晰,这也是未来研究IMO代谢的一个方向[45]。
关于IMO 的代谢调控的报道并不多,在嗜酸乳杆菌NCFM 的gal-lac 家族基因簇中,发现了一个由malN,malL,malP,pgmB 和ABC 转运蛋白基因mmalEFG-msmK 组成的基因操纵子参与IMO的转运和代谢, 位于操纵子基因下游的调控因子编码的蛋白MalR 对该操纵子起调控作用[46]。 IMO能够诱导基因簇中相关基因的表达, 而这些基因受到葡萄糖的抑制[47]。

图3 乳酸菌代谢XOS 的基本途径Fig.3 Metabolic pathway of xylooligosaccharides in Lactic acid bacteria

图4 乳酸菌代谢IMO 的基本途径Fig.4 Metabolic pathway of isomalto-oligosaccharides in Lactic acid bacteria
5 乳酸菌对棉籽糖系列低聚糖的代谢
棉籽糖系列低聚糖(raffinose family oligosaccharides,RFO), 是由一系列半乳糖通过α-(1-6)糖苷键连接到蔗糖上的6-葡萄糖基,主要包括棉籽糖、水苏糖和毛蕊草糖。 RFO 在甜菜、棉籽、麦类、玉米和豆科类植物等中广泛分布[48]。 人体摄入RFO 后, 由于消化道内缺乏α-D-半乳糖苷酶,水苏糖不经消化吸收可直接到达大肠内为双歧杆菌所利用,快速增殖双歧杆菌,然而,与其他低聚糖如FOS、GOS 不同的是,RFO 被看作抗营养因子,经常会导致肠胃气胀和肠道不适[49]。
乳酸菌对RFO 的代谢存在两个主要途径 (图5): 一是在细胞外,RFO 被果聚糖蔗糖酶水解,转化成α-低聚半乳糖和果糖, 随后α-低聚半乳糖转运到细胞内被α-半乳糖苷酶水解。 罗伊氏乳酸菌(Lb. reuteri)可以采用这种方式代谢RFO[3,50]。二是RFO 被整体转运进细胞内,随即被α-半乳糖苷酶水解生成蔗糖和半乳糖, 然后转化成单糖类物质, 双歧杆菌主要利用该方式进行RFO 的代谢[50-51]。
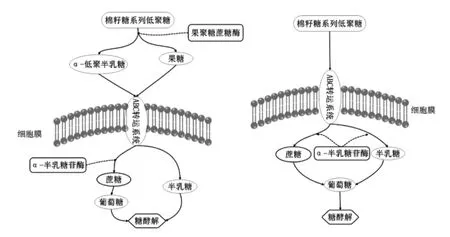
图5 乳酸菌代谢RFO 的基本途径Fig.5 Metabolic pathway of raffinose family oligo-saccharides in Lactic acid bacteria
6 乳酸菌对其它功能性低聚糖的代谢
如前所述, 乳酸菌和低聚糖之前存在着特异性的关系,一些乳酸菌,如植物乳杆菌、约氏乳杆菌、干酪乳杆菌及嗜酸乳杆菌,都具有特定的低聚糖代谢能力,可以对海藻糖、纤维二糖及人乳低聚糖等一些其他常见的低聚糖类进行分解代谢[3]。
海藻糖(Trehalose),是由两个葡萄糖分子以(1,1)-糖苷键构成的非还原性糖, 在自然界的许多可食用动植物及微生物体内都广泛存在[52]。 海藻糖的代谢主要是通过PTS 系统和磷酸果糖基水解酶。 在干酪乳杆菌(Lb. casei)及植物乳杆菌中,海藻糖可以通过PTS 转运系统将其运到细胞内,在磷酸化的作用下,形成海藻糖-6-磷酸盐,然后水解成葡萄糖和葡萄糖-6-磷酸[9,53-54]。
纤维二糖(Cellobilse)是纤维素在纤维二糖水解酶和内切葡聚糖酶的水解作用产生的终产物[3,55]。纤维二糖主要也是通过PTS 系统和磷酸果糖基水解酶的方式进行代谢, 例如干酪乳杆菌等[3,55]。
人乳低聚糖 (Human milk oligosaccharides,HMO),是母乳中除了乳糖和脂质外,含量最丰富的成分,含1%的低聚糖,主要由D-葡萄糖、D-半乳糖、N-乙酰氨基乳糖、 乳糖-N-己糖、L-岩藻糖和唾液酸等成分组成[56-58]。 然而,由于不同HMO的组成存在一定的差异,对乳酸菌分解代谢HMO机理的研究数据相对较少[9]。 对纯化过的HMO 的研究表明,乳酸杆菌能分解代谢岩藻糖和N-乙酰氨基乳糖而不能以HMO 做为生长碳源[59-60],相反,双歧杆菌在HMO 为碳源的培养基上生长良好。研究表明,双歧杆菌代谢HMO[61]主要存在两种途径,一是先转运后水解。 ABC 转运蛋白将HMO 运输到胞内,随后被多种胞内水解酶水解,由于HMO组成成分复杂,所以生成了葡萄糖、半乳糖、N-乙酰氨基乳糖等多种单糖和双糖[62-63],婴儿双歧杆菌(B. longum subsp. infantis)主要以这种形式进行代谢; 二是先水解后转运。 在两岐双歧杆菌(B.bifidum)中, 首先HMO 与膜表面的α-半乳糖苷酶、 岩藻糖苷酶和唾液酸酶及乳糖-N-己糖酶(Lacto-N-biosidase)等结合酶结合,不同的结合酶可以特异性地从HMO 中分离出对应的组分,然后分别通过相应的ABC 转运蛋白运输到细胞内,随后经胞内水解生成葡萄糖和半乳糖等单糖[64]。
7 总结与展望
乳酸菌作为肠道中土著菌群, 对人体健康起着非常重要的作用, 而低聚糖可以促进肠道乳酸菌的增殖、调节肠道菌群的平衡,是乳酸菌在肠道中定殖的必要条件。通过上述分析,可以发现一些乳酸菌利用低聚糖的共同特点。 一是不同种类的乳酸菌对不同低聚糖的代谢都有特异性,比如,嗜酸乳杆菌可以利用包括FOS、GOS 等在内的多种低聚糖,而XOS 主要被双歧杆菌利用。 二是参与乳酸菌代谢低聚糖的基因大多位于一个基因簇内,主要由编码转运系统、水解酶系及相应调控蛋白的基因组成, 但是其作用方式却不尽相同。 三是, 乳酸菌利用低聚糖分为先转运再水解和先水解再转运两种方式。对于先转运再水解来说,由于转运蛋白能力的限制, 使得他们对聚合程度低的低聚糖有更好的利用能力, 而不能利用高聚合度的糖类。而对于先水解再转运来说,由于低聚糖是在细胞外进行水解的, 使得部分水解生成的单糖也可以被周围的其它共栖菌群所利用, 对其选择性增殖并没有利。
低聚糖作为面向二十一世纪“未来型”新一代功效食品,在促进肠道中有益菌的增殖、调节肠道菌群平衡等方面对人类健康有非常积极的作用。然而肠道内菌群微生物数量繁多,种类复杂,选择特定的具有选择性增殖益生菌能力的益生元就显得十分重要。在将来的研究中,一方面要继续探索不同乳酸菌利用低聚糖的途径, 选择最合适的乳酸菌-低聚糖组合以达到更大的益生效应。 此外,截至目前研究, 只能表明乳酸菌对低聚糖代谢存在多种调控机制,但是其具体调控机理尚不明晰,因此, 研究其代谢调控机制以更好地促进乳酸菌对低聚糖的利用,是将来该领域研究的重点之一,也为进一步通过体内试验探索乳酸菌在肠道内利用低聚糖的生理活动规律并合理利用奠定基础。
