应用高通量测序技术解析清香型大曲微生物多样性
2019-07-30胡佳音赵卫鹏张如今白逢彦
周 森 胡佳音 崔 洋 赵卫鹏 张如今 白逢彦*
(1 北京顺鑫农业股份有限公司牛栏山酒厂 北京101301 2 中国科学院微生物研究所 真菌学国家重点实验室 北京101301)
中国白酒作为世界六大蒸馏酒之一, 具有悠久的历史和深厚的酒文化内涵[1],其使用大曲作为发酵剂和糖化剂,经过糖化、发酵、蒸馏和储存等步骤制得。制曲技术是我国特有的一份民族遗产,它的出现代表了一个时代的进步, 当制曲技术出现后,酒业就得到规模化、规范化、较先进的发展,从此酒就离不开曲,曲决定酒[2]。 俗语说:“有美酒必有佳曲[3]”,“曲为酒之骨[4]”的美誉,可见酒曲在白酒酿造中的重要性。
清香型白酒是我国白酒三大香型之一, 具有深厚的文化底蕴[5]。其特有的清香纯正,醇甜柔和,自然谐调,余味爽净等特点符合现代饮用要求,易与国际市场接轨,发展前景广阔。
目前, 清香型白酒酿造用曲多采用低温型大曲,其原料及生产流程基本相似。 可简单归纳为:豌豆、大麦、小麦粉碎混合后加水踩曲制成曲块,经过卧曲、上霉、晾霉、潮火、干火、后火、养曲、贮曲等环节[6]。其生产过程是依靠自然界中带入的各种微生物在淀粉质原料中进行富集生长并繁殖扩大,不同的微生物形成了大曲的菌系结构,其代谢生成的各种酶类构成了大曲的酶系, 而不同地域微生物群落组成不同, 使得不同地域酒曲带有明显的地域特色。 认识清香型大曲中不同曲种间微生物群落结构与差异, 对于研究清香型白酒发酵具有十分重要的意义。
传统微生物培养技术是指通过对微生物进行分离、纯化和培养,来获取微生物纯培养的技术,该技术简单易行, 可以获得白酒中可培养微生物数量关系及活体菌株。 由于传统白酒酿造属于开放式操作,所以环境中大量微生物在固、气、液相界面里进行复杂的物质代谢, 经过长期的驯化适应了缺氧、高渗透压、低pH 等特殊环境。 而在人工培养模式下,由于培养条件的差异,往往造成微生物之间共同协作的自然生存方式崩溃, 导致微生物可培养性不高[7]。 高通量测序(HTS)技术(又称“第二代”测序(NGS)技术)[8-9],不需要对样品微生物进行分离、纯化及培养,可以直接对样品微生物群落结构进行准确分析, 是典型的微生物分子生态学技术。目前,高通量测序技术已运用到各种分子生物学领域,如人体微生物、水中生物等方面及土壤中微生物群落研究等。 值得注意的是高通量测序往往检测到的是样品中所有DNA 序列,其中同样包含微生物死亡后存留的DNA 片段,这些DNA 片段会对高通量实时性及准确性造成一定影响。
本研究将传统培养分离方法与高通量测序技术相结合,以北京、山西、台湾、黑龙江、河北5 地的11 份清香大曲为研究对象,通过传统分离方法获得11 份大曲微生物的数量关系,并利用高通量测序技术分析11 份大曲真菌、细菌微生物的群落组成。将传统分离与高通量分析相结合,确定了清香型大曲的优势菌群, 为进一步解析清香型大曲功能微生物,筛选优良酿造微生物奠定基础。
1 材料与方法
1.1 试验材料
样品来源为北京、山西、台湾、黑龙江、河北5地的11 家清香型酒厂的清香型低温大曲。 其中,北京样品2 种标记为BJ-1、BJ-2, 山西样品4 种标记为SX-1-SX-4,台湾样品1 种标记为TW,黑龙江样品1 种标记为HLJ, 河北样品3 种标记为HB-1-HB-3。
1.2 主要仪器
BSC-1100ⅡA2 型生物安全柜,北京东联哈尔仪器制造有限公司;1-14k 高速冷冻离心机,德国Eppendorf 公司;PLR-1006+4 ℃实验室冰箱,赛墨飞世尔;FastPrep-24 样品快速制备系统, 美国MP;基础型水平电泳仪,美国BIORAD 公司;全自动凝胶成像仪,美国BIORAD 公司。
1.3 主要试剂
FastDNA SPIN Kit for Soil (MP bio 土壤基因组DNA 提取试剂盒)。
1.4 培养基
1.4.1 YPD 酵母培养基 酵母浸粉10 g, 蛋白胨20 g,葡萄糖20 g,琼脂20 g,水1 L。
1.4.2 PDA 丝状真菌培养基 马铃薯浸提液500 mL,葡萄糖20 g,琼脂20 g,水500 mL。
1.4.3 MRS 乳酸菌培养基 牛肉膏10 g, 酪蛋白胨30 g,酵母提取物5 g,葡萄糖20 g,乙酸钠5 g,柠檬酸氢二胺2 g,吐温80 1 mL,磷酸氢二钾2 g,七水合硫酸镁0.58 g,一水合硫酸锰0.25 g,琼脂12 g,水1 L。
1.4.4 孟加拉红丝状真菌培养基 北京奥博兴外购。
1.4.5 芽孢杆菌肉汁培养基 蛋白胨10 g, 牛肉膏3 g,NaCl 5 g,琼脂15 g,水1 L。
1.5 清香型大曲微生物分离方法
大曲微生物种类较多, 其主要微生物大致可分为酵母菌、丝状真菌、芽孢杆菌和乳酸菌这4 大类,采用稀释涂布计数法,利用不同的培养基和培养条件,可以较为准确的分离出以上几类微生物,其步骤如下:
将大曲样品砸碎后混匀,采用四分法取样。称取大曲样品10 g 置于装有90 mL 无菌水的250 mL 三角瓶中,摇床振荡30 min 使样品充分混匀,制成菌悬液。
将菌悬液依次做10 倍递减稀释,选取适当的稀释梯度液100 μL 涂布相应平板中(每个样品3个平行),涂布梯度、培养基及培养条件如表1。

表1 微生物分离梯度及处理条件Table 1 Media, pretreatment and incubation conditions for the isolation of microbes from Daqu samples
计数方法: 一般选择CFU (Colony-Forming Units)菌落形成单位在20~300 之间的平板进行计数。 在这个范围之外则不能正确地指示样品中微生物的真实数量。 具体计数原则如下:
为了避免虚假精确度的产生, 当进行活菌计数时,保留一位有效数字,按照四舍五入原则对其进行取舍。
每毫升菌落形成的单位(CFU)=同一稀释度3次重复的平均菌落数×稀释倍数×10
1.6 大曲总DNA 提取及高通量测序
称取1g 大曲样品,用Fastprep 处理后,根据FastDNA SPIN Kit for Soil 试剂盒步骤提取大曲样品总DNA,经琼脂糖凝胶电泳检测后,送往北京奥维森公司,进行真菌ITS1 区、细菌16S rDNA V3-V4 区高通量测序。 利用Illumina MiSeq PE300 进行高通量测序得到原始测序序列, 通过Fastqc 进行质量检测去除低质量Reads (过滤标准:Q20 ≥90%)。 通过COPE 软件(Connecting Overlapped Pair-End),进行序列拼接及过滤后利用Mothur 软件以平均邻近聚类算法(Average Neighbor Clustering Algorithm)在0.03(或97%的相似度)水平下对Clean Tags 进行OTU (operationaL taxonomic units)的聚类,统计各个样品每个OTU 中的丰度信息。选取分析数据中每个OTU中一个有代表性的序列,通过Blast 比对,获得每一个OTU 所代表的种名[10]。
2 结果与分析
2.1 清香型大曲可培养微生物分菌结果
通过图1 可以看出,11 种清香大曲微生物组成较为一致,真菌含量均比细菌高。不同大曲真菌和细菌数量及比例关系各不相同, 相互之间不具有规律性。
2.2 可培养真菌数量关系
本研究将清香型大曲中可培养真菌分为丝状真菌和酵母菌两大类。 扣囊覆膜酵母(Saccharomycopsis fibuligera)是一种在大曲中广泛存在的酵母,能够采用肉眼进行区分,酿酒酵母(Saccharomyces cerevisiae)和生香酵母(上述两种之外所有酵母菌的总称)形态差异较小易混淆,将这两种酵母归类为酵母菌进行整体分析。 因此在讨论中将真菌划分为丝状真菌、扣囊覆膜酵母、酵母菌三大类进行分析。
通过图2 可以看出,11 种大曲中扣囊覆膜酵母、丝状真菌、酵母菌的数量各不相同,不具备规律性。但在真菌组成上较为一致,扣囊覆膜酵母在11 种大曲中均为主要真菌,丝状真菌和酵母菌数量要小于扣囊覆膜酵母。 大曲中酵母菌只在SX-1、SX-3 和HLJ 中数量超过了丝状真菌,其余样品中均少于丝状真菌, 整体看来其数量要少于丝状真菌。
通过可培养真菌分离结果可以看出, 不同大曲微生物数量存在差异, 但大致可以确定出清香型大曲真菌微生物数量组成关系为: 扣囊覆膜酵母是主要真菌,其次为丝状真菌,而酵母菌数量相对较少。

图1 11 种大曲微生物计数结果Fig.1 The total of number of microbes in each of the 11 Daqu samples per gram

图2 清香型大曲可培养真菌分离图表Fig.2 Cultivable fungi isolated from light-flavor Daqu
2.3 可培养细菌数量关系
本研究将清香大曲中可培养细菌分为乳酸菌和芽孢杆菌两大类进行分析讨论。
通过图3 可以看出, 不同大曲中乳酸菌和芽孢杆菌数量之间存在较大差异且不具备规律性,如SX-1、HB-2、TW 大曲中乳酸菌数量要远远高于芽孢杆菌,SX-2、SX-3 大曲中芽孢杆菌数量却又远高于乳酸菌,HLJ 中乳酸菌与芽孢杆菌数量又相差不大。整体来看,在不同清香型大曲中,乳酸菌和芽孢杆菌分别构成了细菌优势类群。
2.4 大曲ITS 区高通量分析
对11 种大曲样品ITS 区进行数据处理后,共获得290 种OTU, 主要包括酵母目(Saccharomycetales)、毛霉目(Mucorales)、散囊菌目(Eurotiales)、丝孢酵母目(Trichosporonales)。 挑选OTU 总数前13 的序列进行分析,结果如表2。
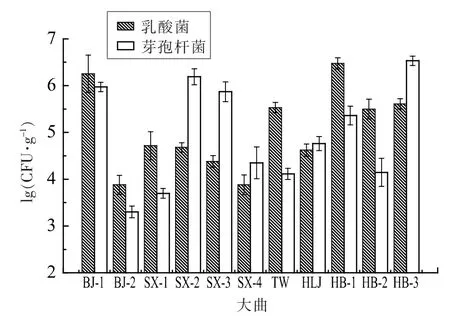
图3 清香型大曲可培养细菌分离图表Fig.3 Cultivable bacteria isolated from light-flavor Daqu

表2 清香型大曲ITS 区高通量测序分析结果Table 2 Composition of fungi in light-flavor Daqu samples based on high throughput ITS library sequence analysis
通过表3 数据可以看出, 这13 种真菌OTU可占大曲真菌OTU 总数的96.93%~99.64%,因而可以确认其为清香大曲的主要真菌类群。 13 种真菌OTU 中包括丝状真菌5 种, 分别为: 米曲霉(Aspergillus oryzae)、 谢瓦散囊菌(Eurotium chevalieri)、微小根毛霉(Rhizomucor pusillus)、嗜热子囊菌(Thermoascus aurantiacus)、伞枝横梗霉(Lichtheimia corymbifera);酵母菌8 种,分别为:扣囊覆膜酵母(Saccharomycopsis fibuligera)、库氏毕赤酵母(Pichia kudriavzevii)、热带念珠菌(Candida tropicalis)、白地霉(Geotrichum candidum)、菱形伊萨酵母(Issatchenkia scutulata)、异常威克酵母(Wickerhamomyces anomalus)= 异常汉逊酵母 (Hansenula anomala)、 阿萨希丝孢酵母(Trichosporon asahii)、酿酒酵母(Saccharomyces cerevisiae)。
整体来看, 虽然不同大曲真菌的组成比例各不相同,但是主体真菌均为扣囊覆膜酵母,其在不同大曲样品中所占比例在51.48%~98.32%之间。库氏毕赤酵母是OTU 总数第二的真菌,其在不同大曲样品中所占比例在0.37%~30.87%之间。排在其后的是5 种丝状真菌, 在所有大曲样品中均有出现,但数量较少,只在个别大曲数量较多。 而其余的7 种酵母菌在大曲中数量更少或无法检测到。
2.5 大曲细菌16S rDNA V3-V4 区高通量分析
11 种大曲样品V3-V4 区进行数据处理后,共获得305 种OTU,主要包括乳杆菌目(Lactobacillales)、芽孢杆菌目(Bacillales)、红螺菌目(Rhodospirillales)、肠杆菌目(Enterobacteriales)、假诺卡氏菌目(Pseudonocardiales)、链霉菌目(Streptomycetales), 挑选OTU 总数前15 的序列进行分析,结果如表3。

表3 清香型大曲细菌16S rDNA V3-V4 区高通量测序分析结果Table 3 Composition of bacteria in light-flavor Daqu samples based on 16S rDNA V3-V4 region library high throughput sequence analysis
通过表3 高通量数据可以看出,15 种细菌OTU 可占大曲细菌OTU 总数的68.8%~91.2%,因而初步确定其为清香大曲的主要细菌类群。 15 种细菌OTU 可分为五大类, 分别为乳酸菌10 种包括:融合魏斯氏菌(Weissella confuse)、植物乳杆菌(Lactobacillus plantarum)、耐酸乳杆菌(Lactobacillus acetotolerans)、柠檬明串珠菌(Leuconostoc citreum)、戊糖片球菌(Pediococcus pentosaceus)、短乳杆菌 (Lactobacillus brevis)、 黑龙江乳杆菌(Lactobacillus heilongjiangensis)、 弯曲乳杆菌(Lactobacillus curvatus)、 旧金山乳杆菌(Lactobacillus sanfranciscensis)、桥乳杆菌(Lactobacillus pontis);芽孢杆菌1 种为:地衣芽孢杆菌(Bacillus licheniformis);泛菌属1 种为:成团泛菌(Pantoea vagans);葡萄球菌1 种为:鸡葡萄球菌(Staphylococcus gallinarum); 放线菌2 种为: 白色链霉菌(Streptomyces albus)、 克罗彭斯特菌属(Kroppenstedtia eburnea)。
整体来看,清香型大曲细菌组成较为多样化,不具备明显优势种, 但通过高通量数据可以看出在大曲细菌多样性组成中乳酸菌类在种类和数量上均处于优势地位。 其中数量较多的乳酸菌主要为魏斯氏菌(W. confuse)、戊糖片球菌(P. pentosaceus)、柠檬明串珠菌(L. citreum)、耐酸乳杆菌(L. acetotolerans)。
成团泛菌、地衣芽孢杆菌、鸡葡萄球菌、白色链霉菌、 克罗彭斯特菌属这5 种细菌在大曲样品中均有出现,并且在某些样品中占有较高的比例,但整体从数量和种类分析, 这几类细菌均无法同乳酸菌类相比。
3 讨论
大曲作为酿酒的糖化发酵剂, 一直以来备受企业重视,多年来,人们不断地研究制曲,改良制曲工艺,使制曲工艺逐步走向规范化。但由于制曲过程属于生料制曲、自然接种[11]。 即原料没有经过灭菌, 而且菌种还可来自制曲环境中的空气和工具,涉及的微生物种类和数量都极为复杂,造成了微生物的多样性, 至今尚未完全研究透彻曲中各种微生物及酶在酿酒发酵过程中的作用机理。
本研究利用传统分离方法结合rDNA 高通量测序技术对北京、山西、台湾、黑龙江、河北5 地的11 份清香大曲微生物进行系统研究。 研究结果表明:传统分离结果中11 份大曲样品中微生物数量各不相同,真菌总数远大于细菌总数。在真菌组成中, 扣囊覆膜酵母是11 份大曲样品的主要真菌,其数量远高于丝状真菌和其他酵母菌, 不同大曲之间丝状真菌和酵母菌数量比例关系各不相同,总体来看酵母菌数量要小于丝状真菌。 在细菌组成中,大曲的优势细菌存在差异,乳酸菌和芽孢杆菌分别构成了不同大曲的优势细菌类群。
rDNA 高通量测序数据分析表明,在真菌多样性中, 大曲中真菌类群主要由扣囊覆膜酵母和库氏毕赤酵母2 种酵母组成, 其中扣囊覆膜酵母是大曲中优势真菌类群,其可占大曲样品的51.48%~98.32%,这与传统分离结果较为一致。 而丝状真菌整体数量较少, 只在某1 种或2 种大曲中占有一定的比例。在细菌多样性中,大曲中细菌类群主要由乳酸菌、芽孢杆菌、泛菌属、放线菌这4 大类组成。乳酸菌在种类和数量上处于优势地位,主要种类为融合魏斯氏菌、 戊糖片球菌、 柠檬明串珠菌、耐酸乳杆菌。
本研究利用传统微生物分离技术确定了大曲中微生物数量关系, 通过高通量测序获得了不同大曲的微生物多样性组成, 将两种分析手段相结合,明确了清香大曲真菌和细菌的数量关系、微生物多样性及优势种群分布。 虽然两种分析方法在整体结果上较为一致, 但在某些方面存在一定差异, 如两种方法中酵母菌和丝状真菌比例关系差异较大, 这是否由于常规培养条件下该菌较难分离或丝状真菌孢子较多、菌丝茂盛,影响分离效果所造成, 或是由于在大曲制作过程中某一节点该菌大量生长后死亡,残留的大量DNA 未降解从而影响了高通量数据造成, 这还需进一步验证。 同时,在今后大曲微生物研究中,可对传统分离微生物进行分子鉴定后再与高通量数据进行对比,这样可使研究结果更加准确。
