黄酒饮后不同物质的代谢差异
2019-07-30金建顺傅祖康唐雅凤
彭 林,金建顺,傅祖康,唐雅凤,毛 健
(1.江南大学粮食发酵工程与技术国家工程实验室,江苏无锡214122;2.会稽山绍兴酒股份有限公司,浙江绍兴312000)
黄酒是我国传统酿造酒之一,具有口感醇厚、香气浓郁、营养丰富的特点,由于其悠久的历史文化积淀,已成为我国消费酒类的重要组成部分。黄酒的酿造是以谷物为原料,利用发酵原料和环境中的微生物资源进行的半固态双边发酵,发酵过程中酵母产酒和多种产酶微生物进行的淀粉糖化共同进行,从而赋予黄酒独特的风味和营养价值。近年来,随着国内消费水平的不断提高,市场销售的酒类逐年递增,消费者饮用酒类的选择也逐渐丰富。随着消费人群健康意识的增强,消费者选择消费酒类时除考虑品牌因素外,饮用过程中和饮用后的舒适度成为衡量和评价酒类的重要标准之一。在国内主要的消费酒类中,黄酒在近年来的销售额虽然有所提高,但所占市场份额却逐年降低,其中一个重要的因素就是黄酒饮用后的上头问题。所谓上头,是指饮酒后出现头部神经痛,或面红耳赤、头晕心跳、恶心呕吐等现象。由于黄酒酿造微生物和生产工艺的复杂性,目前黄酒的生产过程主要依赖于操作工人的丰富经验,而缺少导致黄酒上头问题的物质基础和相关机理的科学认识,也为从工艺调控角度控制黄酒上头形成了障碍。这些问题的存在直接影响了黄酒产业提高市场份额和进一步发展。
在黄酒的酿造工艺中,经酵母和多种微生物发酵后的半固态原料经压榨、过滤、煎酒最终得到黄酒。黄酒的酿造特点一方面使较多原料来源和微生物发酵来源的营养和功能物质保留在黄酒中,赋予了黄酒营养功能丰富的优点,但另一方面也使较多的上头物质保留于酒中。倪莉[1]在总结黄酒饮后上头的原因时认为,导致黄酒饮后上头的物质主要包括几大类:酒精、杂醇油(高级醇)、醛类物质和酸酯不平衡。此外,黄酒中存在的生物胺类物质具有一定的生理副作用,其中部分不适症状如偏头疼,与饮后上头也有直接的联系。生物胺中组胺与饮酒上头密切相关的是引发的头痛,组胺摄入引起的头痛症状属于血管收缩性头痛,主要是由于摄入组胺刺激内皮细胞过量释放信号分子NO,导致颅内动脉的血管收缩,最终造成头痛[2-3]。酪胺的摄入会引起血管收缩,从而导致饮食诱导的偏头痛、呕吐、呼吸困难并提高血压血糖[4-5],其中酪胺导致的血压增高会进一步诱发心力衰竭和脑出血[6]。相比其他生物胺,尸胺和腐胺具有较低的毒副作用[7],但其存在主要通过抑制组胺和酪胺的代谢酶,如抑制单氨基氧化酶MAO和二胺氧化酶DAO的活性,从而增强组胺和酪胺的毒副作用[8-9]。醛类物质中,由于乙醛的强致癌性使其被美国环境保护署(U.S.EPA)列为B2级致癌物[10]。同时,饮酒后人体会将乙醇代谢为乙醛,并且酒中会有不同含量的乙醛随酒一同进入人体,人体内升高的乙醛含量会导致多种不良症状,包括降低血压、心跳和呼吸急促、口和喉部干渴、头疼等[11],同时在人体内乙醛含量的提高与宿醉后的头疼、呕吐反应有直接联系,这些症状可能与乙醛浓度的提高导致提高了组胺的释放[12]有关,从而加强了组胺摄入的相关不良症状及过敏反应。
目前,针对黄酒饮后上头问题的认识,参考借鉴白酒和啤酒的相关研究和成果,已经在可能导致上头的物质方面具有了一定的认知。但是,黄酒发酵技术和工艺的特点与白酒和啤酒差异较大,不具备直接借鉴的实际价值,同时其他酒类的相关调控策略和技术也无法直接应用于黄酒。因此,本文基于之前工作中对黄酒中不同物质含量范围检测后,通过在SD大鼠模型中考察生物胺、高级醇和醛类物质代谢情况,了解黄酒所含物质中的代谢速度情况,通过比较代谢动力学参数确定黄酒中代谢较慢的物质,为进一步明确影响黄酒舒适度及其作用机制奠定基础。
1 材料与方法
1.1 材料、试剂
实验用鼠:药物代谢动力学研究选择成年健康的SD大鼠,雌雄各半,体重为200 g左右,年龄6~8周,实验动物购自上海斯莱克实验动物有限责任公司,实验动物质量合格证号SCXK(沪)2007-0005。
试剂:药代动力学研究中所用组胺、酪胺、尸胺、腐胺、苯乙醇、正丙醇、异丁醇、异戊醇、乙醛和5-羟甲基糠醛(5-HMF)和乙醇均为色谱级试剂,购自Sigma公司。
1.2 实验方法
1.2.1 实验设计
本实验中的给药量按成人体重60 kg饮用2瓶黄酒,根据黄酒中各物质浓度,计算成人每kg体重摄入物质的含量,计算后各物质的给药量见表1。所有研究物质均用15%vol乙醇溶液溶解配制。除所有10种物质单独给药外,本项目为模拟黄酒中各物质的代谢速度和对乙醇代谢的影响,设置混合组进行给药,即将4种生物胺、4种高级醇和2种醛类物质同时溶解于15%vol溶液中,采用单次口服灌胃的给药方法进行给药。
1.2.2 SD大鼠单次口服灌胃给药、取血和血样处理
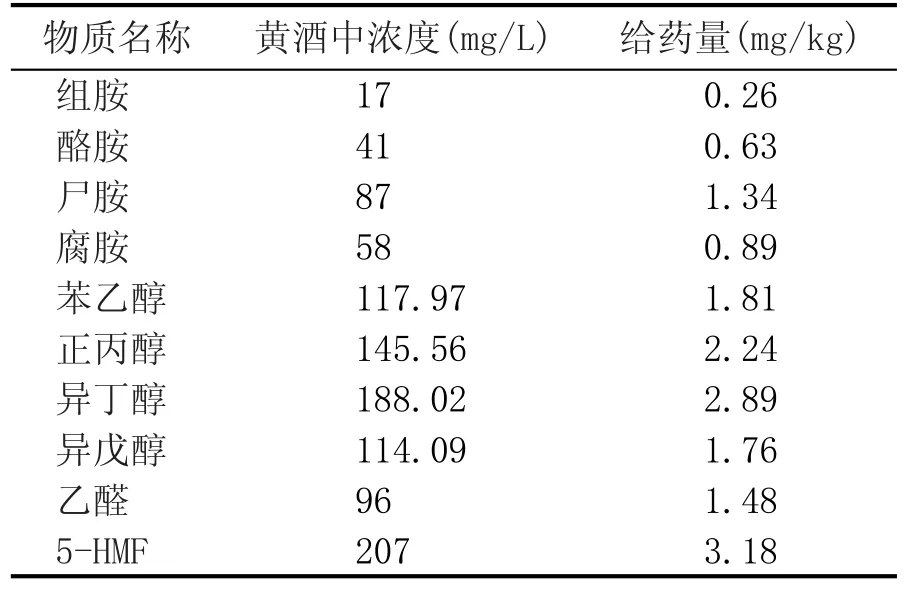
表1 SD大鼠模型中生物胺、高级醇和醛类物质的给药量
根据给药物质不同,分别将SD大鼠分为空白组、乙醇组和加药组,其中加药组为分别含有10种药物的15%vol乙醇溶液,配制浓度见表1。将7 d适应性培养的SD大鼠随机分组,每组5只大鼠,对所有大鼠进行颈动脉插管手术,以便于同一只大鼠连续取血。将配制试剂按大鼠体重10 mL/kg口服灌胃给药,给药前SD大鼠禁食12 h。
大鼠取血时间为给药前0 h和给药后2 h、4 h、6 h、12 h、24 h,每只大鼠连续取血样200 μL,分别进行标号后于4℃、3000 r/min离心10 min,置于-20℃冰箱中保存血清样品待测。
1.2.3 HPLC法检测血清中生物胺的含量
样品衍生化:血清中的生物胺首先利用丹磺酰氯进行衍生化,条件为:0.1 mL血清分别加入1 mL饱和碳酸氢钠、100 μL氢氧化钠和1 mL的10 mg/mL丹磺酰氯溶液,漩涡振荡混匀1 min后60℃衍生15 min,加入100 μL谷氨酸钠以60℃反应15 min,加入1 mL水涡旋1 min、40℃水浴除去丙酮,加入0.5 g氯化钠和5 mL乙醚,取有机相在40℃氮气吹干。加入1 mL乙腈,过0.45 μm有机滤膜,用于液相检测。
色谱条件:HPLC为安捷伦1100高效液相色谱,所用色谱柱为C18反向色谱柱。样品检测中,上样量为10 μL,流动相A:90%乙腈(含0.1%乙酸的0.01 mol/L乙酸铵);流动相B:10%乙腈(含0.1%乙酸的0.01 mol/L乙酸铵),流速1.0 mL/min,检测柱温度35℃,检测波长254 nm。样品中组胺、酪胺、尸胺、腐胺含量利用标品峰面积绘制的标准曲线进行计算。
1.2.4 HPLC法检测血清中高级醇含量
样品处理:取血清样品50 μL,置于1.5 mL离心管中,加50 μL内标 0.1 mg/mL甘油,5 μL衍生化试剂对甲苯磺酰异氰酸酯TSIC 2 g/mL,室温下衍生化2 min。加5 μL水,加140 μL乙腈,离心取上清液,过0.45 μm有机滤膜,用于液相检测。
色谱条件:HPLC为安捷伦1100高效液相色谱,所用色谱柱为C18反向色谱柱。样品检测中,上样量为10 μL,流动相:35%乙腈+65%磷酸盐缓冲液(0.01 mol/L磷酸二氢钾,磷酸调pH值到2.5),流速1.0 mL/min,检测柱温度25℃,检测波长为227 nm。样品中苯乙醇、正丙醇、异丁醇、异戊醇和乙醇含量利用标品峰面积绘制的标准曲线进行计算。
1.2.5 HPLC法检测血清中醛类物质的含量
样品处理:(1)乙醛:取样50 μL,置于1.5 mL离心管中,补加缓冲液至250 μL,再用2,4-二硝基苯肼定容到0.5 mL,盖紧盖子混匀,60℃水浴加热1 h,冷却至室温取出。提取液以4600 r/min离心10 min取上清液,过0.45 μm有机滤膜,用于液相检测;(2)5-HMF:50 μL样品加50 μL草酸溶液混合均匀,沸水浴中加热25 min,冷却至室温。将试管中溶液转移至1.5 mL试管瓶中,用0.1 mL甲醇分3次洗涤。加入0.03 mL亚铁氰化钾溶液(92 g/L)和0.3 mL乙酸锌(183 g/L)溶液,摇匀后静置15 min,加甲醇补足0.5 mL。过0.45 μm滤膜上样测定。
色谱条件:HPLC为安捷伦1100高效液相色谱,所用色谱柱为C18反向色谱柱。样品检测中,上样量为10 μL,流动相:90%水+10%甲醇,流速1.0 mL/min,其中乙醛检测柱温度40℃、检测波长360 nm,5-HMF检测柱温度25℃、检测波长280 nm。样品中乙醛和5-HMF含量利用标品峰面积绘制的标准曲线进行计算。
1.2.6 数据处理
药代动力学中的血药浓度-时间曲线,结果表现为每组5个平行样品的平均值±方差,利用GraphPrism 7.0绘制。药代动力学参数的计算利用DAS 2.0软件进行数据处理。
2 结果与分析
为研究生物胺、高级醇和醛类物质在SD大鼠体内的吸收、分布和消除特性,找出黄酒中代谢速度较慢的物质,从而确定影响黄酒饮后舒适度的可能物质,本项目在SD大鼠模型中通过单次口服给药的方式,将组胺、酪胺、尸胺、腐胺、苯乙醇、正丙醇、异丁醇、异戊醇、乙醛和5-羟甲基糠醛(5-HMF)分别给药后,检测给药后SD大鼠血液中各物质浓度的变化,并通过分析处理得到药代动力学参数,通过参数的比较分析各物质间的代谢差异。药物进入体内后,主要经过吸收、分布和消除3个过程。在口服给药模式下,药物首先经过胃后由小肠吸收,经血液转运入肝脏并进行初步代谢后进入全身血液。血液将转运的药物运至全身各组织器官中,相应药物在特定组织器官中结合并开始消除过程,最终使血液中药物浓度逐渐降低并最终清除。
2.1 SD大鼠口服生物胺的药代动力学参数
为模拟黄酒中多种物质同时摄入后对单一物质的药代动力学参数的影响,本研究在试验中设立混合组作为黄酒模拟组,考察同时摄入10种物质后对物质代谢的影响。数据经处理后,计算得出的药代动力学参数列于表2。结果表明,与单一生物胺口服给药相比,混合组中多种物质对物质的吸收造成较为明显的影响。在混合组中,4种生物胺中组胺、酪胺和尸胺的达峰时间Tmax和峰浓度Cmax相比单一生物胺给药都有明显的延后,表明组胺、酪胺和尸胺与组织器官的结合能力变强而导致吸收速度减慢。在物质消除过程中,通过比较半衰期t1/2和清除速率CL可以发现,消除速度最快的为腐胺,其次为酪胺和尸胺,消除最慢的生物胺为组胺。此外,通过与混合组结果比较发现,多种物质共同摄入时会加快组胺的消除速率,并减慢尸胺的消除速度。
2.2 SD大鼠口服高级醇的药代动力学参数
将苯乙醇、正丙醇、异丁醇、异戊醇单次口服给药SD大鼠后,血液药物浓度-时间曲线数据经软件分析后计算得出4种高级醇在SD大鼠体内的药代动力学参数,结果见表3。结果显示,与单一药物给药相比,混合组给药后苯乙醇、正丙醇和异戊醇的消除半衰期t1/2明显提高,同时清除率CL明显降低,这些结果表明,多种物质共同摄入减慢了苯乙醇、正丙醇和异戊醇的消除速率。与此相比,异丁醇的消除速度并没有明显的变化。此外,在4种高级醇中,苯乙醇的消除速率最慢,其清除半衰期t1/2为4.142 h,其次为异丁醇和异戊醇,消除速度最快的高级醇是正丙醇。
2.3 SD大鼠口服乙醛和5-HMF的药代动力学参数
SD大鼠口服给药乙醛和5-HMF后计算得出的药代动力学参数见表4。结果显示,与单一给药相比,混合组多种物质共同摄入后直接影响了乙醛和5-HMF的吸收。药物峰浓度在混合组中明显降低,其中乙醛由0.424 mg/L降低至0.076 mg/L,而5-HMF由0.079 mg/L降低至0.035 mg/L,同时进入血液的药物相对数量指标AUC也都有明显的降低。此结果表明,混合组给药后使乙醛和5-HMF与体内组织器官的结合作用增强,从而导致吸收进入血液的药物含量明显降低。但增强的组织器官结合能力提高了乙醛和5-HMF的消除速率,药代参数中清除半衰期t1/2和清除率CL的降低表明,混合组给药提高了乙醛和5-HMF的消除速率。
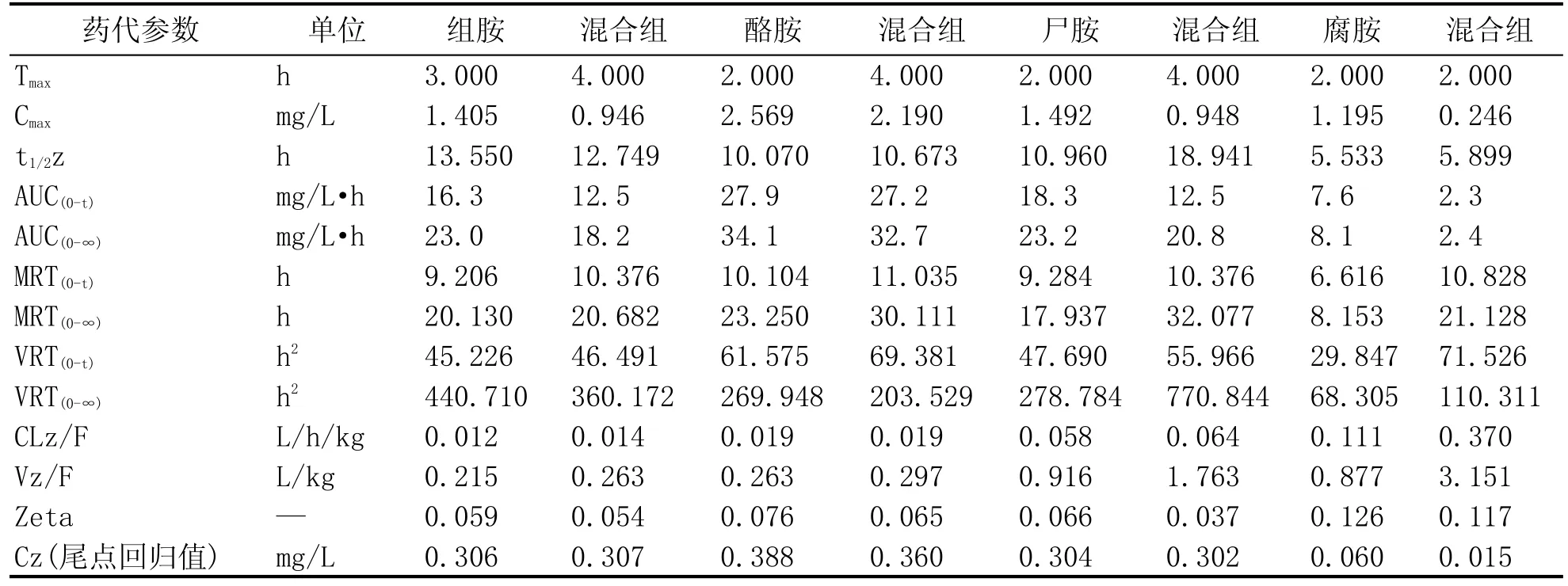
表2 SD大鼠单次口服组胺、酪胺、尸胺、腐胺和混合组的各物质药代参数(n=5)
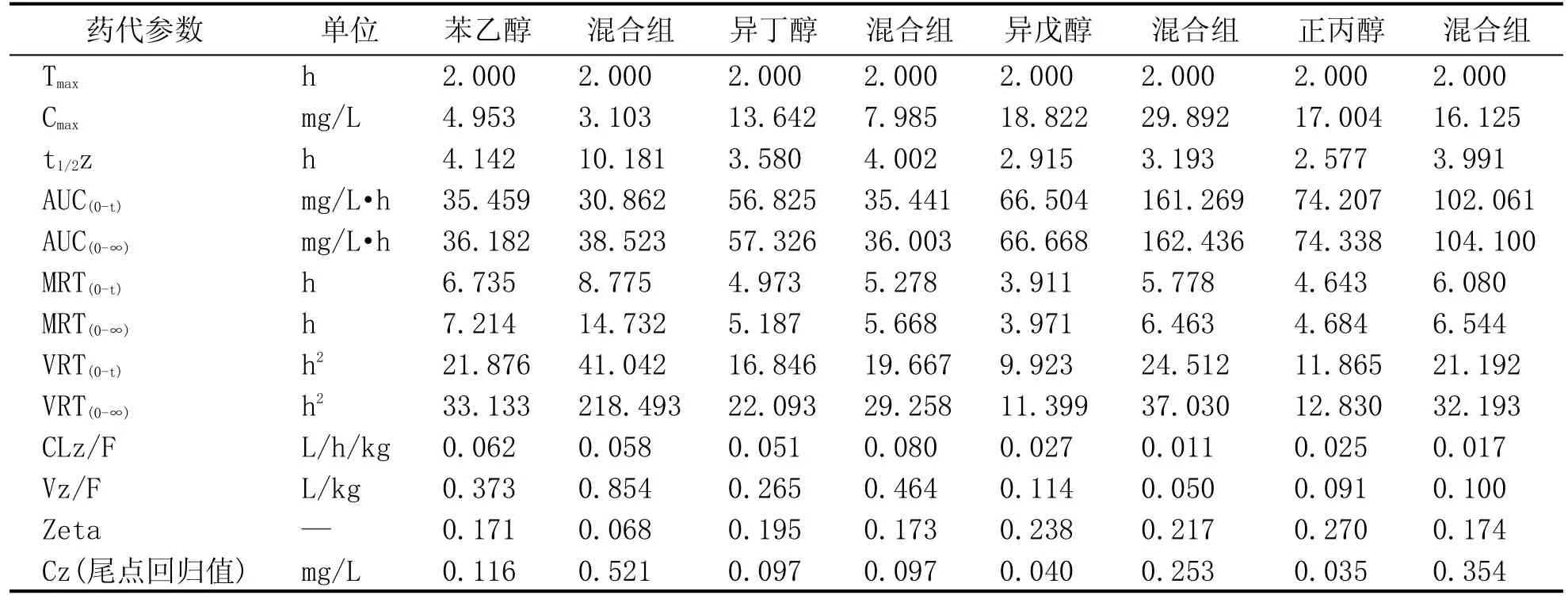
表3 SD大鼠单次口服苯乙醇、正丙醇、异丁醇、异戊醇和混合组的各物质药代参数(n=5)
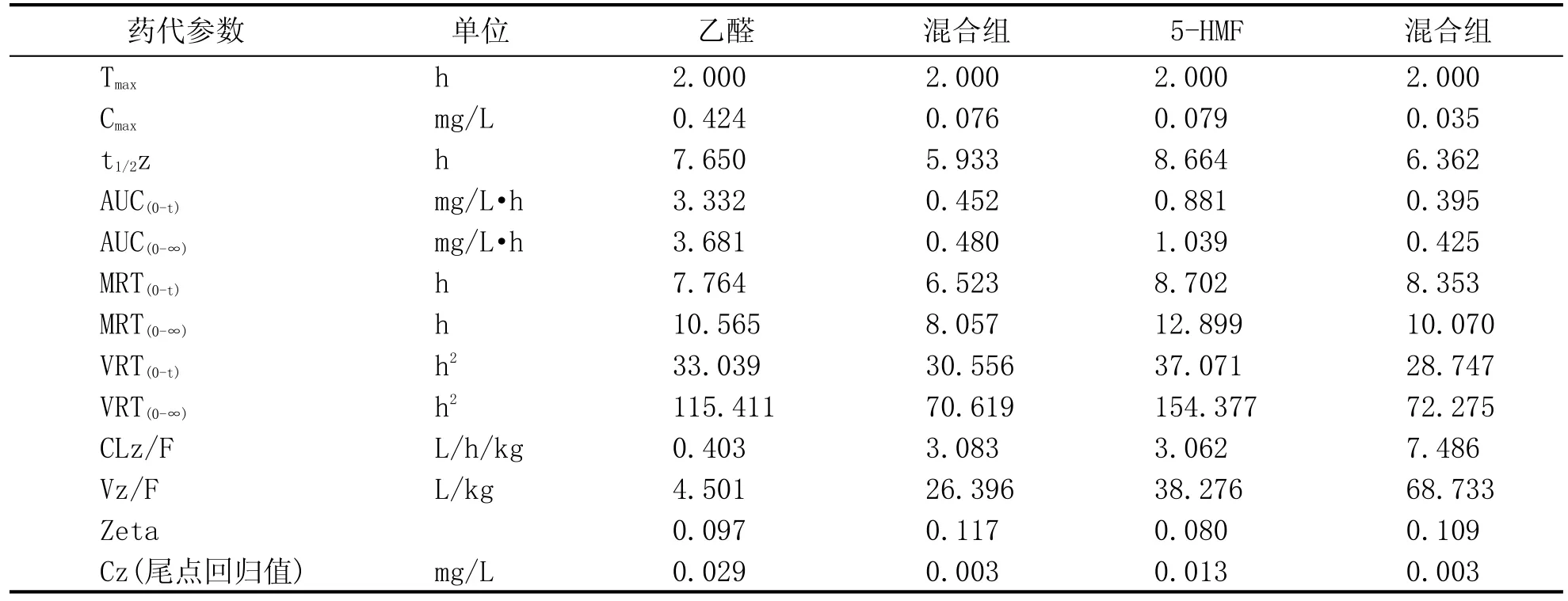
表4 SD大鼠单次口服乙醛、5-HMF和混合组的各物质药代参数(n=5)
2.4 三大类物质间的清除速度比较
本试验在考察了生物胺、高级醇和醛类物质在单一口服给药和混合给药两种方式后,得出了生物胺、高级醇和醛类自身物质间的消除速度差异。在此结果上,本试验总结了4种生物胺、4种高级醇和2种醛类的药代动力学参数(表5),将10种物质进行横向比较,以得出10种物质间的消除速度差异。10种考察的物质中,通过综合比较不同物质间的给药量(表1)、清除半衰期t1/2和清除速率CL,以消除速度快慢计,10种物质的消除速度顺序为:正丙醇>异戊醇>异丁醇>苯乙醇>腐胺>乙醛>5-HMF>酪胺>尸胺>组胺。在此顺序中,生物胺中的组胺和酪胺代谢速度最慢,高级醇中的正丙醇和异戊醇代谢速度较慢,乙醛和5-HMF代谢速度较快。
3 结论
作为中国传统酿造酒的代表,黄酒未经蒸馏的发酵工艺决定了其中含有远高于白酒等蒸馏酒的丰富物质,这些物质除作为营养物质和功能物质为黄酒添加了健康保健属性外,也可能对黄酒饮后舒适度问题带来困扰。在本团队之前的研究中发现,生物胺、高级醇和醛类物质的存在减缓了乙醇在SD大鼠体内的代谢速度,通过影响大鼠代谢乙醇的方式带来黄酒饮后舒适度问题。在本文的研究中,比较了10种生物胺、高级醇和醛类物质在SD大鼠体内的代谢差异,发现各物质在SD大鼠体内的代谢具有一定的差异,消除速度由慢到快的顺序为:10物质的消除速度顺序为异戊醇>正丙醇>异丁醇>腐胺>乙醛>5-HMF>苯乙醇>酪胺>组胺>尸胺。饮用黄酒后,消除速度较慢的物质可能更长时间保留于人体内,更持久的减缓乙醇的代谢。同时,考察的10种物质中,部分物质自身具有一定的副作用,对造成上头现象中的头疼、呕吐、头晕、口渴等症状具有直接联系。因此,通过本文的研究,初步得出影响黄酒饮后上头作用相关机制的物质基础,为进一步分析上头在人体内所涉及的生理机制奠定了物质基础,也为制备高舒适度黄酒的酿造工艺调控策略提供了理论依据。
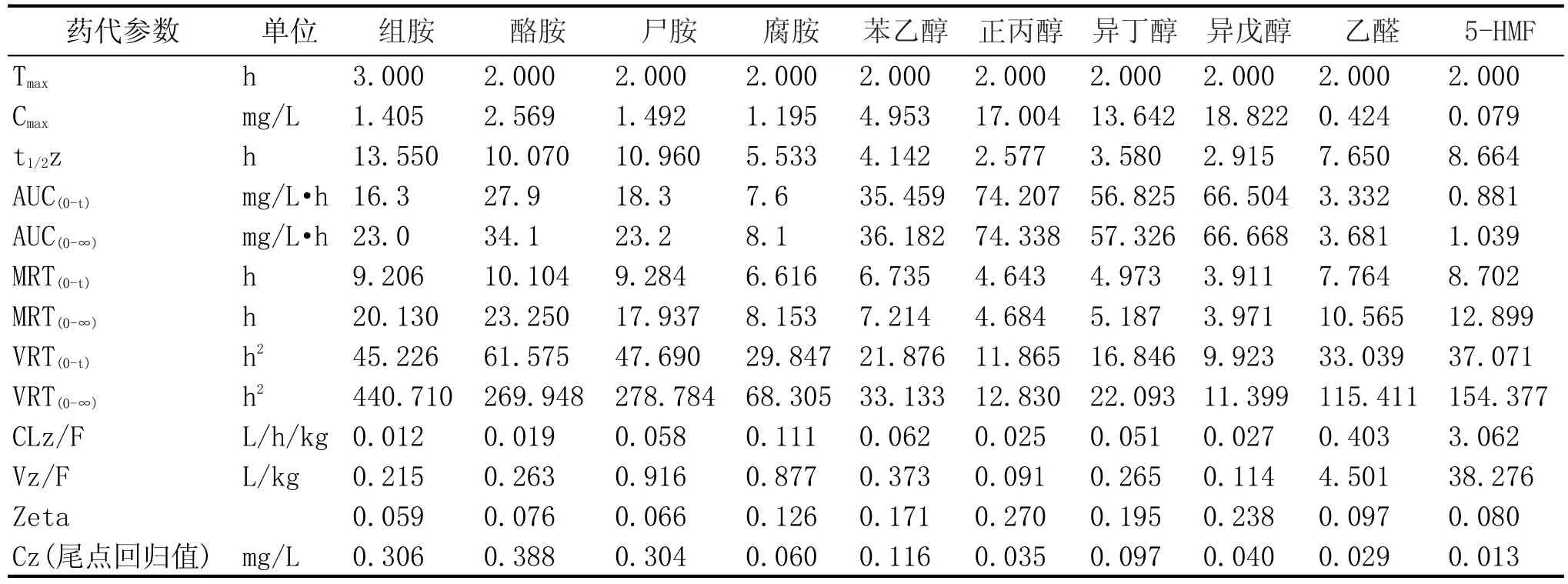
表5 单一摄入药物中生物胺、高级醇和醛类物质间代谢参数的比较
