老年非酒精性脂肪性肝病痰湿质患者与瘦素受体和脂联素基因多态性的关联研究*
2019-07-28王睿瑞王健英刘保成
王 侨 王睿瑞 李 东 王健英 张 磊 贺 光 季 光,4 刘保成△
1.上海中医药大学中医健康服务协同创新中心 (上海, 201203) 2.上海市浦东新区张江社区卫生服务中心 3.上海交通大学Bio-X研究院 4.上海中医药大学附属龙华医院脾胃病研究所
非酒精性脂肪性肝病(NAFLD)是一种常见的慢性肝脏疾病,以体内大量脂肪堆积导致肝脏体积增加5%~10%并且无过量饮酒史 (男性≤30 g/d;女性≤20 g/d)的一种病理状态[1, 2]。NAFLD的疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)、肝硬化、肝癌等[3]。中医体质学说认为,体质是人体在先天遗传的基础上加上后天所得表现出的生理功能、心理健康和外部结构各方面综合的、比较稳定的一种特质。在某些特殊情况下,体质决定着疾病的易感性[4]。在个人禀赋和外界环境的影响下, 不同个体有不同的症状表现, 而相对稳定的体质便会成为研究某些疾病异质性以及有效指导临床的线索[5]。NAFLD 是受遗传-环境-代谢应激相关因素影响的复杂疾病,其中与遗传易感性关系密切。既往研究发现瘦素与单纯性脂肪肝有关,其与瘦素受体(LEPR)结合, 在瘦素生物学作用的发挥中起重要作用[6]。脂联素(ADIPOQ)是脂肪细胞分泌的活性蛋白之一,与糖、脂肪等代谢有着密切的关系,参与了肾脏疾病、肝脏疾病、胰岛素抵抗等多种疾病发生、发展的机制[7,8]。既往研究发现NAFLD患者以痰湿质居多[9,10],因此,本研究将对NAFLD痰湿质患者与LEPR基因以及ADIPOQ基因多态性进行关联研究分析。
1 资料与方法
1.1 研究对象 纳入人群为2018年4月至7月参与上海市浦东新区张江社区卫生服务中心常规体检的常住居民。最终纳入NAFLD患者461例,其中痰湿质组207例(男∶女=118∶89),非痰湿质组254例(男∶女=101∶153)。每位参与者均测量了基础指标(身高、体重、腰围、臀围和血压等)以及生化指标(血常规、肝功能、肾功能、空腹血糖和血脂等)。本研究遵从上海中医药大学医药伦理委员会条例,每位参与者均签订知情同意书。
1.2 NAFLD诊断标准 NAFLD 的诊断标准采用中华医学会肝病学分会脂肪肝和酒精性肝病学组以及中国医师协会脂肪性肝病专家委员会共同制订的《非酒精性脂肪性肝病防治指南(2018 年更新版)》中的临床诊断标准[11]。患者均由两名具有中级以上职称的操作熟练的超声科医师采用彩色多普勒超声进行诊断。
1.3 纳入及排除标准 纳入标准:①参与体检、中医问卷填写以及进行基因分型者;②B超诊断为NAFLD者;③同意参加本研究并签署知情同意书者;④年龄>65岁者。排除标准:①未参与体质问卷填写者;②年龄<65岁者;③生化指标和体质问卷信息不完整及明显有误者;④未进行基因多态性分型者;⑤患有严重心脑肺肾疾病、恶性肿瘤以及拒绝填写知情同意书者。
1.4 中医体质诊断 体质诊断采用中华中医药学会颁布的体质分类法[12]。量表分为9个部分,由平和质和8种偏颇体质(阴虚质、阳虚质、气虚质、痰湿质、湿热质、血瘀质、气郁质和特禀质)9个自评亚量表组成,共33道问题。每位调查员在问卷填写之前经过统一化、规范化的填写标准培训并通过考核,调查时尽量做到术语表述一致,填写时采取面对面的方式。为保证问卷信息的准确性,采用双人双录入的方式。在每个体质得分的基础上利用判别分析法判定每种体质[13]。
1.5 基因检测方法 选用LEPR rs1805094、 rs11208659、 rs4655537、 rs12409877和ADIPOQ rs182052、 rs3774261、 rs6773957、 rs17366568这8个位点进行基因多态性分析。所有研究对象抽血前空腹10 h,于次日上午采外周静脉血样。采用苯酚-氯仿法进行基因组DNA提取;采用Sequenom 平台的MassARRAY®分子量阵列技术对ADIPOQ和LEPR进行基因多态性分型,分型检测均在上海交通大学Bio-X研究院的实验平台完成。基因多态性分型质量控制采用随机抽取10%的DNA质量较高的样本进行了重复分析。
1.6 统计学方法 采用 SPSS 25.0、SHEsis软件和R语言进行数据分析。计量资料用均数±标准差表示;计数资料采用频数(百分比)表示。计量资料两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA)。采用SHEsis软件进行等位基因、基因型以及哈迪-温伯格平衡(HWE)检验。采用 logistic 回归模型,多因素时校正年龄、性别、肝酶(谷丙转氨酶和谷草转氨酶)以及血脂(高密度脂蛋白、低密度脂蛋白、总胆固醇和甘油三酯)。分类变量具体赋值如下。因变量∶痰湿质=1,非痰湿质=0。自变量:LEPR rs11208659:CC=1,TC=2,TT=3;ADIPOQ rs182052: AA=1, AG=2, GG=3; 性别:男性=1,女性=2。连续性变量(高密度脂蛋白、低密度脂蛋白、总胆固醇、甘油三酯、谷丙转氨酶、谷草转氨酶以及年龄)直接放入模型进行分析。按检验水准α=0.05,P<0.05表示差异具有统计学意义。
2 结果
2.1 痰湿质组患者与非痰湿质组患者人口学特征和实验室指标信息 见表1。性别和年龄在痰湿质患者和非痰湿质患者中具有显著性差异,痰湿质患者年龄比非痰湿质患者平均高1岁;男性患者中痰湿质人数较非痰湿质人数多,而在女性患者中非痰湿质人数远远高于痰湿质人数。与非痰湿质患者相比,痰湿质患者BMI、腰围、收缩压、舒张压均高于非痰湿质患者,高密度脂蛋白低于非痰湿质患者(P<0.05)。谷草转氨酶、谷丙转氨酶、低密度脂蛋白、总胆固醇和甘油三酯在两组中均未见统计学差异。
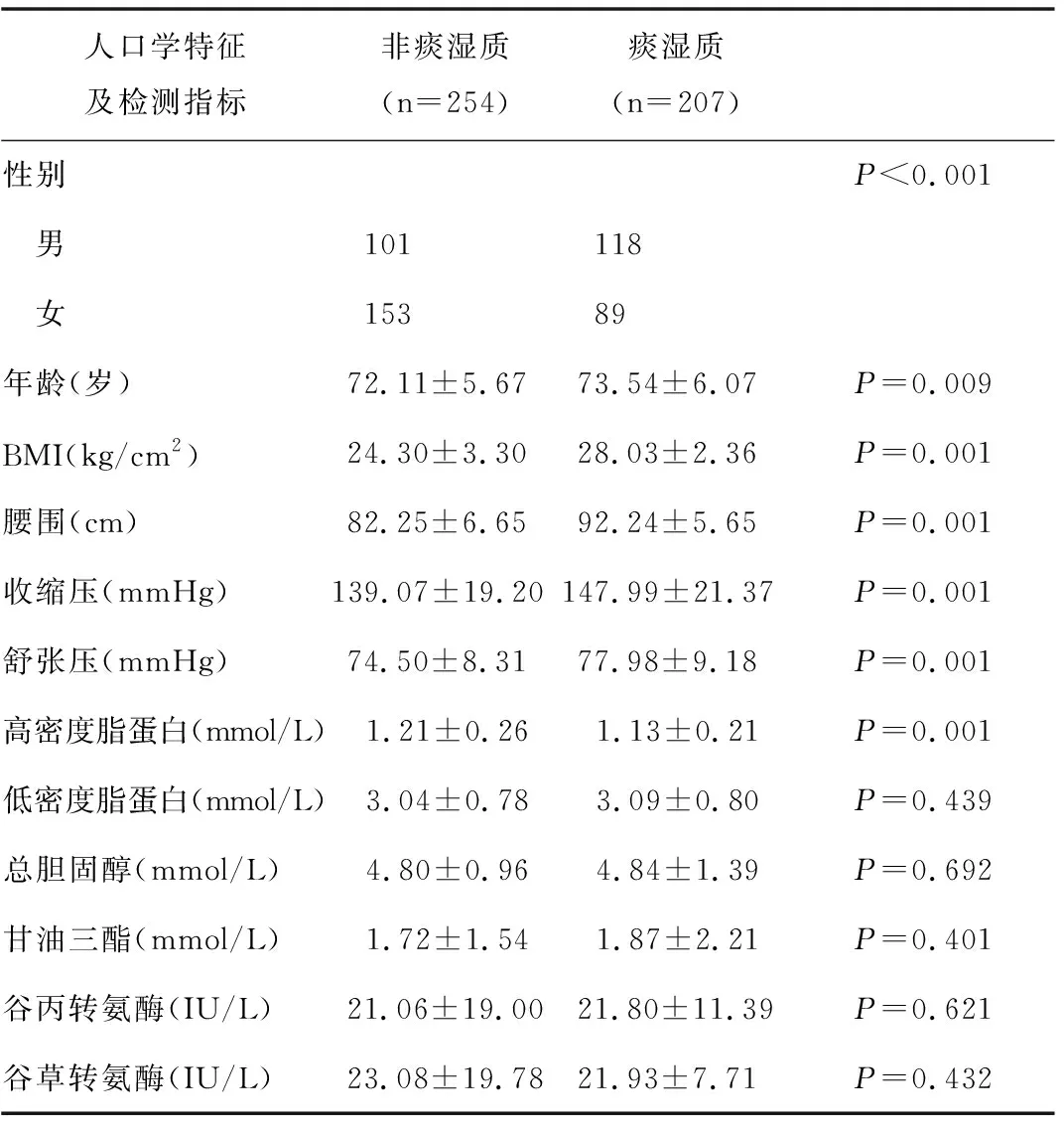
表1 人口学特征和实验室指标在两组患者中的比较
2.2 ADIPOQ、LEPR等位基因和基因型频率与痰湿质患者的相关性 见表2。LEPR rs1805094、rs11208659、rs4655537、rs12409877 和 ADIPOQ rs182052、rs3774261、rs6773957、rs17366568这8个位点在两组患者中经吻合度检验,均符合哈迪-温伯格法则,表明数据来自同一遗传群体。经统计学分析,发现只有ADIPOQ rs182052和LEPR rs11208659 这两个位点在两组患者中存在显著性差异。ADIPOQ rs182052和LEPR rs11208659位点等位基因频率在两组中均有差异,ADIPOQ rs182052 G等位基因在痰湿质患者中频率高于非痰湿质患者,痰湿质患者LEPR rs11208659 T等位基因频率显著高于非痰湿质组。在基因型分析中,ADIPOQ rs182052和LEPR rs11208659位点在两组患者中均有差异。ADIPOQ rs182052 位点GG基因型在痰湿质患者中的频率分布高于非痰湿质患者,痰湿质患者的LEPR rs11208659位点TT基因型远远高于TC 基因型和CC基因型。
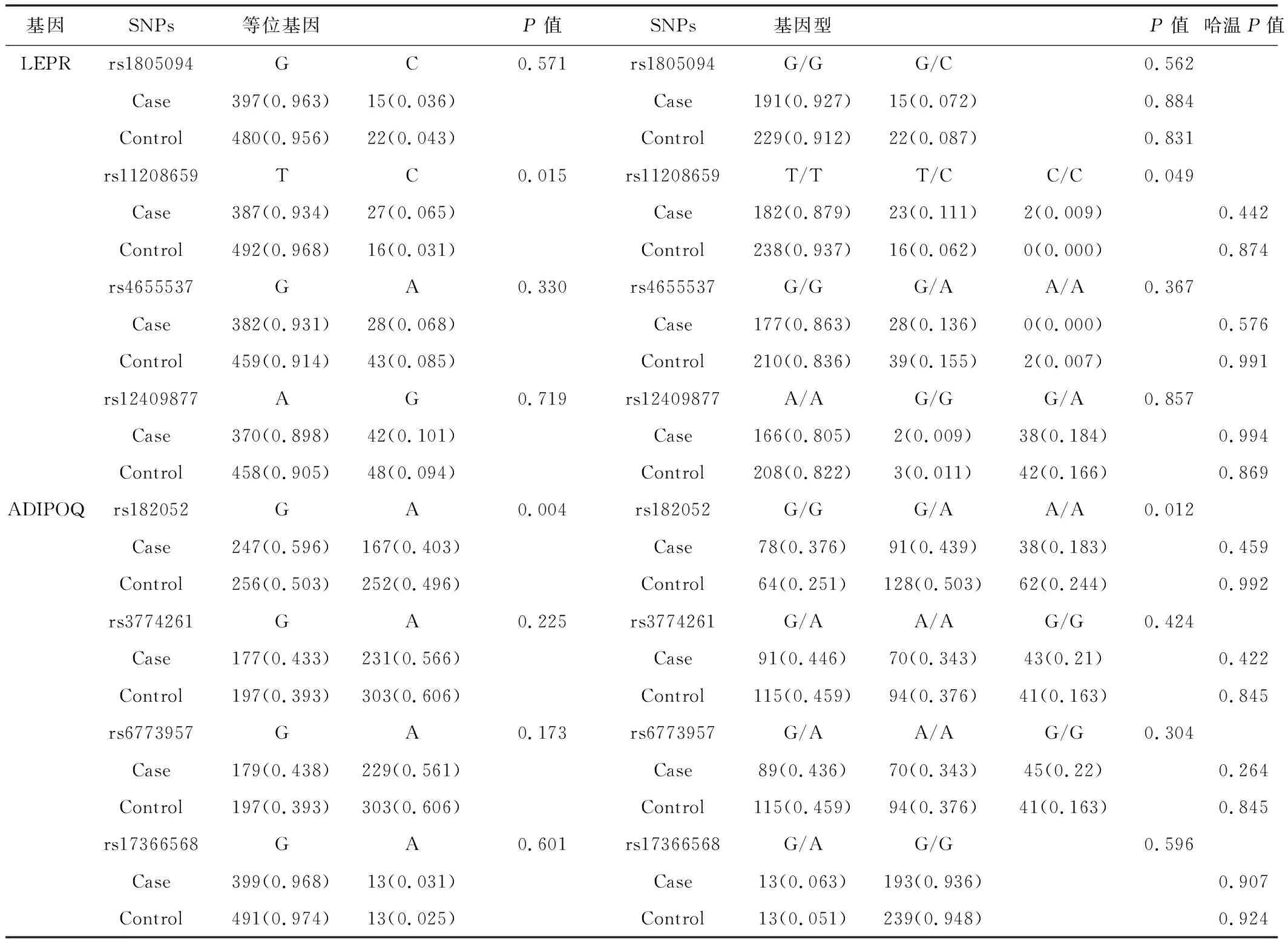
表2 ADIPOQ、LEPR等位基因和基因型频率分析
2.3 NAFLD痰湿质患者Logistics回归模型分析 见表3。单因素逻辑回归分析发现ADIPOQ rs182052基因为痰湿质患者的危险因素。ADIPOQ rs182052 突变型GG基因携带者痰湿质发生的风险是非痰湿质发生风险的2倍[OR=2.104(1.24~3.578)]。进一步校正性别、年龄、肝酶以及血脂后,ADIPOQ rs182052 突变型GG基因携带者痰湿质发生的风险仍是非痰湿质发生风险的2倍[OR=2.274(1.303~3.967)]。表明ADIPOQ rs182052 野生型AA基因型是NAFLD痰湿质患者的保护基因。

表3 NAFLD痰湿质患者logistics回归模型分析
2.4 痰湿质患者ADIPOQ rs182052和LEPR rs11208659的遗传模型分析 见表4。

表4 ADIPOQ rs182052和LEPR rs11208659遗传模型在两组患者中的比较 [n(%)]
在5种遗传模型中,ADIPOQ rs182052和LEPR rs11208659位点在共显性模型、显性模型以及加性模型中均存在统计学差异(P<0.05)。ADIPOQ rs182052在共显性模型和显性模型中,当以突变型GG基因型为参照时,AG和AA基因型为痰湿质患者的保护因素;LEPR rs11208659在显性模型中,当以突变型TT基因型为参照时,发现TC和CC基因型为痰湿质患者的危险因素。NAFLD患者中C等位基因携带者痰湿质发生的风险是非痰湿质发生的2倍[OR=2.05(1.07~3.96)]。
3 讨论
瘦素位于7号染色体q31.3位点,包含3个外显子和2个内含子,由146个氨基酸组成,是分子量为16 kD的脂肪组织源性多肽激素[14]。LEPR属于1类细胞因子受体家族,可在人体多种组织器官中表达。Wellhoener等[15]发现,葡萄糖代谢是机体瘦素表达和分泌的主要决定因素。而肝脏又是脂肪代谢和葡萄糖调节的重要脏器,瘦素参与肝内脂肪和葡萄糖代谢,通过增强葡萄糖-6磷酸激酶的活性,使得磷酸烯醇丙酮酸羧激酶(PEPCK)活性增强,糖异生的效率增高,刺激肝糖原产生,而当LEPR位点发生突变时,瘦素在肝脏内的生物学效应不能正常发挥,致使葡萄糖-6磷酸激酶和PEPCK的活性降低,糖酵解活动增强,肝糖原减少,从而产生脂肪肝[16]。
ADIPOQ位于3号染色体q27.3,包含3个外显子和2个内含子,由244个氨基酸组成,是分子量为30 kD的分泌蛋白。主要是由脂肪细胞产生的一种保护肝脏的细胞因子,与脂肪水平成负相关。NAFLD的“一次打击学说”认为其产生的原因是胰岛素抵抗(IR),IR主要通过两种机制增加肝细胞中脂肪的沉积-脂解作用和高胰岛素血症[17]。当机体出现IR时,胰岛素作用减弱,脂肪迅速分解以及葡萄糖利用能力下降,致使机体产生脂肪代谢紊乱,血糖浓度代偿性升高。而ADIPOQ可以增加胰岛素敏感性,通过降低葡萄糖-6磷酸激酶和PEPCK的生物学活性,从而刺激糖异生过程,维持细胞内糖脂代谢的稳态。而当ADIPOQ位点突变时,其不能增加胰岛素敏感性以及纠正机体的脂肪代谢紊乱,从而引发脂肪肝[18]。
NAFLD属中医“痞满”、“湿阻”、“肝癖”等范畴。国医大师李振华教授认为NAFLD病位在肝,病机关键在脾,属痰饮为患[19]。《金匮要略》有云:“见肝之病,知肝传脾,当先实脾”。脾升胃降,为人体气机之枢纽。《素问·灵兰秘典论》曰:“脾胃者, 仓廪之官, 五味出焉。”本研究人群均为老年人,具有虚、痰、瘀、郁等生理特点,其中以虚为主。饮食不节、劳逸失调等导致脾失健运,水谷精微失于运化,化为痰饮,阻滞于肝及情志失调,肝气郁结,肝失疏泄,气滞血瘀,使得痰瘀互结,本病而生[20]。
本研究结果提示:①LEPRrs11208659位点为NAFLD痰湿质患者的危险因素,而ADIPOQrs182052位点为其保护基因;②ADIPOQ rs182052 野生型AA基因型为参照时,突变型GG基因型携带者痰湿质的发病风险为野生型AA基因型携带者的2倍。
本研究从分子生物学角度分析了LEPR(rs1805094、rs11208659、rs4655537、rs12409877)和ADIPOQ(rs182052、rs3774261、rs6773957、rs17366568)基因多态性与NAFLD痰湿质的相关性,初步揭示了ADIPOQ为NAFLD痰湿质患者的保护基因,ADIPOQ rs182052位点突变可能是NAFLD痰湿质患者的分子遗传学基础之一。本研究为NAFLD痰湿质患者的早期预防提供一定的数据支持。痰湿质是由于先天遗传和后天嗜食肥甘厚腻,脾失健运,痰湿凝聚,以黏滞重浊为核心特征的体质[21]。体质具有后天可调性,因此中医通过干预体质来早期预防疾病有着独特的优势,通过纠正或改善偏颇体质,降低疾病的易感性,可预防或延缓疾病的发生发展,降低社会医疗负担。本研究尚存诸多不足,如患者为65岁以上老年人,且样本量相对偏少,仍需后期扩大样本量展开进一步研究。
