糖皮质激素广谱特异性单克隆抗体的制备及其ic-ELISA方法的建立
2019-07-26姚添淇劳翠瑜王士峰胡桂平张世伟
姚添淇,劳翠瑜,王士峰,胡桂平,张世伟*
(广东省深圳市计量质量检测研究院,国家营养食品质量监督检验中心,广东 深圳 518060)
糖皮质类激素是类固醇激素类的一种,具有强大的抗炎、抗过敏、免疫抑制和抗增生的作用[1]。在养殖业方面,糖皮质激素能促进动物的非正常生长,可以大幅提高动物养殖的经济效应,所以在养殖业中被大量使用[2]。但是滥用糖皮质类激素会使其在动物组织中及奶制品中存在不同程度的残留,人体长期食用这些残留有糖皮质激素的食品会导致机体代谢紊乱和发育异常等状况[3-4]。另外有一些不法商贩通过对一些保健品、中药材等非法添加糖皮质激素[5-7],会使消费者在食用后短期内出现一些积极作用,但长期摄入则可能会引起内分泌失调、致畸、致癌、水肿、糖尿病等严重后果[8-9]。
随着近年来人民生活水平在不断提高,人们的饮食观念也从注重食品数量向注重食品质量转变,食品安全既关系到人民群众的切身健康也关系到我国食品行业的良性发展。在经济利益的驱使下,不法商贩非法滥用糖皮质激素的情况不容乐观[10-11]。在我国农业部2002年235号公告《动物性食品中兽药最高残留限量》[12]对各类糖皮质类激素进行了最高限量值的规定,欧盟、日本等国际组织或国家也禁止对食品源性动物使用糖皮质类激素。现有常用的糖皮质激素检测方法主要为气相色谱法、高效液相色谱法、气相色谱-质谱联用和液相色谱-质谱联用等方法[13-15],这些方法均需要采样后返回实验室内运用大型设备仪器进行检测,对于检测的便利性与时效性无法保证,建立一种快速、简单、可靠的检测方法具有重要意义。


图1 几种常见的糖皮质激素化学结构式Fig. 1 Chemical structures of several common glucocorticoids
糖皮质激素的种类多样,常见的糖皮质类激素包括氢化可的松、可的松、地塞米松、曲安奈德、丙酸氯倍他索、倍他米松、泼尼松和泼尼松龙等。如图1所示,几种常见糖皮质激素化学结构图具有类似的母环结构,也具有不同程度但作用相似的抗炎和促进非正常生长等作用。为应对不法商家违规使用或添加不同种类糖皮质激素的现象,除达到检测方法的灵敏度外,也要求检测方法具有一定广谱特异性。越来越多的研究发现基于异源策略的酶联免疫吸附检测(enzyme linked immunosorbent assay,ELISA)可以显著提高检测小分子的灵敏度[16-23]。本实验通过筛选得到氢化可的松单克隆抗体,对12 种糖皮质激素进行同源和异源包被的间接竞争酶联免疫吸附检测(indirect competitive-enzyme linked immunosorbent assay,ic-ELISA),为更好地应对不同种类糖皮质类激素残留的检测需求提供理论支持。
1 材料与方法
1.1 材料与试剂
液体乳样品 中国伊利集团;小鼠骨髓瘤细胞SP2/0为本实验室保存;6~8 周龄雄性SPF级Balb/c小鼠购自广东省医学动物实验中心。
卵清蛋白(ovalbumin,OVA)、钥孔戚血蓝蛋白(keyhole limpet hemocyanin,KLH)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide hydrochloride,EDC)、N-羟基丁二酰亚胺(N-hydroxysuccinimide,NHS)、聚乙二醇(polyethylene glycol,PEG) 美国Sigma公司;免疫佐剂 北京博奥龙免疫技术有限公司;糖皮质激素标准品(乙酸氟氢可的松、倍氯米松、倍他米松、乙酸地塞米松、泼尼松、泼尼松龙、甲基泼尼松) 德国Dr. Ehrenstorfer公司;丙酸氯倍他索 中国Adamas-beta公司;可的松、曲安奈德、氢化可的松、地塞米松百灵威科技有限公司;BCA蛋白浓度检测试剂盒湖南艾佳生物科技公司;高糖DMEM细胞培养基(DMEM-GlutaMAX)、胎牛血清(fetal bovine serum,FBS)、青霉素-链霉谷-氨酰胺混合液(100×)、HAT添加剂(50×)、HT添加剂(100×) 美国Gibco公司;HRP标记山羊抗鼠IgG抗体 美国Arista Biologicals公司;ELISA酶标板 美国Corning公司。
磷酸盐缓冲液(phosphate buffer saline,PBS):pH 7.4,0.2 g/L KH2PO4,2.9 g/L Na2HPO4·H2O,0.2 g/L KCl,8.5 g/L NaCl;PBST:含0.05% Tween 20的PBS;包被液:pH 9.6,0.75 g Na2CO3,1.46 g NaHCO3;封闭液:5%脱脂奶粉溶解于PBS。
1.2 仪器与设备
SynergyH1酶标仪、96 孔酶联免疫洗板机 美国BioTek公司;超纯水机 美国Merck Millipore公司。
1.3 方法
1.3.1 氢化可的松半抗原HYD及地塞米松半抗原DEX合成
氢化可的松半抗原HYD合成(图2):称取氢化可的松0.18 g、丁二酸酐0.15 g于50 mL圆底烧瓶中,加入无水吡啶5 mL,混合后在60 ℃反应8 h,停止加热后冷却至室温,将反应物转移至20 mL 10%的HCl冰水浴中,有大量白色沉淀析出,过滤后用去离子水洗涤数次,干燥后得半抗原白色固体约138 mg。
地塞米松半抗原DEX合成(图2):称取地塞米松0.16 g、丁二酸酐0.12 g于50 mL圆底烧瓶中,加入无水吡啶5 mL,混合后在60 ℃反应8 h,停止加热后冷却至室温,将反应物转移至20 mL 10%的HCl冰水浴中,有大量白色沉淀析出,过滤后用去离子水洗涤数次,干燥后得半抗原白色固体约130 mg。
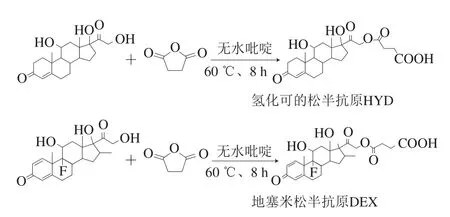
图2 氢化可的松半抗原HYD及地塞米松半抗原DEX合成Fig. 2 Synthesis of haptens from HYD and from DEX
1.3.2 完整抗原合成与鉴定
完整抗原参考活泼酯法[24]进行合成,将氢化可的松半抗原HYD分别与载体蛋白KLH和OVA偶联得到完整抗原KLH-HYD和OVA-HYD,地塞米松半抗原DEX与载体蛋白OVA偶联得到OVA-DEX,其中合成的KLH-HYD作为小鼠的免疫抗原,OVA-HYD和OVA-DEX作为酶联反应的包被抗原,合成的完整抗原均采用BCA蛋白浓度检测试剂盒测定其质量浓度,-20 ℃保存备用。
1.3.3 动物免疫与细胞融合
选取8 只6~8 周龄雄性Balb/c小鼠,将KLH-HYD完整抗原稀释至2 µg/µL,稀释后的完整抗原与商品化佐剂按照1∶1比例振荡混合均匀,吸取100 µL混合抗原对每只小鼠腿部进行肌肉注射,第一次免疫后于第6、13天以同样条件对小鼠进行加强免疫,在第20天时对小鼠进行尾静脉取血,采用ic-ELISA方法检测小鼠血清的亲和力及特异性,选取血清效价1∶20 000以上中抑制率最高的小鼠进行腹腔注射KLH-HYD完整抗原冲击免疫,3 d后无菌提取脾细胞与小鼠骨髓瘤细胞SP2/0进行细胞融合[25]。
1.3.4 单克隆抗体的筛选与腹水制备
细胞融合10 d后在显微镜下观察细胞融合率达100%,在融合第12天后,观察大部分孔内杂交瘤细胞长至约1/4孔底面积时对细胞上清液进行ic-ELISA检测,后经过多轮筛选验证及亚克隆,获得1 株稳定分泌抗氢化可抗体的细胞株(命名为HYD-C1)。利用HYD-C1细胞株诱导Balb/c小鼠产生腹水,将获得的腹水抗体通过辛酸硫酸铵沉淀法进行纯化[26],纯化后产物分装-80 ℃保存备用。
1.3.5 ic-ELISA的建立
使用棋盘法[27]分别确定同源策略(包被原为OVAHYD)和异源策略(包被原为OVA-DEX)下抗原及包被原的最佳工作质量浓度。利用棋盘法中得到的最佳工作质量浓度,以4 倍稀释法制备不同质量浓度的氢化可的松标准液作为竞争物,分别建立同源和异源策略氢化可的松ic-ELISA标准曲线。结合率按照公式(1)计算:

式中:B为一定竞争物氢化可的松质量浓度时在450 nm波长处的OD值;B0为不加任何抑制物时在450 nm波长处的OD值。
标准曲线以氢化可的松质量浓度的常用对数值为横坐标,以结合率为纵坐标,当结合率为50%时相应的抑制物质量浓度即为IC50值,以此评价其灵敏度,对比两种不同策略下的检测结果。
1.3.6 糖皮质激素交叉抑制检测
利用棋盘法优化后得到的ic-ELISA工作条件,分别在包被同源抗原OVA-HYD及包被异源抗原OVA-DEX的情况下,采用4 倍稀释法检测得到的氢化可的松单克隆抗体对地塞米松、乙酸地塞米松、可的松、乙酸氟氢可的松、丙酸氯倍他索、曲安奈德、倍氯米松、倍他米松、泼尼松、泼尼松龙、甲基泼尼松11 种糖皮质激素进行交叉抑制检测,分别制作标准曲线计算每种糖皮质激素对应半抑制浓度IC50值、检测限IC10值,交叉反应率根据公式(2)计算:

式中:IC50氢化可的松为抑制物为氢化可的松时的半抑制浓度/(ng/mL);IC50目的抑制物为待测目的抑制物的半抑制浓度/(ng/mL)。
计算出每种糖皮质激素对应氢化可的松在同源及异源策略情况下的交叉反应率,对比两种策略下的氢化可的松单克隆抗体的广谱特异性情况。
1.3.7 添加回收实验
将筛选出具有交叉反应的糖皮质激素分别稀释成不同质量浓度的标准液,添加至正规超市中采购的液体乳样品中,首先使用高效液相色谱-串联质谱法准确测定出空白液体乳样品中的待测的各糖皮质激素含量,在此基础上分别在液体乳中添加已知含量的各类糖皮质激素,振荡混匀,采用ic-ELISA,扣除空白样品中本底值后计算各种糖皮质激素的添加回收率。
1.4 数据统计及图像处理
利用Origin pro 2018及Excel等软件绘制标准曲线及分析数据,化学结构式由ChemBioDraw Ultra 14.0绘制。
2 结果与分析
2.1 抗原抗体最佳工作质量浓度确定
基于棋盘法对OVA-HYD和OVA-DEX两种包被抗原的最佳工作质量浓度及纯化后的抗体稀释倍数进行确定。确定工作质量浓度如下:同源包被抗原OVA-HYD和异源包被抗原OVA-DEX的最佳工作质量浓度均为1 µg/mL,腹水抗体HYD-C1的最佳稀释倍数为10 000 倍。
2.2 同源及异源策略ic-ELISA
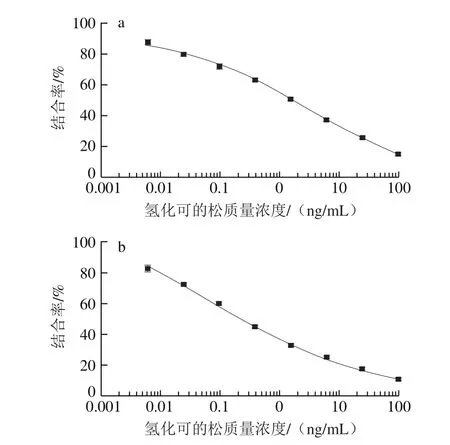
图3 同源(a)和异源(b)策略ic-ELISA法检测氢化可的松标准曲线Fig. 3 Standard curves for detection of hydrocortisone using homologous (a) and heterologous (b) ic-ELISA
根据优化后的最佳抗原抗体工作质量浓度,以4 倍稀释法分别建立氢化可的松同源及异源策略ic-ELISA的标准曲线,如图3所示,同源策略IC50氢化可的松为1.63 ng/mL;异源策略IC50氢化可的松为0.24 ng/mL。结果表明在异源策略中氢化可的松的灵敏度大幅高于同源策略中得到的结果。
2.3 糖皮质激素交叉抑制检测结果

表1 基于单克隆抗体建立的同源及异源策略ic-ELISA法对糖皮质激素的灵敏度及交叉反应率检测结果Table 1 Cross-reactivity of monoclonal antibody against hydrocortisone with other glucocorticoids in homologous and heterologous ic-ELISA
如表1所示,在用OVA-HYD同源包被情况下,可的松、乙酸氟氢可的松、泼尼松、泼尼松龙、甲基泼尼松、倍氯米松6 种糖皮质激素有较明显交叉抑制,交叉反应率分别为38.6%、8.89%、70.78%、205.52%、2.52%和0.36%,剩余5 种糖皮质激素的灵敏度IC50值均大于1×103ng/mL,无明显交叉抑制情况;在OVA-DEX异源包被情况下,5 种在同源情况下无交叉抑制的糖皮质激素也出现了明显抑制情况,灵敏度范围从0.19 ng/mL(乙酸氟氢可的松)到79.29 ng/mL(倍他米松),交叉抑制率范围从0.3%(倍他米松)到126.32%(乙酸氟氢可的松)。结果表明,在同源和异源策略下该单克隆抗体都具有糖皮质激素广谱特异性,但在异源策略下对各种糖皮质激素的灵敏度较之同源包被的情况发生了较大程度的提高,也具有更广谱的糖皮质激素抑制特征。
2.4 添加回收实验结果

表2 基于单克隆抗体建立异源策略ic-ELISA法对糖皮质激素的添加回收检测结果Table 2 Recoveries of spiked glucocorticoids by heterologous ic-ELISA

续表2
如表2所示,在异源策略中平均添加回收率在77.5%~111.3%之间,变异系数在1.2%~8.6%之间,结果表明异源策略ic-ELISA检测的糖皮质激素添加回收率落在合理范围内,符合检测所需指标,方法重复性较好、可以满足于液体乳样品中激素残留的检测需求。
3 结 论
本研究将氢化可的松半抗原HYD与KLH利用活泼酯法连接成完整抗原KLH-HYD使小鼠免疫,将HYD及地塞米松半抗原DEX分别与OVA连接成OVA-HYD和OVA-DEX完整抗原用作包被抗原,后取小鼠脾脏与SP2/0细胞进行细胞融合筛选得到1 株稳定分泌氢化可的松抗体的单克隆抗体,命名为HYD-C1,并利用该细胞株大量制备氢化可的松腹水抗体。以OVA-HYD作为同源包被源,以OVA-DEX作为异源包被源,利用得到的抗体分别建立同源策略及异源策略的氢化可的松ic-ELISA法标准曲线,发现在异源策略下的灵敏度(0.24 ng/mL)比同源策略下的(1.63 ng/mL)高出近1 个数量级。
利用该抗体在不同策略下进行11 种糖皮质激素的广谱特异性检测,发现在异源策略下11 种糖皮质激素的检测灵敏度均明显提高,在同源策略下没有明显抑制的地塞米松、丙酸氯倍他索、曲安奈德、乙酸地塞米松和倍他米松5 种糖皮质激素均在异源策略下发生明显抑制,说明在异源策略中该抗体对应的糖皮质激素抑制谱更宽,灵敏度也更高。在异源策略下液体乳的糖皮质激素添加回收实验中平均添加回收率在77.5%~111.3%之间,在合理范围区间,重复性较好,本方法中对于氢化可的松、可的松、乙酸氟氢可的松、泼尼松和泼尼松龙的检测限均能达到GB/T 21981—2008《动物源食品中激素多残留检测方法 液相色谱-质谱/质谱法》中检测低限,该方法的广谱特异性可良好运用于对液体乳样品中糖皮质激素残留的现场初筛检测。
本研究着重对比了氢化可的松抗体在同源策略与异源策略下对各种不同种类的糖皮质激素的结合情况,推测存在异源包被的抗原在与抗体结合时的作用力要弱于同源包被时的情况,继而使得游离抑制物可以更容易与包被抗原竞争性地与抗体结合,使得许多在同源情况下不具备竞争能力的糖皮质激素在包被抗原结合力变弱时相对也具备了竞争优势,但具体的分子作用力之间的机理有待进一步研究。异源策略大幅加强了抗体对具有类似结构的其他糖皮质激素的检测灵敏度,拓宽了糖皮质激素的检测谱宽,这一策略可以更好地应用于需要进行广谱筛查的日常检测工作中,也为其他有提高灵敏度或提高广谱特异性需求的研究提供参考。
