南极假丝酵母脂肪酶B在黑曲霉中的分泌表达及其硅藻土固定化应用
2019-07-26张玲敏
张玲敏,王 斌,潘 力*
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东 广州 510006)
脂肪酶(EC 3.1.1.3)是用于三酰基甘油水解的生物催化剂[1],具有高度的化学、区域和立体选择性,可催化酯类化合物的合成、分解、酯交换等多种反应,因而被普遍应用于食品、化妆品、化工和制药等产业[2]。南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)是一种优异的脂肪酶,在水相、有机相中均具有很强的催化活性[3]。由于其具有特殊的活性中心结构[4-5],CALB没有表现出界面活性却有极强的立体选择性和宽泛的底物特异性[6],因此在手性化合物拆分、有机合成、医药中间体制备等领域得到广泛应用[7-9]。
1994年Uppenberg等[5]已研究出CALB自由酶的三维立体结构和氨基酸序列;1995年,诺和诺德公司成功克隆出CALB基因,并首次在米曲霉里成功表达[10];受米曲霉成功表达的启发,CALB相继实现了在大肠杆菌[11]、酿酒酵母[12]、毕赤酵母[13]等宿主中的表达。但是,米曲霉生产的商业化CALB价格昂贵无法满足工业需求[14];大肠杆菌缺乏蛋白质翻译后修饰系统,对真核来源的蛋白质多以包涵体的形式产生[10];毕赤酵母表达常用甲醇作为唯一碳源诱导培养,导致CALB在食品工业中的应用受到限制[15];酿酒酵母容易对CALB产生过度糖基化而降低其活性[16]。而黑曲霉代谢能力强、外源蛋白产量大、分泌效率高,具备完善的蛋白翻译后修饰系统,是美国食品药品监督管理局认证的通常认为安全(generally regarded as safe,GRAS)的菌株[17-19]。然而目前几乎没有关于黑曲霉分泌表达CALB的文献报道,因此本研究利用黑曲霉表达系统对CALB进行分泌表达,对于提高其产量、降低成本、满足工业化需求具有非常重要的意义。
己酸乙酯是一种广泛应用于食品调香的酯类香料,主要用作白酒、食醋、糖果的调香剂[20]。与传统化学法相比,酶法合成己酯乙酯具有反应条件温和、产率高、副产物少、易提取等优点[21]。本研究根据黑曲霉密码子偏好性设计合成了CALB基因并在黑曲霉HL-1中成功实现分泌表达,对纯化后的CALB进行了酶学性质分析,优化了CALB在硅藻土上的固定条件,同时研究了硅藻土-CALB固定化酶在无溶剂体系中合成己酸乙酯的应用。提供了一种用廉价载体简易有效固定CALB催化己酸乙酯经济、快速、高效的合成途径,为硅藻土-CALB固定化酶在酯化、水解、转酯等方面的应用提供理论支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
大肠杆菌Match1T1 美国Invitrogen公司;黑曲霉HL-1 本实验室保藏。
pUEV质粒 本实验室构建;Bgl II和Apa I快速限制性内切酶、DreamTaq Green PCR Master Mix美国Thermo Fisher Scientific公司;PCR预混酶Prime STAR HS(premix) 日本TaKaRa公司;HiFi DNA Assembly Cloning Kit 美国NEB公司;4-硝基苯丁酸酯(p-nitrophenyl butyrate,pNPB) 上海麦克林生化科技有限公司;引物 广州天一辉远公司。
1.1.2 培养基
察氏(Czapek-Dox,CD)培养基(固体含2%琼脂,液体含0.05%琼脂):2%葡萄糖,0.3% NaNO3,0.2% KCl,0.05% MgSO4·7H2O,0.1% KH2PO4,0.001% FeSO4·7H2O,pH 5.5。
蔗糖高渗培养基(上层板含0.5%琼脂,底层板含2%琼脂):40%蔗糖,0.3% NaNO3,0.2% KCl,0.05% MgSO4·7H2O,0.1% KH2PO4,0.001% FeSO4·7H2O,pH 5.5。
淀粉固体培养基:0.3%牛肉膏,0.2%酵母粉,1%蛋白胨,0.2% NaCl,1%可溶性淀粉,2%琼脂。
淀粉发酵培养基:5%玉米淀粉(需沸水浴加酶液化),3%玉米浆,2%黄豆饼粉。
三丁酸甘油酯固体培养基:0.2%橄榄油,0.5%三丁酸甘油酯,0.3% NaNO3,0.1% KH2PO4,0.05% MgSO4·7H2O,0.05% KCl,1%葡萄糖,0.25%曲拉通,2%琼脂。
1.2 仪器与设备
Veriti 96-Well Thermal Cycler梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;微量移液器、高速冷冻离心机 德国Eppendorf公司;酶标仪 美国Thermo Fisher Scientific公司;浸入式水平电泳系统 美国Bio-Rad公司;AKATA层析仪 美国通用电气公司;高速分散匀质机上海标本模型厂。
1.3 方法
1.3.1 CALB基因的优化、合成与克隆
将CALB的氨基酸序列和黑曲霉密码子偏好表发给南京金斯瑞生物科技有限公司,委托其合成密码子优化后的CALB基因并连接到pUC57T载体上,质粒pUC57T-CALB用大肠杆菌Top 10保种。在实验室克隆CALB基因则以提取的pUC57T-CALB质粒为模板,设计扩增引物,上游引物:5’-ATGAAGCTGCTCTCCCTGACCG-3’;下游引物:5’-AAATGGATTGATTGTTCAGTGATGATGA TGATGATGGGGGGTCACGATACCGGAGC-3’(下划线分别表示含15 bp与表达载体重叠的序列和18 bp 6×His-Tag标签序列)。PCR体系:质粒模板2 μL,上下游引物各0.5 μL,2×Prime STAR 25 μL,ddH2O补足到总体积为50 μL,做2 个平行,共100 μL。PCR条件:98 ℃预变性10 min;98 ℃变性30 s,68 ℃退火30 s,72 ℃延伸2 min,共35 个循环;72 ℃延伸7 min。PCR产物经1% DNA琼脂糖凝胶电泳鉴定正确后纯化回收存于-20 ℃备用。
1.3.2 表达载体pUEV-PnaII/tpi-CALB的构建及黑曲霉HL-1转化
PnaII/tpi是一个高效的杂合启动子,以黑曲霉HL-1基因组为模板,可设计引物进行克隆。上游引物:5’-AT GGGCCCAGATCTCAATTCATGGTGTTTTGATCATTT TAA-3’(下划线表示含15 bp与表达载体重叠的序列),下游引物:5’-GGAGAGCAGCTTCATCCCAGTTGTGT ATATAGAGGA-3’(下划线表示含15 bp与CALB重叠的序列),PCR产物经DNA琼脂糖凝胶电泳鉴定正确后纯化回收存于-20 ℃备用。本实验室通用载体pUEV如图1所示,用限制性内切酶Bgl II使其线性化并纯化回收后与CALB、PnaII/tpi的PCR纯化产物在NEB HiFi DNA连接酶的作用下50 ℃反应30 min,然后转入大肠杆菌Match1T1中,涂布在含100 μg/mL Amp的LB平板上,最后将通过菌液电泳和质粒酶切验证的阳性质粒提交广州天一辉远公司进行序列鉴定。提取测序正确的重组质粒并用限制性内切酶Apa I进行线性化,通过CaCl2介导的原生质体转化法转化到黑曲霉HL-1中,取转化产物涂布于蔗糖高渗平板上,30 ℃培养5~7 d。
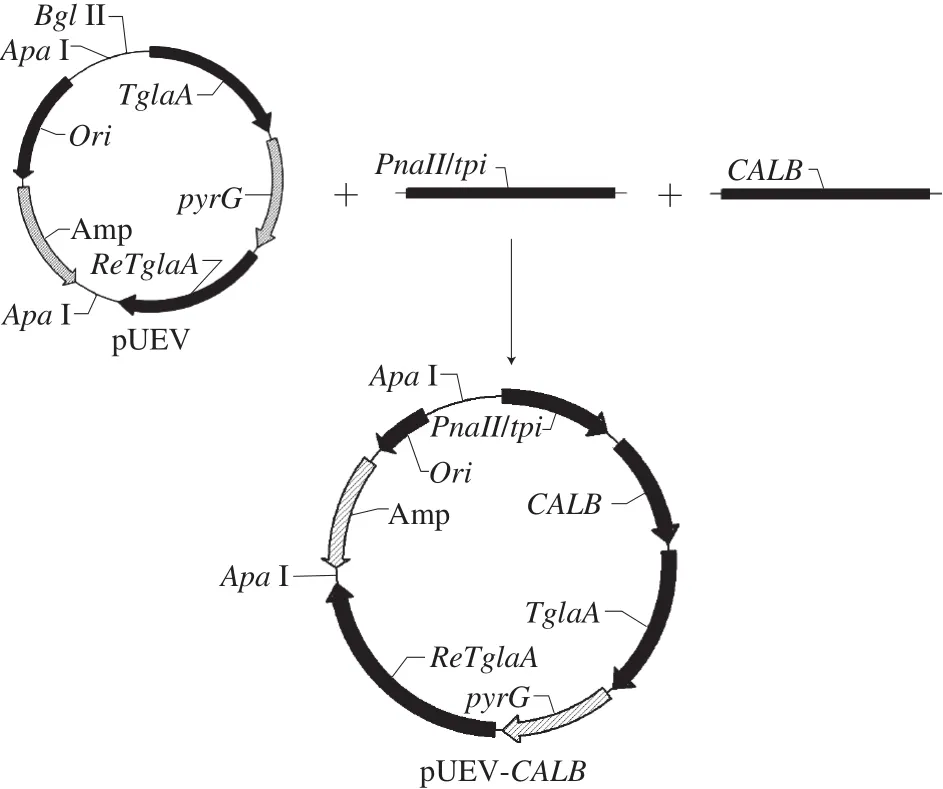
图1 重组质粒pUEV-PnaII/tpi-CALB的构建流程Fig. 1 Construction of recombinant plasmid pUEV-PnaII/tpi-CALB
1.3.3 重组工程菌的筛选和表达
挑取蔗糖高渗平板上的转化子至CD平板上,30 ℃培养3 d后再将CD平板上的转化子同时挑取到淀粉平板和三丁酸甘油酯平板上,待三丁酸甘油酯平板上出现透明水解圈后提取淀粉板上相应转化子的基因组进行目的基因PCR鉴定,然后将鉴定正确且水解圈较大的阳性转化子转移到液体CD培养基中静置培养,最后进行摇瓶发酵表达产酶。摇瓶发酵过程如下:取3 mL含CALB重组工程菌的CD液体培养基,放入含100 mL淀粉发酵培养基的500 mL锥形瓶中,30 ℃、200 r/min培养,发酵上清液即为粗酶液。
1.3.4 酶活力和蛋白含量测定
CALB活力以pNPB为底物,利用多功能酶标仪测定。反应体系如下:900 μL 50 mmol/L Tris-HCl缓冲液(pH 8.0),50 μL 25 mmol/L pNPB底物溶液,50 μL适当稀释的酶液,45 ℃反应5 min,测定反应液在405 nm波长处的吸光度。酶活力单位定义:在45 ℃、pH 8.0条件下,1 min内催化生成1 μmol对硝基苯酚所需要的酶量定义为1 U[1]。
蛋白质含量通过BCA试剂盒测定,待测样品37 ℃反应30 min后在562 nm波长处测定其吸光度[1]。
1.3.5 SDS-PAGE分析和蛋白纯化
取40 μL发酵上清液与10 μL 5×loading buffer混合,沸水浴5 min后取10 μL进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)。电泳采用12%的分离胶和5%的浓缩胶,60 V电泳30 min后切换到120 V,电泳结束后进行考马斯亮蓝染色。
蛋白纯化采用金属螯合层析法,原理是CALB上的His Tag可与层析柱上的Ni2+发生螯合作用而被吸附。发酵液在10 000×g、4 ℃离心2 次并用0.45 μm水系滤膜抽滤后存于4 ℃中待纯化,柱子选择GE公司的5 mL HisTrapTMHP,其上的金属位点用0.1 mol/L NiSO4溶液填充。具体纯化步骤如下:20%的乙醇溶液冲洗系统至基线平稳;将柱子连接到AKATA层析仪上;超纯水冲洗柱子至基线平稳;Buffer A(0.5 mol/L NaCl,20 mmol/L Tris,pH 8.0)冲洗柱子至基线平稳;取合适体积的待纯化样品上样;上样结束后,用Buffer A冲洗柱子至基线平稳;Buffer B(0.5 mol/L咪唑,0.5 mol/L NaCl,20 mmol/L Tris,pH 8.0)梯度洗脱(10%~100%)并收集有峰的洗脱液;洗脱结束后,先用超纯水冲洗柱子至基线平稳,再用20%乙醇溶液冲洗封柱。
1.3.6 酶学性质分析
1.3.6.1 最适温度和温度稳定性
在pH 8.0 Tris-HCl缓冲液中分别测定CALB在25~80 ℃的酶活力,活力最高的温度即为最适反应温度,以其酶活力为100%,计算其他温度下的相对酶活力。将CALB在25~70 ℃中分别水浴保温1 h,再在最适温度、pH 8.0条件下测定残余酶活力,以未做任何处理的酶液活力为100%,计算其他温度条件下的残余酶活力。
1.3.6.2 最适pH值和pH值稳定性
在50 ℃中分别测定CALB在pH 4~10(50 mmol/L柠檬酸-柠檬酸钠缓冲液:pH 4~6;50 mmol/L磷酸氢二钠-磷酸二氢钠缓冲液:pH 6~8;50 mmol/L Tris-HCl缓冲液:pH 8~10)条件下的酶活力,活力最高的pH值即为最适反应pH值,以其酶活力为100%,计算其他pH值条件下的相对酶活力。将CALB分别在pH 4~10中4 ℃保存24 h,再在最适温度、最适合pH值条件下测定残余酶活力,以未做任何处理的酶液活力为100%,计算其他pH值下的残余酶活力。
1.3.6.3 金属离子和表面活性剂对CALB活力的影响
将CALB分别在含有1、10 mmol/L不同金属离子(Na+、K+、Cu2+、Zn2+、Ca2+、Mg2+、Mn2+、Ni2+、Ba2+)和0.1 g/100 mL不同表面活性剂(SDS、山梨醇、TritonX-100、Tween-20)的pH 8.0 Tris-HCl缓冲液中40 ℃处理30 min,以未加金属离子和表面活性剂的酶活力为100%,在pH 8.0、50 ℃条件下测定相对酶活力。
1.3.7 硅藻土固定化酶的制备
在一定浓度、一定pH值的50 mL CALB粗酶液体系中加入一定量的硅藻土,搅拌均匀,恒温水浴振荡一定时间后,离心收集固体,将固定化载体用一定量的丙酮清洗3 遍,使载体颗粒分散,真空冷冻干燥后存于4 ℃备用[22]。固定化酶活力分析方法参照1.3.4节方法。
1.3.8 固定化酶用于己酸乙酯的合成
在50 mL具塞三角瓶中加入50 mmol己酸和一定量的无水乙醇作为反应物,所有反应物和固定化酶分别在密封容器中用饱和LiCl溶液(aw=0.11)于25 ℃预平衡3 d。在反应前向酯化体系加入一定量的水控制反应的初始含水量(占己酸物质的量百分比),最后加入固定化酶(100 U/g)立即启动反应,反应在200 r/min及一定温度的恒温水浴摇床中进行。随后,定时取出100 μL样品并与5 mL预冷的正己烷混合,通过在酚酞存在下用0.1 mol/L的氢氧化钾-乙醇标准溶液滴定取出的混合物,测定剩余脂肪酸含量以确定酯的合成[23]。
1.4 数据统计及图表绘制
实验中每组数据均做3 个平行,取平均值作图,误差分析采用标准差的方式,图表用Origin分析软件绘制。
2 结果与分析
2.1 表达载体pUEV-PnaII/tpi-CALB的构建
分别以pUC57T-CALB质粒和黑曲霉HL-1基因组为模板,PCR扩增得到CALB基因和PnaII/tpi启动子,经琼脂糖凝胶电泳(图2)可见,CALB大小约1 000 bp,PnaII/tpi大小约600 bp,将这两个片段回收并与线性化后的通用载体pUEV在重组酶的作用下连接,提取重组质粒,进行Apa I酶切验证,电泳结果显示片段大小正确,最后经DNA测序鉴定表达载体pUEV-PnaII/tpi-CALB已成功构建。

图2 CALB基因、PnaII/tpi启动子PCR扩增及重组质粒酶切鉴定Fig. 2 Electrophoretogram of PCR amplified products and restriction enzyme digestion analysis of plasmid pUEV-PnaII/tpi-CALB
2.2 重组工程菌的筛选和表达

图3 重组黑曲霉产酶曲线Fig. 3 Lipase production of recombinant Aspergillus niger
按照1.3.3节的方法筛选得到了1 株产重组CALB活力较高的转化子,命名为n17,将其CD液体培养基用30%(体积分数)甘油保种存于-80 ℃。在n17摇瓶发酵过程中,每隔24 h取样测定发酵上清液的酶活力。如图3所示,发酵培养到72 h时,酶活力达116 U/mL;而当发酵培养基含2%葡萄糖时,菌体生长期延长,酶活力在120 h时最高,达到171 U/mL。
2.3 SDS-PAGE分析和重组蛋白纯化

图4 重组CALB粗酶液(A)及纯化液(B)SDS-PAGE分析Fig. 4 SDS analysis of the crude (A) and purified (B) recombinant lipase
n17接种发酵培养基后每隔24 h取样,离心收集上清液进行SDS-PAGE分析,用未转入CALB的宿主作为对照。由图4A可见,在理论值33 kDa[24]附近出现了明显的条带,且随培养时间的延长,其浓度先增加后减小,对照则没有出现相应的条带,只是在50 kDa附近出现了2 个背景蛋白条带。
重组CALB经镍柱亲和层析纯化后,进行酶活力和蛋白含量测定,如表1所示,目的蛋白纯化了6.4 倍,但酶活力回收率仅6.2%,说明CALB在纯化过程中损失较大,但纯度较高。将纯化后的CALB进行SDS-PAGE分析(图4B),可知纯化产物仅出现单一条带且分子质量与上清液中CALB一致,证实该纯化产物即为CALB且纯化效果理想。

表1 重组蛋白的纯化Table 1 Purification of recombinant lipase
2.4 酶学性质分析
2.4.1 最适温度和热稳定性

图5 重组CALB的最适反应温度(A)及热稳定性(B)Fig. 5 Effect of temperature on the activity (A) and stability (B) of recombinant CALB
如图5A所示,在25~50 ℃范围内酶活力随温度升高逐渐上升,在50~80 ℃范围内酶活力随温度升高逐渐下降,说明该重组CALB的最适反应温度为50 ℃,与Liu Zhiqiang等[1]在毕赤酵母中表达的CALB最适反应温度52 ℃相近。如图5B所示,在25~45 ℃范围内,重组CALB具有较好的稳定性,残余酶活力在80%左右;当温度超过50 ℃时,酶的活性急剧下降,在70 ℃时酶活力仅为对照的6%,表明该酶对高温耐受性较差。
2.4.2 最适pH值和pH值稳定性
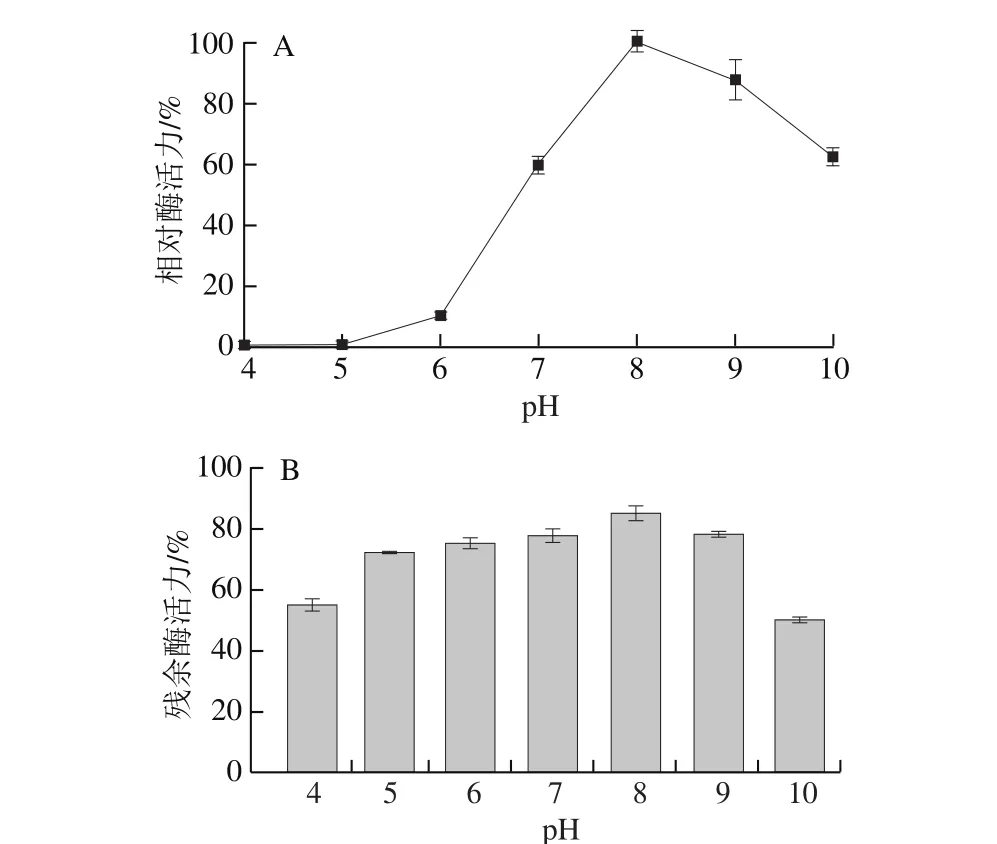
图6 重组CALB的最适反应pH值(A)及pH值稳定性(B)Fig. 6 Effect of pH value on the activity (A) and stability (B) of recombinant lipase
如图6A所示,在pH 4.0~5.0范围内几乎没有酶活力,在pH 6.0~8.0范围内随着pH值的升高酶活力逐渐升高,在pH 8.0~10.0范围内酶活力逐渐下降,说明重组CALB在弱碱环境中具有较好的活性,最适反应pH值为8.0,与其他报道[1,6]的重组CALB最适反应pH值一致。如图6B所示,重组CALB在pH 6.0~9.0范围内具有较好的稳定性,残余酶活力均在80%左右,当条件过酸或过碱时酶活力均会急剧下降。
2.4.3 金属离子和表面活性剂对CALB活力的影响
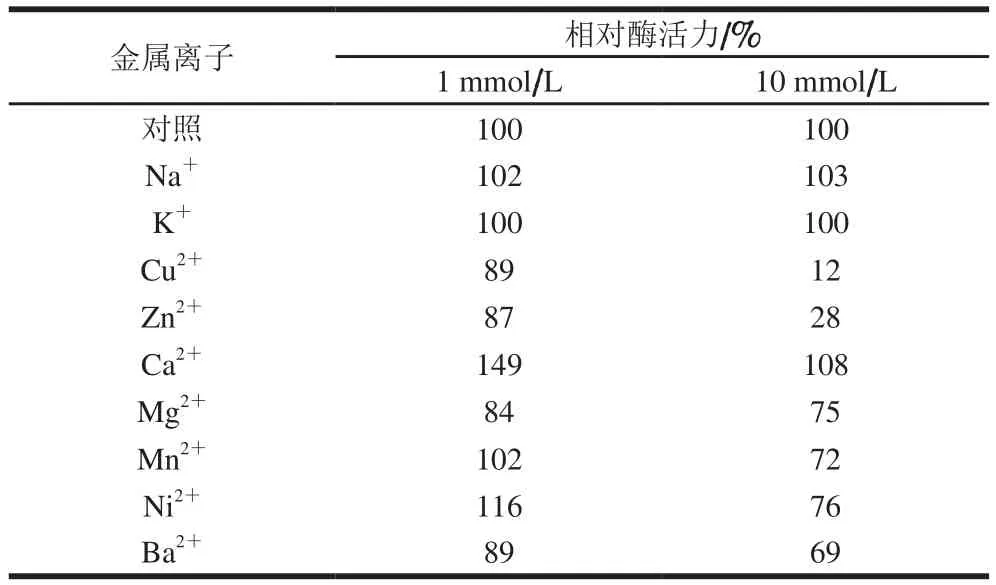
表2 不同金属离子对重组CALB活力的影响Table 2 Effects of different metal ions on the activity of recombinant CALB
由表2可知,低浓度(1 mmol/L)条件下Ca2+和Ni2+均对重组CALB具有激活作用,其中Ca2+激活作用最强;Na+、K+、Mn2+对重组CALB活力几乎没有影响;而Cu2+、Zn2+、Mg2+、Ba2+抑制重组CALB活力。在金属离子浓度提高到10 mmol/L时,Ca2+仍有轻微的激活作用,Ni2+由激活转为抑制;Na+、K+对CALB活力仍无影响;而Cu2+、Zn2+对CALB活力的抑制作用急剧加强。与其他研究[1,13]相比发现,Ca2+对重组CALB普遍具有激活作用,而Cu2+对重组CALB普遍具有抑制作用。
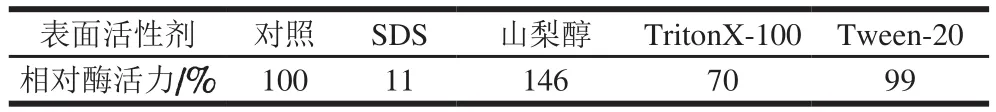
表3 不同表面活性剂对重组CALB活力的影响Table 3 Effects of different surfactants on the activity of recombinant CALB
由表3可知,在0.1 g/100 mL条件下,山梨醇对重组CALB具有明显的激活作用,激活强度比Liu Zhiqiang等[1]报道的高40%;而SDS和TritonX-100则抑制了重组CALB的活性,其中SDS抑制作用最强烈,抑制强度比Liu Zhiqiang等[1]报道的高83%;Tween-20则对CALB活力没有影响。
2.5 硅藻土对CALB固定条件优化
在固定时间4 h、pH 7.5、温度35 ℃条件下,向50 mL CALB粗酶液体系中加入1 g硅藻土,由图7A可知,随CALB粗酶液活力增加固定化酶相对活力逐渐升高,这是因为载体吸附的蛋白量逐渐增加。在CALB粗酶液活力为70 U/mL时,固定化酶相对活力最高,此时继续增加酶液用量会使固定化酶活力下降,原因在于每个载体分子表面吸附的蛋白量相对过多,造成酶分子相互聚集成团,酶分子的活性中心有可能被遮盖。
在固定时间4 h、pH 7.5、硅藻土质量1 g、CALB粗酶液活力70 U/mL条件下,研究不同温度对固定化的影响。由图7B可知,在25~40 ℃范围内固定化酶活力随温度升高而升高,这是因为温度升高导致分子运动逐步剧烈,蛋白吸附量有所提高;当温度超过40 ℃后,由于酶分子在较高温度发生了不可逆失活导致固定化酶活力下降,因此固定化温度不宜太高,最适固定温度为40 ℃。
在固定时间4 h、温度40 ℃、硅藻土质量1 g、CALB粗酶液活力70 U/mL条件下,研究pH值对固定化的影响。由图7C可知,硅藻土固定化CALB只有在弱碱环境下才能固定上较高酶活力,当pH值继续升高,CALB会带上负电荷并与硅藻土自身携带的负电荷产生电荷排斥效应,导致蛋白吸附量降低,因此最适固定pH值为7.5~8.0。
在固定温度40 ℃、pH 7.5、硅藻土质量1 g、CALB粗酶液活力70 U/mL条件下,研究固定时间对固定化的影响。由图7D可知,固定化酶活力在3 h最高,由于CALB热稳定不高,高温下继续延长固定时间会导致固定化酶活力降低。
2.6 固定化酶合成己酸乙酯条件优化
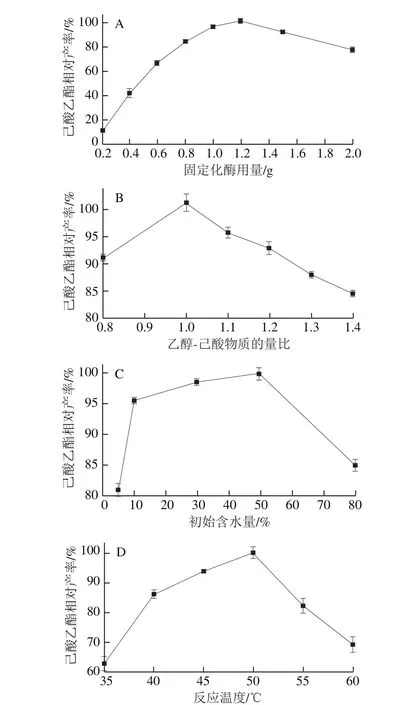
图8 固定化酶用量(A)、乙醇-己酸物质的量比(B)、初始含水量(C)及反应温度(D)对己酸乙酯产率的影响Fig. 8 Effects of immobilized enzyme dosage (A), molar ratio between ethanol and hexanoic acid (B), initial water content (C) and reaction temperature (D) on the yield of ethyl hexanoate
如图8所示,产物产率随固定化酶用量的增加而升高,但当固定化酶用量超过1.2 g时,酶相对底物出现饱和,固定化酶用量继续增加会影响传质降低酶促反应速率从而导致产物产率降低;当乙醇-己酸物质的量比为1.0时,产物产率最高,过量的酸或醇均不会增加产物产率;CALB分子表面需要一定量的结合水才能维持酶构象发挥催化活性[25],当反应体系中初始含水量为10%~50%时产物产率最高,初始含水量过低或过高都会急剧降低产物产率;在35~50 ℃范围内,随反应温度的升高,底物分子与酶分子碰撞更加频繁从而使产物产率提高,当温度超过50 ℃时,固定化酶在高温下逐渐变性失活,催化能力降低导致产物产率下降,因此最适反应温度为50 ℃。
2.7 固定化酶的操作稳定性
固定化酶比游离酶稳定性高,并且可以回收重复利用。在最佳反应条件下将固定化酶重复进行6 次己酸乙酯合成实验,如图9所示,从第4次开始,固定化酶的催化效果急剧下降,利用到第6次时催化能力仅剩20%左右,说明随着使用次数的增加,CALB会从硅藻土上脱落且高温反应也会导致固定化酶逐渐失活。

图9 固定化酶的操作稳定性Fig. 9 Operational stability of immobilized enzyme
3 讨论与结论
目前关于CALB的研究主要集中在其催化应用[26-27]和毕赤酵母表达[28-29]上,但是商业化CALB成本高难以实现大规模的工业化应用,而毕赤酵母对CALB无论是分泌表达还是展示表达均无法取得较高的活性和产量。黑曲霉作为成熟的真核表达系统,代谢灵活性强,蛋白分泌效率高,具备完善的蛋白翻译后修饰系统,Pan Zhiyou等[23]利用黑曲霉作为宿主表面展示表达CALB,但是存在CALB与锚定蛋白结合不牢固而容易外泄的问题,且在摇瓶发酵条件下对pNPB的水解活力仅为400 U/g(以干细胞计)。
本研究根据黑曲霉密码子偏好性将CALB基因进行密码子优化后成功转入黑曲霉HL-1中实现分泌表达,在含2%葡萄糖的淀粉发酵培养基中进行摇瓶发酵,其上清液酶活力达到171 U/mL,分别是毕赤酵母分泌表达11.1 U/mL[6]和46 U/mL[13]的15.5 倍和3.7 倍。CALB粗酶液经镍柱亲和层析后纯化了6.4 倍,但酶活回收率较低。重组CALB最适反应温度为50 ℃,最适反应pH值为8.0,在pH 6.0~9.0和45 ℃以下具有较高的稳定性,发现Ca2+对CALB有激活作用,而Zn2+和Cu2+对CALB有强烈的抑制作用,表面活性剂山梨醇可提高CALB活力,而SDS则强烈抑制CALB活力。
CALB固定化多以有机材料作载体,固定过程繁琐且费用高,而硅藻土是一种常用来固定脂肪酶的无机载体,其价格便宜,固定过程简单,依靠其强烈的吸附作用即可固定蛋白质,因此本研究使用硅藻土作为CALB的固定载体,以期获得经济有效的固定化酶。经过实验探究得出最佳固定条件为温度40 ℃、pH 7.5、时间3 h,在最佳固定条件下,1 g硅藻土对50 mL CALB粗酶液(70 U/mL)的固定量为187 U/g。在测试该固定化酶催化己酸乙酯合成过程中得出最佳反应条件为:酶使用量1.2 g(100 U/g)、酸醇物质的量比1.0、初始含水量10%~50%,反应温度50 ℃。在该反应条件下,己酸乙酯在4 h内便达到了最高产率91%,取得了与CALB全细胞生物催化剂同样的效率[23],由此表明利用硅藻土固定CALB制备固定化酶具有简单、经济及高效的优点。
本研究成功实现了CALB的高效胞外分泌表达,并对该酶的硅藻土固定化应用进行了探索,基于本实验的研究现状,今后可采用高密度发酵培养技术以进一步提高CALB的产量和活性,使其最终能满足工业化需求。
