黑果枸杞酵素自然发酵过程中微生物群落的动态变化
2019-07-24高庆超常应九马蓉曹效海王树林
高庆超,常应九,马蓉,曹效海, 2,王树林, 2*
1(青海大学 农牧学院,青海 西宁,810016) 2(青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁,810016)
黑果枸杞(LyciumruthenicumMurr.)属于茄科枸杞属,主要分布于我国西北等地,其富含多种营养成分和活性成分,且具有多种生物活性,如抗氧化、抗疲劳、预防癌症、抗心血管疾病等[1-2],充分利用黑果枸杞及其药用价值开发新的食品及药品,对人类健康具有重要意义。
酵素是以乳酸菌、酵母菌等多菌种复合发酵果蔬、菌菇及中草药等,形成富含矿物质、维生素、多种酶、有机酸和少量乙醇等产物的液态或固态食品[3]。酵素旧称为“酶”,但不只是酶,它还包含产酶微生物和相互调节因子及其相互作用的产物,强调的是微生态整体[4-5]。酵素中主要微生物为酵母菌、醋酸菌和乳酸菌,其发酵过程是复杂的间歇性过程[6],TEOH等[7]从红茶菌酵素分离出接合酵母。卢梦瑶等[8]以10种酵素为菌源,经分离纯化、产酸定性和定量试验及16S rDNA水平鉴定,获得1株高产醋酸菌为芝庇侬醋酸杆菌。MARISA等[9]从诺丽酵素中分离出欧文氏菌和葡萄糖杆菌。
传统微生物分离方法是在微生物发酵食品领域中一种最常用的研究方法,但其得到的微生物信息较片面,有很大的局限性,而近年来,由于高通量测序技术具备灵敏度高、读数长和效率高的特点,能更加真实地反映发酵食品中微生物群落定性及相对定量的遗传信息[10-11],已广泛应用于发酵食品微生物体系研究。
本研究以黑果枸杞酵素为研究对象,采用Illumina MiSeq高通量测序技术对不同发酵阶段的酵素中的主要微生物群落构成及动态变化进行研究,为揭示黑果枸杞酵素发酵中微生物群落结构变化和相互作用关系提供依据,以期能够实现发酵过程中微生物菌群的调控,为黑果枸杞酵素的开发提供理论参考。
1 试验材料与方法
1.1 主要试验材料及仪器
黑果枸杞、枸杞、玛卡、蕨麻、沙棘粉等,青海千平万安农业科技有限公司提供。
E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒(OMEGA);Qubit3.0 DNA检测试剂盒(Life);2×TaqMaster Mix(Vazyme);MagicPure Size Selection DNA Beads(Transgen)等。
Pico-21台式离心机,Thermo Fisher;凝胶成像系统,美国UVP;Qubit®3.0荧光计,Invitrogen;PCR仪,BIO-RAD;DYCP-31DN DNA电泳槽,北京六一仪器厂;混匀型干式恒温器,深圳拓能达科技有限公司。
1.2 试验方法
1.2.1 黑果枸杞酵素制作
称取黑果枸杞300 g、枸杞200 g、蕨麻125 g、玛卡75 g、红糖125 g、沙棘粉25 g、无菌水2 L,玛卡和蕨麻清洗后水煮60 min至变软,黑果枸杞和枸杞清洗后按质量比1∶3加无菌水进行复水,将全部原料打浆,转至灭菌坛中搅匀,密封并做相应标记,置于28 ℃培养箱下避光发酵,每10 d平行取样3次,并编号为0、10、20、30、40、50和60 d,置于-80 ℃冰箱中待测。
1.2.2 理化及活性成分的测定
可滴定酸按照GB/T 12456—2008《食品中总酸的测定》进行测定[12]。总糖含量测定采用蒽酮-硫酸法[13],以葡萄糖为标准品,测得标准曲线为y=7.235 6x-0.012(R2=0.990 6)。花青素含量测定采用pH示差法[14]。总酚含量测定采用福林酚法[15],以没食子酸为标准品,测得标准曲线为y=0.101 4x+0.044 4(R2=0.999 4)。SOD酶活力按照SOD试剂盒中的方法进行测定。同时委托青海谱测检测有限公司对黑果枸杞酵素中大肠杆菌和沙门氏菌的含量进行测定。
1.2.3 高通量测序
将第0、10、20、30、40、50和60天取的样品委托生工生物工程(上海)股份有限公司进行基因组DNA提取、PCR扩增、凝胶电泳、上机测序及数据分析。将所有样本序列按照序列间的距离进行聚类后,根据97%相似性将序列分成不同的操作单元(operational taxonomic units, OTU),并进行生物信息统计分析。
1.2.3.1 DNA提取
分别取第0、10、20、30、40、50、60天样品,采用E.Z.N.ATMMag-Bind Soil DNA Kit试剂盒提取细菌基因组DNA和真菌基因组DNA,于-20 ℃保存备用。
1.2.3.2 PCR扩增
以341F(5’- CCTACGGGNGGCWGCAG-3’)/805(5’-GACTACHVGGGTATCTAATCC-3’)为引物扩增细菌16S rDNA V3-V4区序列;以ITS1F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)/ITS2R(5’- GCTGCGTTCTTCATCGATGC-3’)为引物扩增真菌ITS rDNA ITS1-2区序列。第一轮扩增:扩增体系: 2×Taqmaster Mix 15 μL,Bar-PCR primer F(10 μmol/L) 1 μL,Primer R (10 μmol/L) 1 μL,Genomic DNA 10~20 ng,加H2O 30 μL。反应条件:94 ℃预变性3 min,94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,5 个循环,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,20 个循环,72 ℃后延伸5 min,10 ℃保存。第二轮扩增:引入Illumina桥式PCR兼容引物,扩增体系: 2×Taqmaster Mix 15 μL,Primer F(10 μmol/L) 1 μL,Primer R (10 μmol/L) 1 μL,PCR产物(上一轮) 20 ng,加H2O 30 μL。反应条件:95 ℃预变性3 min,94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,5 个循环,72 ℃后延伸5 min,10 ℃保存。扩增产物用 1.0%的琼脂糖凝胶电泳检测是否扩增出目的条带,并对DNA进行纯化回收。
1.2.4 数据处理与分析
利用Excel 2007、R软件、SPSS Statistics 20.0等进行数据处理和分析。
2 结果与分析
2.1 黑果枸杞酵素中理化及活性成分测定结果
发酵前后黑果枸杞酵素中理化及活性成分测定结果如表1所示。

表1 黑果枸杞酵素发酵前后理化及活性成分含量变化Table 1 The changes of physicochemical and active ingredient contents of enzymes includingLycium Ruthenicum Murr. before and after fermentation
注:“-”表示未测。
由表1可以看出,黑果枸杞在60 d时,相关理化及活性成分发生了变化,可滴定酸含量增加了290.81%,总糖含量降低了62.91%,总酚含量增加了80.42%,SOD酶活力上升了5.90%。花青素保留率为42.49%,由于酵素中酸含量上升,花青素在酸性条件下会在一定程度上延缓花青素的降解且致病菌(大肠杆菌和沙门氏菌)未超标。从这些指标中可以看出,黑果枸杞酵素在发酵60 d后,除花青素有所损失,其他指标都呈现较好的水平,因此,可以判定黑果枸杞酵素在发酵60 d后拥有较高的质量水平。
2.2 黑果枸杞酵素自然发酵过程中微生物群落的Alpha多样性分析
Shannon指数和Simpson指数表示样品中微生物的多样性,Shannon值越大,Simpson值越小,说明群落多样性越高;ACE指数和Chao指数是用来估计物种总数,即群落的丰富度;Coverage指数表示各样本文库的覆盖率[16]。
2.2.1 黑果枸杞酵素自然发酵过程中细菌群落的Alpha多样性分析
对不同发酵阶段的黑果枸杞酵素的细菌群落进行多样性分析,结果见表2。

表2 黑果枸杞酵素自然发酵过程中细菌群落的Alpha多样性分析Table 2 Alpha diversity analysis of bacterial community during natural fermentation of enzymes including Lycium Ruthenicum Murr.
由表2可知, 0、10、20 d样品中细菌群落的多样性相对较高,30、40 d样品中细菌群落的多样性相对较低;0、20 d样品中细菌群落的丰富度相对较高,40、50 d样品中细菌群落的丰富度相对较低。结果表明,黑果枸杞酵素在发酵0~20 d中细菌群落多样性和丰富度相对较高。
2.2.2 黑果枸杞酵素自然发酵过程中真菌群落的Alpha多样性分析
对不同发酵阶段的黑果枸杞酵素的真菌群落进行多样性分析,结果见表3。

表3 黑果枸杞酵素自然发酵过程中真菌群落的Alpha多样性分析Table 3 Alpha diversity analysis of fungal community during natural fermentation of enzymes including Lycium Ruthenicum Murr.
由表3可知,30、40、50 d样品中真菌群落的多样性相对较高,0、60 d样品中真菌群落的多样性相对较低;30、40、50 d样品中真菌群落的丰富度相对较高,10、20 d样品中真菌群落的丰富度相对较低;结果表明黑果枸杞酵素在发酵30~50 d中真菌群落多样性和丰富度相对较高。
2.3 黑果枸杞酵素自然发酵过程中微生物群落结构组成分析
2.3.1 黑果枸杞酵素自然发酵过程中细菌群落结构组成分析
对不同发酵阶段黑果枸杞酵素中细菌群落结构进行门和属水平上的分析,结果见图1和图2。
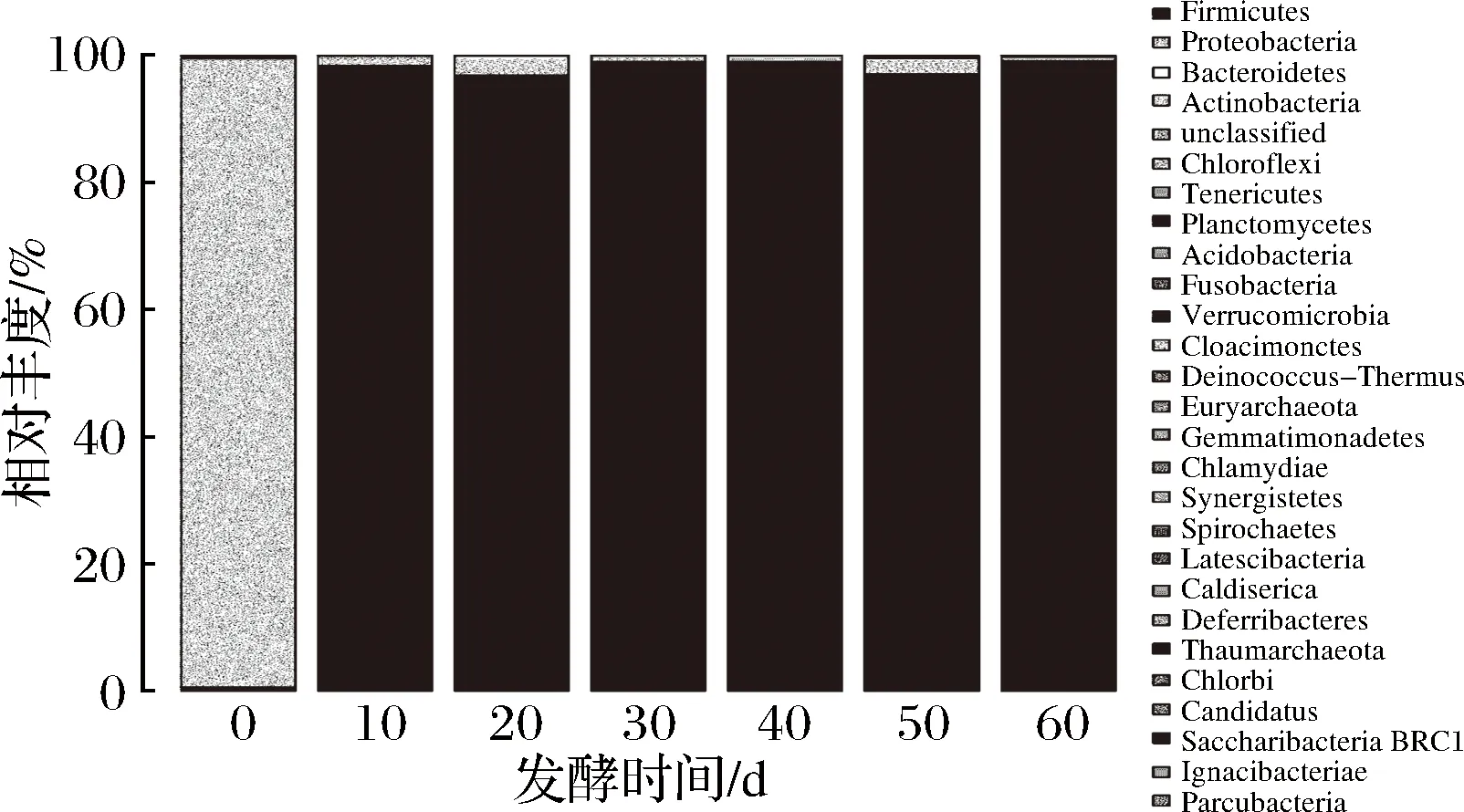
图1 黑果枸杞酵素自然发酵过程中细菌门水平分布图Fig.1 The histogram of bacteria during natural fermentation of enzymes including Lycium Ruthenicum Murr. in phylum
由图1可知,在门水平上,共检测出26种已知的细菌门,其中,0 d样品中主要为变形菌门(Proteobacteria),所占比例约为99%。在10、20、30、40、50、60 d样品中主要为厚壁菌门(Firmicutes),所占比例96.9%~99.1%。

图2 黑果枸杞酵素自然发酵过程中细菌属水平分布图Fig.2 The histogram of bacteria during natural fermentation of enzymes including Lycium Ruthenicum Murr. in genus
由图2可知,在属水平上,共检测出48种已知的细菌属。在0 d样品中主要为泛菌属(Pantoea)71.35%、假单胞菌属(Pseudomonas)14%、欧文氏菌属(Erwinia)6.61%。在10 d样品中主要为乳酸杆菌属(Lactobacillus)57.92%、乳球菌属(Lactococcus)14.23%、魏斯氏菌属(Weissella)12.08%、肠球菌属(Enterococcus)9.45%、片球菌属(Pediococcus)4.41%。在20 d样品中主要为乳酸杆菌属(Lactobacillus)77.28%、肠球菌属(Enterococcus)19.39%。在30 d样品中主要为乳酸杆菌属(Lactobacillus)96.26%、肠球菌属(Enterococcus)2.78%。在40 d样品中主要为乳酸杆菌属(Lactobacillus)96.8%、肠球菌属(Enterococcus)2.18%。在50 d样品中主要为乳酸杆菌属(Lactobacillus)96.8%、肠球菌属(Enterococcus)2.18%。在60 d样品中主要为乳酸杆菌属(Lactobacillus)95.1%、乳球菌属(Lactococcus)1.82%、片球菌属(Pediococcus)1.77%。以上结果说明未经发酵的原料汁中细菌主要为泛菌属(Pantoea)和假单胞菌属(Pseudomonas),在发酵第10 天时,酵素中乳酸杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、魏斯氏菌属(Weissella)和肠球菌属(Enterococcus)含量增加,在发酵第20天时,酵素中乳酸杆菌属(Lactobacillus)和肠球菌属(Enterococcus)含量增加,说明在发酵0~20 d时,酵素中细菌群落的丰富度与多样性相对较高,这也与Alpha多样性指数分析中结果一致。在发酵第30、40、50、60天时,酵素中细菌种类趋于稳定,主要优势菌属为乳酸杆菌属(Lactobacillus)。
2.3.2 黑果枸杞酵素自然发酵过程中真菌群落结构组成分析
对不同发酵阶段黑果枸杞酵素中真菌群落结构进行门和属水平上的分析,结果见图3和图4。
由图3可知,在门水平上,共检测出11种已知的真菌门,且相比于酵素中的细菌变化趋于稳定,真菌变化更为复杂。在0 d样品中真菌主要为子囊菌门(Ascomycota)49.75%,担子菌门(Basidiomycota)3.86%,无法归类的菌类占45.99%,说明在未经发酵前,原料中菌类非常复杂。在10 d样品中真菌主要为子囊菌门(Ascomycota)67.68%,担子菌门(Basidiomycota)18.16%,无法分类的菌类占12.54%;在20 d样品中真菌主要为子囊菌门(Ascomycota)84.22%,担子菌门(Basidiomycota)14.34%;在30 d样品中真菌主要为子囊菌门(Ascomycota)57.61%,担子菌门(Basidiomycota)38.04%;在40 d样品中真菌主要为担子菌门(Basidiomycota)56.1%,子囊菌门(Ascomycota)32.53%,无法归类的真菌5.35%;在50 d样品中真菌主要为担子菌门(Basidiomycota)39.37%,子囊菌门(Ascomycota)37.03%,被孢霉菌门(Mortierellomycota)3.22%,无法归类的真菌10.83%,无法分类的菌类占8.84%;在60 d样品中真菌主要为子囊菌门(Ascomycota)93.73%,担子菌门(Basidiomycota)4.85%。
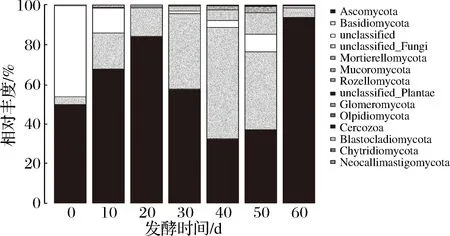
图3 黑果枸杞酵素自然发酵过程中真菌门水平分布图Fig.3 The histogram of fungi during natural fermentation of enzymes including Lycium Ruthenicum Murr. in phylum
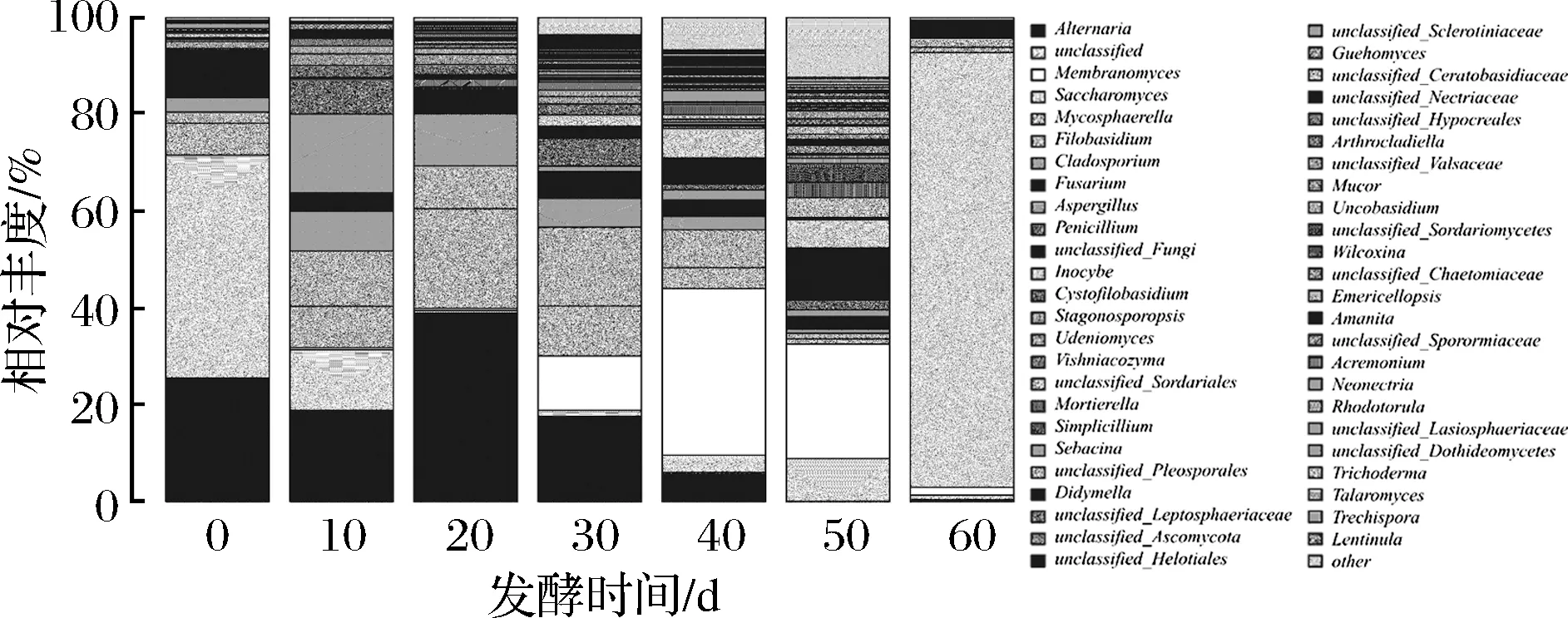
图4 黑果枸杞酵素自然发酵过程中真菌属水平分布图Fig.4 The histogram of fungi during natural fermentation of enzymes including Lycium Ruthenicum Murr. in genus
由图4可知,在属水平上,共检测出32种已知的真菌属。在0 d样品中真菌主要为链格孢属(Alternaria)25.52%,镰刀菌属(Fusarium)9.25%,球腔菌属(Mycosphaerella)6.62%,枝孢霉属(Cladosporium)3.02%,无法归类的菌类占45.99%;在10 d样品中真菌主要为链格孢属(Alternaria)18.84%,曲霉菌属(Aspergillus)16.33%,黑粉菌属(Filobasidium)11.44%,球腔菌属(Mycosphaerella)8.53%,青霉菌属(Penicillium)7.21%,镰刀菌属(Fusarium)3.7%,无法分类的菌类占12.54%;在20 d样品中真菌主要为链格孢属(Alternaria)38.97%,球腔菌属(Mycosphaerella)20.58%,枝孢霉属(Cladosporium)10.74%,Filobasidium8.87%,镰刀菌属(Fusarium)5.36%;在30 d样品中真菌主要为链格孢属(Alternaria)17.6%,Filobasidium16.3%,Membranomyces11.17%,球腔菌属(Mycosphaerella)10.32%,枝孢霉属(Cladosporium)5.96%,青霉菌属(Penicillium)5.77%,镰刀菌属(Fusarium)5.51%;在40 d样品中真菌主要为锁瑚菌属(Membranomyces)34.42%,黑粉菌属(Filobasidium)7.82%,丝盖伞属(Inocybe)6.12%,链格孢属(Alternaria)6.07%,球腔菌属(Mycosphaerella)4.3%,镰刀菌属(Fusarium)3.4%,枝孢霉属(Cladosporium)2.76%;在50 d样品中真菌主要为Membranomyces23.59%,Inocybe5.86%,拟青霉属(Simplicillium)3.82%,被孢霉属(Mortierella)3.22%,镰刀菌属(Fusarium)2.59%,青霉菌属(Penicillium)1.93%,无法归类的真菌10.83%,无法分类的菌类占8.84%;在60 d样品中真菌主要为酵母属(Saccharomyces)89.83%,黑粉菌属(Filobasidium)1.79%,锁瑚菌属(Membranomyces)1.61%,球腔菌属(Mycosphaerella)1.11%。在发酵过程中其主要作用的是链格孢属(Alternaria)、球腔菌属(Mycosphaerella)、黑粉菌属(Filobasidium)、锁瑚菌属(Membranomyces)、酵母属(Saccharomyces)等,在发酵60 d后,主要真菌为酵母属(Saccharomyces),且经分析主要为啤酒酵母(Saccharomycescerevisiae)。
2.4 黑果枸杞酵素自然发酵过程中微生物群落丰度热图分析
采用群落Heatmap图分析微生物物种和不同发酵阶段样品之间的交互关系,见图5和图6。
由图5可知,在细菌属水平上,30 d和40 d样品最为相似,0 d样品与10、20、30、40、50、60 d样品细菌结构差异明显,在0 d样品中,泛菌属(Pantoea)为优势菌属;在10、20、30、40、50、60 d样品中,乳酸杆菌属(Lactobacillus)为优势菌属。
由图6可知,在真菌属水平上,10、20与30 d样品较相似,40与50 d样品较相似,60 d样品与其他样品组之间真菌结构差异明显。在0 d样品中,无法归类的菌类较多,真菌的种类较复杂,其次为链格孢属(Alternaria);在10、20与30 d样品中,主要为链格孢属(Alternaria),球腔菌属(Mycosphaerella),Filobasidium,枝孢霉属(Cladosporium),青霉菌属(Penicillium),说明在发酵第10~30天,这几类真菌起主要作用,且动态变化此消彼长。在40 d与50 d样品中,真菌群落多样性和丰富度相对较高,锁瑚菌属(Membranomyces)为主要优势真菌属。在60 d样品中,真菌群落多样性和丰富度最低,酵母属(Saccharomyces)为优势真菌属。

图5 细菌属水平丰度热图Fig.5 The heatmap of bacteria in genus
2.5 黑果枸杞酵素自然发酵过程中微生物的主成分分析
对不同发酵阶段的黑果枸杞酵素中细菌和真菌在属水平上进行主成分分析,结果见图7和图8。
由图7可知,主成分1表示所有变量的88 %,主成分2表示所有变量的10%,总计贡献率达98 %。从PCA2方向看,0 d样品与10、20、30、40、50、60 d样品差异明显,从PCA1方向看,0,10,20 d与30、40、50、60 d样品差异明显,说明PCA1是导致样本间差异的主要因素。30、40、50、60 d样品在PCA1与PCA2方向距离较近,相对聚集,说明此发酵阶段,样品最为相似。

图6 真菌属水平丰度热图Fig.6 The heatmap of fungi in genus

图7 细菌属水平主成分分析Fig.7 The principal component analysis of bacteria in genus
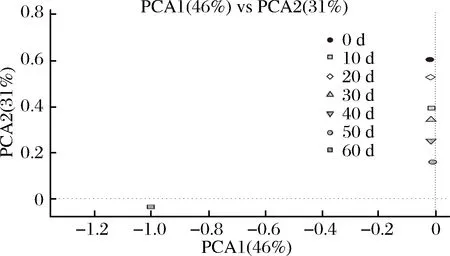
图8 真菌属水平主成分分析Fig.8 The principal component analysis of fungi in genus
由图8可知,主成分1表示所有变量的46%,主成分2表示所有变量的31%,总计贡献率达77%。从PCA1方向看,0 d样品与10、20、30、40、50、60 d样品差异明显,从PCA2方向看,各样品间距离分布差异明显,说明PCA2是导致样本间差异的主要因素。
3 讨论
有研究表明,在酵素中主要微生物为酵母菌、醋酸菌和乳酸菌,但有些酵素由于原料不同,可能不会有醋酸菌的大量生长繁殖[17-18]。通过高通量测序分析黑果枸杞酵素自然发酵过程中微生物的动态变化,样品中未检测到醋酸菌,而是酵母菌、乳酸菌和霉菌在发酵期间起主要作用,这也与OKADA等[19]研究结果一致。
由图2和图5可知,在未发酵前主要为泛菌属(Pantoea)、假单胞菌属(Pseudomonas)、欧文氏菌属(Erwinia),但在发酵后,这3种菌属含量急剧减少,可能与发酵过程中产酸、碳源和氮源消耗较快、pH变化等有关[20]。在发酵中后期,乳酸杆菌属(Lactobacillus)起主要作用,成为优势菌属,且肠球菌属(Enterococcus)也占有一定比例,可能与其耐酸性强和发酵碳水化合物广泛等有关,也有可能是由于乳酸杆菌属(Lactobacillus)具有的胞外多糖和分泌的细菌素保护了自身生长繁殖,抑制或破坏了杂菌生长[21]。
由表3和图4可知,真菌动态变化在酵素发酵过程中更为复杂,在发酵30~50 d真菌群落多样性和丰富度相对较高。发酵前期和中期真菌多样性和丰富度相对较高,随着发酵时间延长,代谢产物增多,微生物之间竞争愈发激烈,一些在酵素体系中适应能力相对较弱的真菌被淘汰[22],适应能力强的真菌在后期发挥主要作用,在发酵60 d后,主要优势真菌属为酵母属(Saccharomyces),且经分析主要为啤酒酵母(Saccharomycescerevisiae)。
由于酵素近年来的火热程度,目前,国内外对于酵素中代谢产物的变化分析相对较多[23-25],而关于采用高通量测序技术对酵素发酵过程中微生物的动态变化进行的研究报道相对较少。基于Illumina MiSeq高通量测序技术对不同发酵阶段的黑果枸杞酵素微生物的群落组成及多样性进行分析,将为今后黑果枸杞酵素产品开发中菌种的调控提供理论依据,具有重大意义。
4 结论
黑果枸杞酵素在发酵0~20 d细菌群落多样性和丰富度相对较高,在发酵30~50 d真菌群落多样性和丰富度相对较高。在未发酵前,主要细菌为泛菌属(Pantoea),而真菌的种类较为复杂,无法归类的真菌较多,已知真菌中链格孢属(Alternaria)占比较大。在自然发酵过程中主要优势细菌为乳酸杆菌属(Lactobacillus),主要优势真菌为子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。在发酵60 d后,主要细菌为乳酸杆菌属(Lactobacillus),主要真菌为酵母属(Saccharomyces)。研究成果揭示了黑果枸杞酵素发酵中微生物群落结构的变化,为发酵过程中微生物菌群的调控提供了方向,以期能开发出高附加值的黑果枸杞功能性食品。
