褐色嗜热裂孢菌脱色过氧化物酶的表达及发酵条件优化
2019-07-24朱竹兵孙亚武唐蕾
朱竹兵,孙亚武,唐蕾,*
1 (工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)2 (江南大学 生物工程学院,江苏 无锡,214122)
染料脱色过氧化物酶(DyPs)是一类具有降解多种染料能力的酶类,首次发现于真菌ThanatephoruscucumerisDec 1中[1],属于胞内蛋白[2]。1999年,研究者将其分离纯化,分析其特征发现,在407 nm处有1个Soret吸收峰,以及它的Na2S2O4还原形式在556 nm有1个吸收峰,表明血红素组分的存在[3]。深入研究发现, DyPs是血红素过氧化物酶家族中区别于传统血红素过氧化物酶的新型家族,例如,DyPs在二级结构上具有多个α-螺旋和β折叠,其他类型血红素过氧化物酶缺少β折叠[4];DyPs有特定结构Fe-His-Asp,而血红素过氧化物酶有Fe-His-His三联体的保守氨基酸[5-7]。
DyPs的特点是利用过氧化氢作为电子受体催化各种有机物,包括蒽醌染料[8]、酚类底物、藜芦醇[9]、愈创木酚[10]、木质素及木质素模型化合物[11],尤其对蒽醌类染料活性最高,因而具有潜在的应用价值,可以实现生物法对染料污水的彻底降解,从而避免化学、物理等方法降解的2次污染问题。目前,人们主要从脱色过氧化物酶的底物特异性、多样性、晶体结构、分类、定点突变、催化机理等[5,12-15]方面展开研究,不仅提高了DyPs的稳定性和表达效率,而且实现了脱色过氧化物酶对底物的有效催化。但是在细菌中异源表达DyPs时,重组蛋白的含量偏低,一般在10 mg/L以下。最近的研究发现,TfuDyP与修饰蛋白(SUMO)[16]融合表达,大肠杆菌中重组蛋白量可增至约200 mg/L,然而高度过表达的SUMO-TfuDyP几乎没有活性。通过紫外-可见吸收光谱法和高分辨率质谱法对酶的分析表明大部分高度过表达的酶只包含有铁缺乏的血红素前体原卟啉IX(PPIX)而不是血红素[17]。血红素作为脱色过氧化物酶的辅基,其胞内合成量对DyPs催化活性起着至关重要的作用,如何在提高DyPs表达量的同时,提高其辅基血红素的含量尚待深入研究。
本文以来源于褐色嗜热裂孢菌(Thermobifidafusca)的TfuDyP为研究对象。以pET28a(+)为载体,在大肠杆菌中异源表达TfuDyP。一方面通过诱导剂浓度、诱导时间、诱导温度优化,获得重组蛋白TfuDyP最佳表达条件。另一方面研究了外源添加剂对重组TfuDyP中血红素饱和度影响,以期更好地提高辅基血红素合成,从而提高目的蛋白的催化活性。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株
宿主菌E.coliBL21由实验室保藏,含有目的基因的表达质粒pET-28a(+)购于南京金斯瑞生物科技有限公司。
1.1.2 培养基
LB液体培养基:酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH 7.0。
LB固体培养基:在LB液体培养基中加入2%琼脂。
1.1.3 主要试剂
SuperBradford蛋白定量试剂盒,康为世纪生物科技有限公司;活性蓝19,上海一基实业有限公司;菌株构建所用的质粒提取试剂盒,购自TaKaRa(大连); 5-氨基乙酰丙酸,购自梯希爱化成工业发展有限公司。
1.1.4 仪器设备
冷冻离心机,日本日立公司; SM-5600细胞超声破碎仪,美国cole-parmer; AKTA AVANT25,美国GE公司; Enspire酶标仪,美国珀金埃尔默有限公司;紫外可见分光光计,日本日立株式会社。
1.2 方法
1.2.1 TfuDyP在大肠杆菌中的构建
利用National Center for Biotechnology Information (NCBI)数据库获得TfuDyP(accession number Q47KB1)全长核酸序列,合成目的基因,以已购的质粒pET-28a(+)为载体,将含有目的基因的质粒转化到E.coliBL21进行异源表达,重组质粒如图1所示。
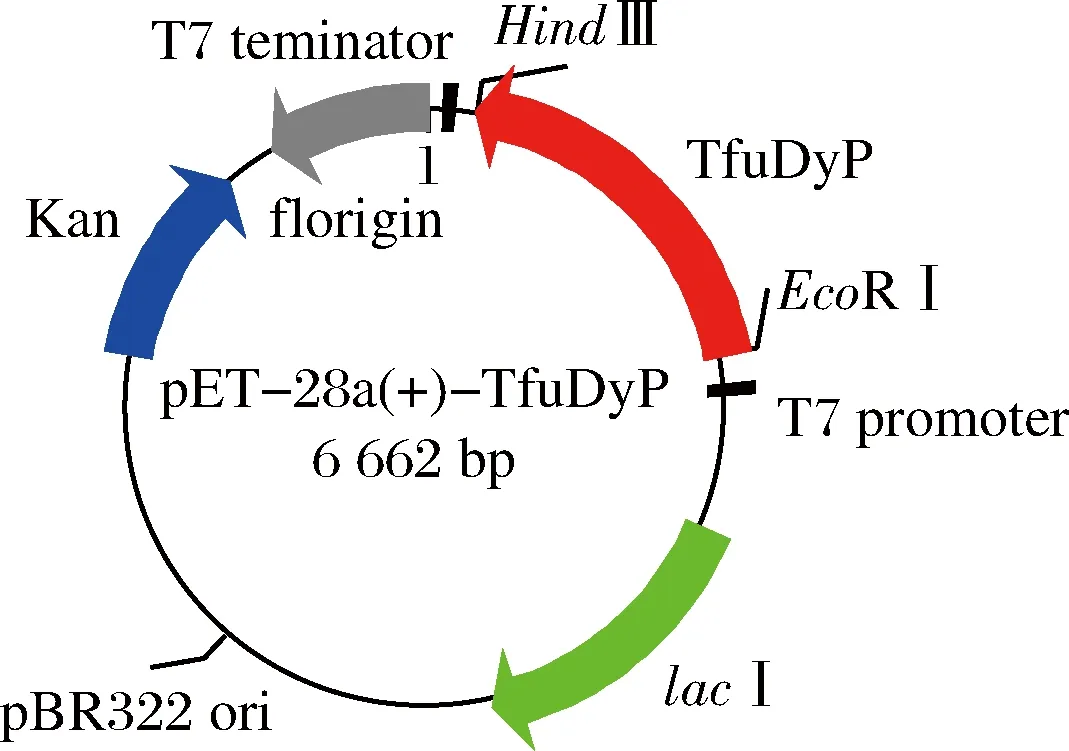
图1 重组质粒pET28a(+)-TfuDyP示意图Fig.1 Schematic representation of recombinant plasmid pET28a(+)-TfuDyP
1.2.2 重组TfuDyP分离纯化
将重组菌株接种到含有100 mg/L卡那霉素的LB培养基中,200 r/min、37 ℃培养12 h,以4%(V/V)接种量转接至含有100 mL新鲜培养基的500 mL摇瓶中,相同条件培养至菌体OD600达到0.6~0.8时。向培养基中添加终浓度为0.5 mmol/L异丙基-β-D-硫代半乳糖吡喃苷(isopropyl β-D-thiogalactopyranoside, IPTG),30 ℃诱导12 h,8 000 r/min离心20 min得到菌体,用 50 mmol/L的pH 7.4磷酸钾缓冲溶液重新悬浮细胞,超声破碎30 min,10 000 r/min离心30 min收集上清液,过0.22 μm水系滤膜得到粗酶液,通过1 mL His TrapTMHP亲和镍柱分离纯化,收集目的蛋白,进行SDS-PAGE电泳以鉴定重组TfuDyP纯度。
1.2.3 酶活力及蛋白浓度的测定
向反应体系中依次加入100 mmol/L醋酸钠缓冲溶液(pH 4.5),100 μmol/L活性蓝19和适量的酶液,最后加入终浓度为0.1 mmol/L过氧化氢启动反应,酶促反应10 min,然后通过加入200 μL 2% SDS终止反应。在室温下,于波长595 nm处检测吸光值变化[17]。蛋白质浓度测定采用BCA法,以牛血清蛋白为标准蛋白。
TfuDyP酶活定义:在25 ℃,pH 4.5条件下,每分钟氧化1 μmol活性蓝19所需的酶量为1 U。比酶活测定如式(1):

(1)
式中:比酶活单位U/mg;酶活单位U/mL;蛋白质量浓度,mg/mL。
1.2.4 重组TfuDyP的表达条件优化
表达条件优化:向培养基中添加终浓度为0.1、0.2、0.3、0.4、0.5 mmol/L的IPTG,诱导时间为8、10、12、14、16 h,诱导温度为16、23、30、37 ℃,8 000 r/min离心20 min得到菌体,用 50 mmol/L的pH 7.4磷酸缓冲溶液重新悬浮细胞,超声破碎30 min,10 000 r/min离心30 min收集上清液,分离纯化,测定蛋白浓度,计算比酶活。
1.2.5 外源添加物对重组TfuDyP表达的影响
1.2.5.1 氨基酸与金属离子对重组TfuDyP表达及酶活性的影响
向培养基中分别添加终浓度为100 μmol/L的组氨酸(His)、谷氨酸(Glu)、FeCl2、CoCl2以及MnCl2;分别添加终浓度为0、40、60、80、100、120 μmol/L的FeCl2;在最佳表达条件下培养、收集菌体、破碎、离心、收集上清液过0.22 μm水系滤膜得到粗酶液,测定菌体生长量和计算酶活。
1.2.5.2 氯高铁血红素和5-氨基乙酰丙酸浓度对重组TfuDyP表达及酶活性的影响
向培养基中分别添加终浓度为0、12、16、20、24 μmol/L的氯高铁血红素;分别添加终浓度为0、100、150、200、300、400、500 μmol/L的5-氨基乙酰丙酸(5-ALA)。在最佳表达条件下培养,测定菌体生长量和计算酶活。
1.2.6 外源添加物对重组TfuDyP中血红素饱和度的影响
分别将100 μmol/L的5-ALA、氨基酸(Glu)、金属离子(Fe2+、Mn2+、Co2+)、氨基酸与铁组合(Glu+Fe2+)加入培养基中,最佳表达条件下培养,收集菌体离心、悬浮、破碎、离心,收集上清液过0.22 μm水系滤膜得到粗酶液,通过1 mL His TrapTMHP亲和镍柱分离纯化,用10个柱体积的洗脱缓冲液进行线性洗脱,对目的蛋白进行全波长扫描和比酶活的计算。
血红素饱和度定义为在408 nm处的吸光值与280 nm处之比,即A408/A280。
2 结果与分析
2.1 TfuDyP在大肠杆菌中的异源表达
2.1.1 TfuDyP的表达与纯化
将含有全长1 293 bp的目的基因的pET28a(+)-TfuDyP和空载pET28a(+)质粒分别转化至E.coliBL21中进行异源表达。收集菌体、破碎、离心、分离纯化,将粗酶液和纯化后蛋白进行SDS-PAGE电泳确定目的蛋白表达情况。结果如图2,有明显的目的蛋白条带,分子质量约为46 kDa,与理论计算值一致。将目标条带割胶回收,进行MALDI-TOF质谱分析[18],检测数据库为SwissProt 201704 (554241 sequences; 198410167 residues),与库中理论质量为45 957 Da的dye-decolorizing peroxidase Tfu_3078 OS=Thermobifidafusca匹配,匹配分数为432(表1),确定重组TfuDyP在E.coliBL21成功表达。

1-纯化的TfuDyP;2-Marker;3-空载pET-28a;4-不加IPTG诱导剂;5-IPTG诱导表达图2 重组蛋白TfuDyP表达SDS-PAGE电泳分析图Fig.2 The SDS-PAGE electrophoresis for recombinant TfuDyP expression
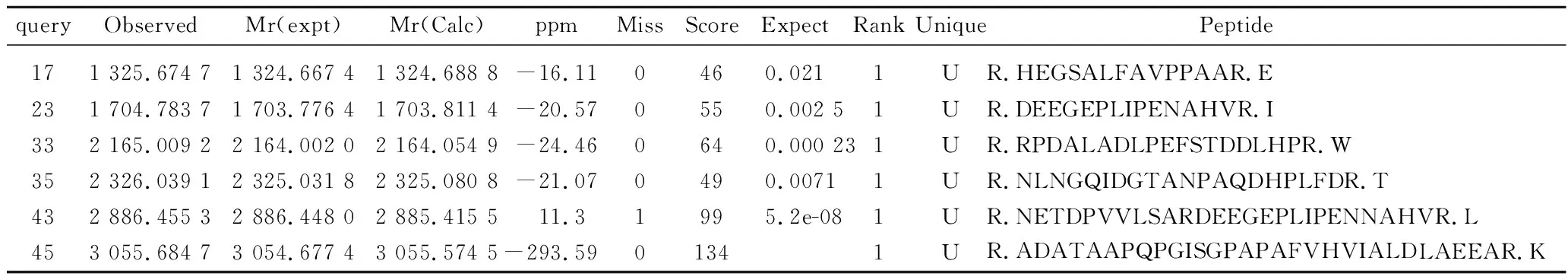
表1 重组蛋白TfuDyP的飞行时间质谱分析Table 1 Time-of-flight mass spectrometry analysis of recombinant TfuDyP
注:DYP THEFY; MASS:45957; Score:432; Matches:6(5); Sequences:6(6) Dye-decolorizing peroxidase Tfu_3078 OS=Thermobifidafusca(strain YX) GN=Tfu_3078 PE=1 SV=1。
2.1.2 重组TfuDyP诱导条件优化
在新生肽链的聚集速率高于蛋白折叠速率的情况下,容易出现不可溶性蛋白。因此,如何降低重组蛋白合成的速率就显得尤为关键,通常采用的方法为降低培养温度和使用低浓度的诱导剂。低温下重组蛋白的合成速率降低,新合成的蛋白就拥有更多的时间进行折叠。此外,降低培养温度也可以减少重组蛋白被宿主降解的量,提升重组蛋白的稳定性[19]。因此,本实验对影响酶表达水平的关键因素即诱导剂浓度、诱导时间和诱导温度进行了研究。
结果表明,当IPTG浓度为0.3 mmol/L时,重组TfuDyP的比酶活达到最大值21.3 U/g,随着诱导剂浓度增加,比酶活缓慢下降(图3-a)。在诱导时间为14 h时,比酶活达到最高值24 U/g,而在低于14 h的情况下,比酶活随着诱导时间的增加明显升高,诱导时间高于14 h时,比酶活反而下降(图3-b)。当诱导温度为30 ℃时,比酶活最高值27.9 U/g,接近16 ℃时的2倍,可以看出温度对酶活影响较大(图3-c)。温度较低(16 ℃)时,菌体的繁殖受阻,活性蛋白合成量低,酶活较低。温度过高(37 ℃),重组TfuDyP的表达水平提高,但是高温时重组TfuDyP的合成速率高于蛋白的折叠速率,容易形成不可溶性蛋白,导致酶活降低。综上所述最佳表达条件为IPTG浓度0.3 mmol/L,诱导时间14 h,诱导温度30 ℃。

图3 重组蛋白TfuDyP表达条件优化Fig.3 Optimization of expression conditions of recombinant TfuDyP
2.2 外源添加物对重组TfuDyP表达及酶活性的影响
DyPs是血红素过氧化物酶家族中的一种,重组TfuDyP必须与辅基血红素结合,才能实现对底物的催化活性。环境因素对重组TfuDyP表达和血红素合成起着关键作用,例如,Fe2+、血红素前体 5-ALA以及氯高铁血红素通常作为添加物以促进血红素合成[20-22];谷氨酸参与TfuDyP的组成和提供血红素合成的前体[23];Mn2+是代谢途径中许多酶类的激活剂。本实验选取几种外源添加剂(Glu、His、Fe2+、Mn2+、Co2+、氯高铁血红素、5-ALA),在上述最佳表达条件下,研究其对重组TfuDyP酶活的影响。
2.2.1 氨基酸与金属离子对重组TfuDyP表达及酶活性的影响
向培养基中分别添加终浓度为100 μmol/L的His、Glu以及FeCl2、CoCl2、MnCl2,其中不添加任何添加剂为对照组,考察氨基酸和金属离子对重组TfuDyP酶活和菌体生长的影响。结果如图4-a所示,CoCl2对重组TfuDyP酶活有一定抑制作用,添加His对重组TfuDyP酶活和菌体的生长基本保持不变,外源添加FeCl2、MnCl2和Glu都能提高重组TfuDyP酶活和菌体生长量。从中可以看出FeCl2对酶活影响最明显,因此,进一步探究了FeCl2浓度对重组TfuDyP表达及酶活性的影响。结果表明随着FeCl2浓度增加,酶活和菌体量呈现增长趋势,提高浓度为80 μmol/L时,酶活达到最大值31.31 U/L,较空白对照提高近67.6%(图4-b)。然而当Fe2+浓度高于60 μmol/L,菌体量逐渐下降。
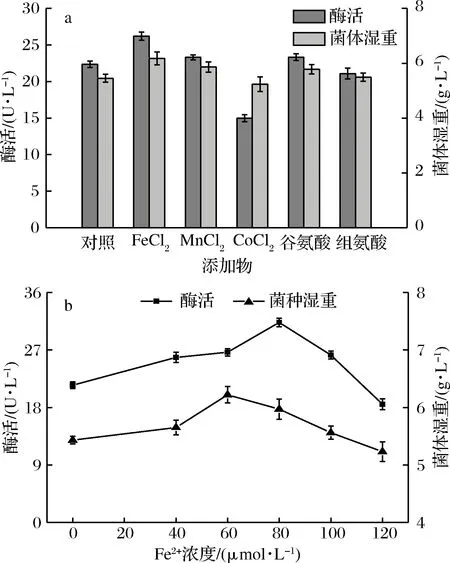
图4 金属离子和氨基酸对重组TfuDyP酶活和菌体生长影响Fig.4 Effect of metal ions and amino acids on recombinant TfuDyP activity and cell growth
2.2.2 氯高铁血红素和5-ALA浓度对重组TfuDyP表达及酶活性的影响
实验结果显示,当氯高铁血红素浓度达到16 μmol/L和18 μmol/L时,重组TfuDyP酶活和菌体湿重分别达到最大值44.95 U/L和6.05 g/L,低浓度的氯高铁血红素对重组TfuDyP酶活和菌体量具有明显的促进作用。当氯高铁血红素浓度大于18 μmol/L时,对菌体生长有明显的抑制作用(图5-a)。
图5-b为5-ALA浓度对重组TfuDyP酶活和菌体生长的影响。当外源添加的5-ALA浓度低于400 μmol/L时,酶活与其添加量呈现出高度线性正相关,当浓度为400 μmol/L酶活达到最大值65 U/L,大约是对照组的3倍。当5-ALA浓度达低于200 μmol/L时,菌体量与5-ALA浓度呈线性增长。
本实验在最佳表达条件下,研究了添加剂种类和浓度对重组TfuDyP表达及酶活性的影响。适量浓度的Glu、Fe2+、Mn2+、氯高铁血红素和5-ALA,一方面提高了菌体生长量,另一方面促进了重组TfuDyP催化活性。而钴离子抑制了重组TfuDyP酶活。实验结果表明,添加剂对重组TfuDyP酶活性影响存在差异:5-ALA>氯高铁血红素> Fe2+> Glu > Mn2+>对照组> Co2+。

图5 氯高铁血红素和5-ALA对重组TfuDyP酶活和菌体生长影响Fig.5 Effect of hemin and 5-ALA on recombinant TfuDyP activity and cell growth
2.3 外源添加物对重组TfuDyP中血红素饱和度和酶活性的影响
从2.2研究结果中可以看出,5-ALA等外源添加剂对重组TfuDyP催化活性产生一定影响,为了探究外源添加剂对重组TfuDyP酶活的影响与血红素的关系,向培养基中分别添加终浓度为100 μmol/L的5-ALA、Glu、Fe2+、Mn2+、Co2+、Fe2++ Glu,其中不添加任何添加剂为对照组,在最佳表达条件下诱导表达,对纯化目的蛋白进行全波长扫描。
2.3.1 外源添加剂对重组TfuDyP中血红素饱和度的影响
波长408 nm为血红素的特征吸收,全波长扫描显示添加了5-ALA、Fe2+、Glu、Mn2+、Co2+的408 nm处的吸收值分别为1.378、0.89、0.741、0.579、0.51(图6)。结果表明,除了Co2+,添加剂(5-ALA、Fe2+、Glu、Mn2+)明显高于对照组。
添加Glu + Fe2+、Fe2+、Glu和对照组在波长408 nm处的吸收值分别为1.027、0.89、0.741、0.579(图7),表明氨基酸与Fe2+的组合可进一步提高重组TfuDyP中血红素的含量。
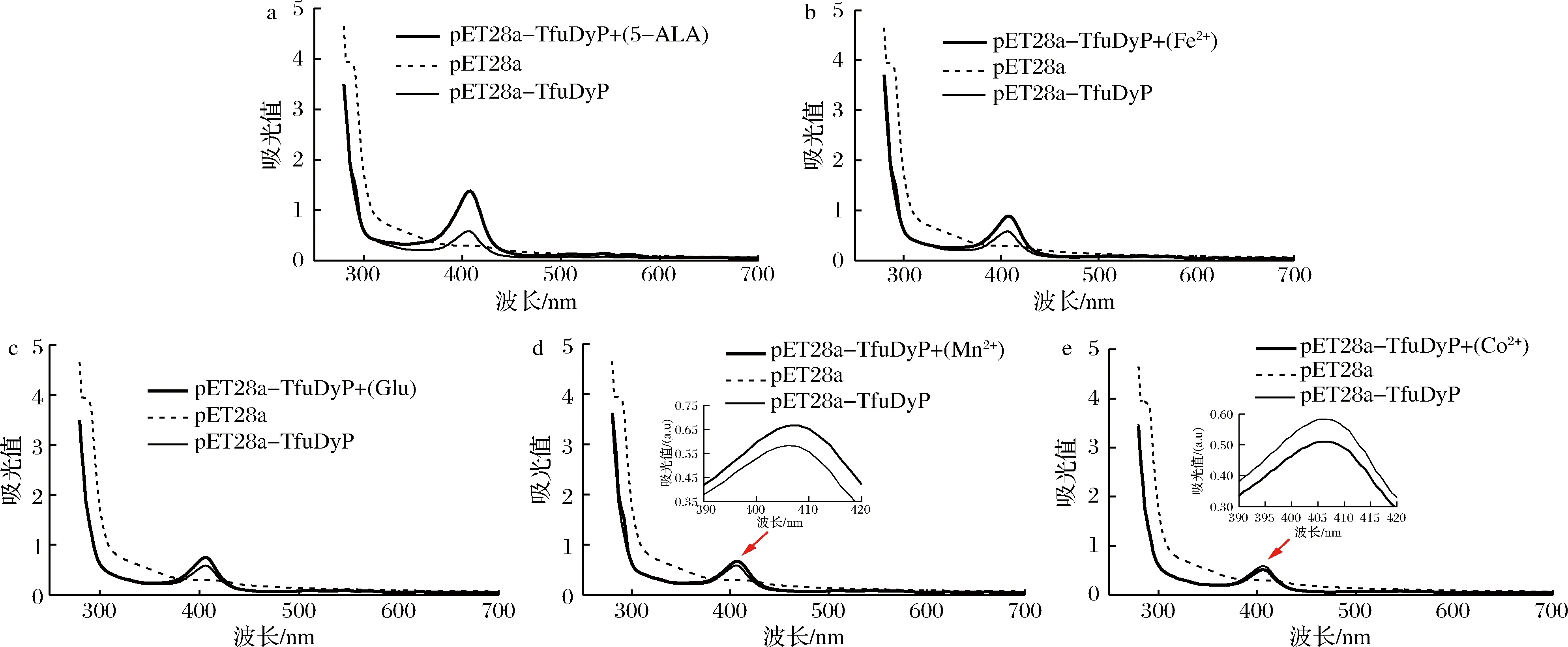
图6 添加剂对重组TfuDyP中血红素饱和度的影响Fig.6 Effect of different amino acids on heme saturation in recombinant TfuDyP
综上所述,重组TfuDyP在波长408 nm处的吸收值:5-ALA>Fe2+>Glu>Mn2+>对照组>Co2+,与添加剂对重组TfuDyP酶活的影响结果是一致的。氨基酸与Fe2+的组合能够进一步促进血红素合成,但远不及5-ALA的添加,氨基酸与Fe2+的添加不是简单的叠加效应,对血红素合成可能是复杂的协同作用。
2.3.2 重组TfuDyP中血红素饱和度和酶活的关系
为了探究重组TfuDyP酶活和血红素饱和度两者之间的关系,将各种添加剂以终浓度为100 μmol/L添加到培养基中,在最佳表达条件下诱导表达,对纯化的目的蛋白进行全波长扫描和比酶活的计算。
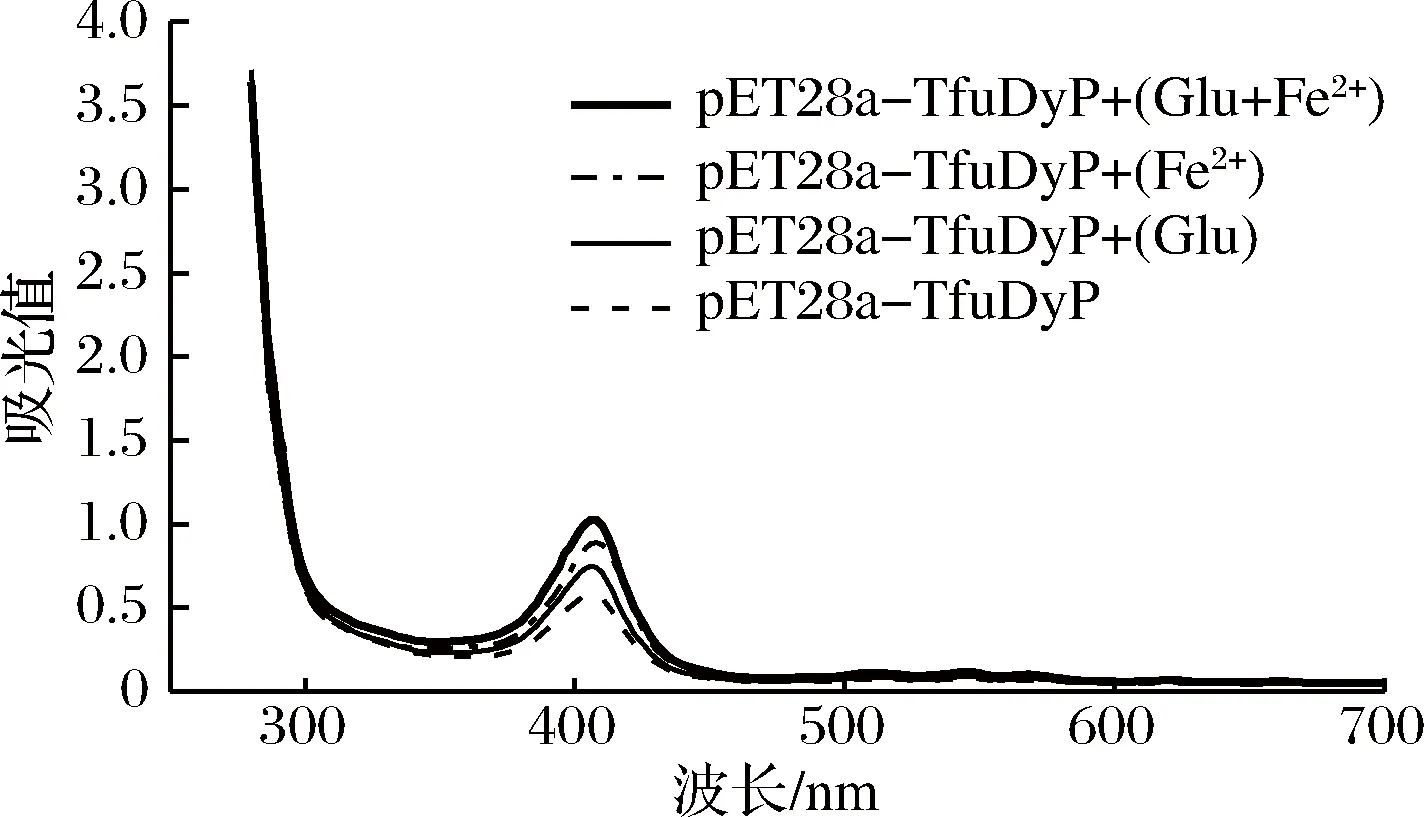
图7 铁离子和氨基酸对重组TfuDyP中的血红素饱和度的影响Fig.7 Effect of iron ions and amino acids on heme saturation in recombinant TfuDyP
实验结果表明,Glu、5-ALA、Fe2+、Glu +Fe2+能够提高重组TfuDyP中血红素饱和度,Co2+对Heme饱和度具有抑制作用(表2)。选取几种外源添加剂(Co2+、Glu+Fe2+、5-ALA),考察重组TfuDyP中血红素饱和度与比酶活关系。实验结果显示,添加剂对重组TfuDyP中血红素饱和度的影响和比酶活的影响呈正相关性(图8)。
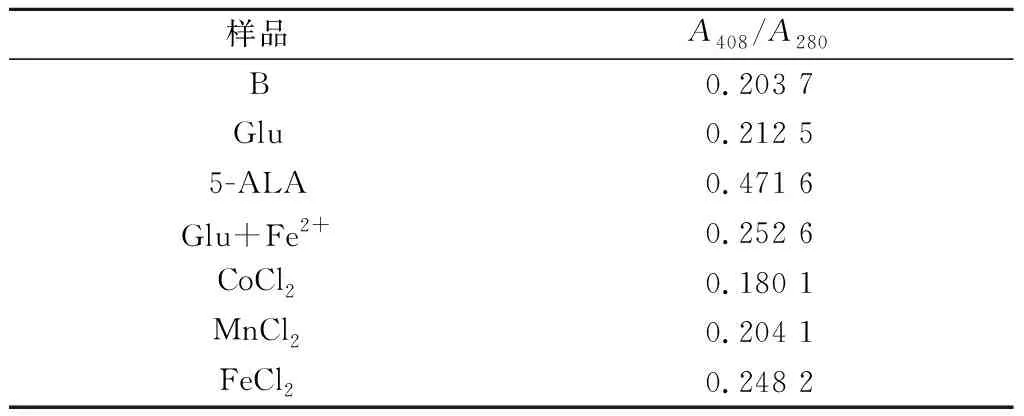
表2 不同外源添加剂对重组TfuDyP中Heme饱和度的影响Table 2 Effect of different exogenous additives on heme saturation in recombinant TfuDyP
注:B-不加任何添加剂的对照组;其他外源添加剂最终浓度0.1 mmol/L。

图8 添加剂对酶活与heme饱和度影响关系图Fig.8 Effect of different additives on enzyme activity and heme saturation
血红素辅基掺入脱辅基重组蛋白被认为对于全蛋白的可溶性和活性至关重要,提高血红素及其前体物质5-ALA的水平是目前使用的最主要策略[24],KERY等[25]发现5-ALA的添加提高了在大肠杆菌中表达的人源胱硫醚β-合成酶的血红素饱和度和产率,与本文一致;但是也有报道指出,5-ALA的添加对目标重组血红素过氧化物酶的活性没有显著影响[19,28],与本研究的结果不同。而Co2+、Glu+Fe2+对血红素饱和度及TfuDyP的比酶活关系的影响未见报道。
3 结论
脱色过氧化物酶是血红素过氧化物酶家族中的新家族,以血红素为辅基,过氧化氢为电子受体,催化各种有机物。本课题以来源于T.fusca的DyP型过氧化物酶(TfuDyP)为研究对象,以pET28a(+)为载体,在大肠杆菌中异源表达脱色过氧化物酶TfuDyP,一方面优化重组TfuDyP表达条件(诱导剂浓度、诱导时间和诱导温度),另一方面研究了添加剂对重组TfuDyP酶活和血红素饱和度影响,得出如下结论:
诱导剂浓度为0.3 mmol/L,诱导时间为14 h,诱导温度30 ℃,胞内比酶活达到27.9 U/g,是重组蛋白TfuDyP最佳表达条件。优化培养基成分,发现氯高铁血红素、5-ALA、Glu、Fe2+、Mn2+能提高重组TfuDyP催化活性,尤其是氯高铁血红素、5-ALA、Fe2+。在研究外源添加剂对血红素饱和度影响过程中发现,在血红素最大吸收波长408 nm处的吸收值:5-ALA>Glu + Fe2+>Fe2+>Glu>Mn2+>对照组>Co2+,与添加剂(5-ALA、氯高铁血红素、Glu、Fe2+、Mn2+)对重组TfuDyP酶活影响结果是一致的,即添加剂是通过影响血红素合成来影响重组TfuDyP催化活性,添加剂对血红素饱和度影响与对比酶活影响成正相关性。DyPs作为一种新型过氧化物酶,在染料降解等领域具有潜在价值,如何提高重组DyPs的活性和产率成为其是否能实现工业应用的关键。通常采用的血红素前体添加物如5-ALA价格较贵[19],而且不总是能够达到提高酶活的效果[13, 21]。本文通过研究外源添加物对血红素饱和度和酶活性的关系,寻找最佳的添加剂量和廉价的添加物如谷氨酸复合铁,可为工业发酵提供理论基础。
