橄榄苦苷对H2O2诱导的PC12氧化应激损伤的保护作用
2019-07-24李文杰李静
李文杰,李静
(1.郑州人民医院,河南 郑州 450003; 2.黄河中心医院,河南 郑州 450003)
缺血性脑血管病脑在缺血后再恢复血氧供应时往往伴随着缺血后的再灌注(I/R)损伤,导致进一步的神经功能障碍。I/R损伤时病理生理机制复杂,其中由于氧化应激及氧自由基损伤最终引起细胞凋亡在脑缺血疾病的发生发展中起到非常重要的作用[1]。因此探索具有抗氧化作用的化合物具有重要的现实意义。橄榄苦苷是油橄榄树主要成分,是一种无毒的裂环烯醚萜苷类化合物。目前,人们对橄榄苦苷的药理作用及临床应用进行了广泛的研究,文献表明橄榄苦苷具有肾脏/心脏保护作用、抗癌、保肝及抗阿尔茨海默病等药理活性[2]。此外橄榄苦苷还具有一定的抗炎[3]、抗氧化能力[4]。但对橄榄苦苷在脑缺血再灌注损伤保护作用研究尚少,特别是分子水平的作用机制尚不完全清楚。本研究拟以H2O2诱导的PC12细胞为模型,探索橄榄苦苷对氧化应激损伤的保护作用及作用机制。
1 材料与方法
1.1 试剂与设备
橄榄苦苷(Funakoshi,日本);四甲基偶氮唑蓝(MTT)、H2O2、二甲基亚砜(DMSO)、SOD及GSH-PX ELISA Kit(武汉默沙克生物科技有限公司);RPMI-1640培养液及FBS(GIBCO);0.25%胰蛋白酶、蛋白提取试剂盒、Bradford蛋白定量试剂盒TUNEL试剂盒(南京建成生物工程研究所);Cyt-c、 Caspase-3鼠抗人单克隆抗体和β-Actin(美国Santa Cruz公司);细胞培养箱(德国);高速低温离心机(德国HERMLE公司);酶标仪(中国Motic)。
1.2 细胞培养
大鼠肾上腺嗜铬细胞瘤细胞株PC12细胞购自中科院上海细胞库,接种于含10%FBS、10万U/L青霉素、100 mg/L链霉素的 RPMI-1640培养液中,37℃、5%CO2条件下培养。按常规方法消化、传代,取对数期细胞为实验对象。
1.3 MTT法检测橄榄苦苷对H2O2诱导的PC12细胞活力的影响
细胞分为空白对照组、模型组、橄榄苦苷组。对数期的PC12细胞铺96孔细胞培养板7 000个/孔,37 ℃、5% CO2孵育箱孵育培养24 h,弃旧培养液,加入含200 μmol/L H2O2的新鲜培养液培养6 h,弃培养液,给予新鲜培养液培养24 h。药物组给予含10、50、100、200 μmol/L橄榄苦苷的新鲜培养液,模型组给予空白新鲜培养液,空白对照组除不给予H2O2预处理及不加入药物外,其他处理同上。每组重复6次。继续培养24、48、72 h。加入MTT(5 mg/mL)溶液20 μL/孔,孵育箱继续孵育4 h,弃去旧培养液,加入DMSO溶液100 μL/孔,遮光振摇10 min,充分溶解甲臢。利用酶标仪在490 nm处检测各孔的OD值。药物设定浓度参考文献[5]。
1.4 TUNEL法检测橄榄苦苷对H2O2诱导的PC12细胞凋亡率的影响
细胞分组及预处理参照“1.3项”。药物组分别加入含50、100、200 μmol/L橄榄苦苷的新鲜培养液,模型组及空白对照组处理参照“1.3项”。每组重复6次。继续培养24、48、72 h,弃培养液,0.25%胰酶消化细胞,转移至EP管,离心,弃上清,4%多聚甲醛固定PC12细胞,放置于摇床上振动0.5~1 h。加入用含0.1% Triton X-100的PBS制成细胞悬液,冰上孵育5 min,采用流式细胞术技术,根据TUNEL试剂盒说明书检测细胞凋亡率。
1.5 ELISA法检测橄榄苦苷对H2O2诱导的PC12细胞内SOD及GSH-PX活力的影响
细胞分组及预处理参照“1.3项”。药物组分别加入含50、100、200 μmol/L橄榄苦苷的新鲜培养液,模型组及空白对照组处理参照“1.3项”。 每组重复6次。各组细胞孵育48 h,倾去旧培养基,0.25%胰酶消化细胞,转移至EP管,加入裂解液裂解细胞,离心,取上清作为待测样品。以上操作均在冰浴下进行,防止蛋白降解。SOD的活力(U/mg protein)和GSH-PX的活性( mU/mg protein)根据SOD及GSH-PX ELISA Kit 说明书进行操作。
1.6 Westing blot法检测Caspase-3、Cyt-C表达
细胞分组及预处理参照“1.3项”。取对数生长期PC12细胞接种于培养瓶中,37℃、5% CO2条件下孵育。药物组分别加入含50、100、200 μmol/L橄榄苦苷的新鲜培养液,模型组及空白对照组处理参照“1.3项”。 每组重复6次。各组细胞孵育48 h。收获细胞,加入适量含蛋白酶抑制剂的细胞裂解液,冰浴裂解25 min,收集细胞,低温高速离心25 min(4℃,25 000 r/min),吸取上清转贮至专用EP管,-20℃冰箱保存备用。至于100℃热水变性10 min,蛋白浓度利用Bradford法来测定。制备10% SDS-PAGE ,电泳分离蛋白,电转至PVDF膜,TBST洗涤PVDF膜3次,10 min/次,置于5%脱脂奶粉溶液中,4℃封闭2 h,一抗Cyt-C、Caspase-3抗体1∶1 000稀释,4℃过夜,二抗(1∶1 000稀释)孵育2 h,ECL法显色,采用凝胶成像系统进行图像量化分析。
1.7 统计学处理。
2 结果
2.1 MTT法检测橄榄苦苷对H2O2诱导的PC12细胞活力的影响
结果见表1。与空白对照组比较,模型组细胞OD值显著降低(P<0.01),差异具有统计学意义。给予50、100、200、400 μmol/L的橄榄苦苷作用24、48、72 h后,与模型组比较,各浓度的OD值明显上升,差异具有统计学意义(P<0.01),表明橄榄苦苷能够抑制H2O2诱导的PC12细胞活力的降低。同时发现,当橄榄苦苷浓度为400 μmol/L时,细胞活力有下降趋势,表明高浓度的橄榄苦苷对细胞的增殖具有一定的抑制作用。基于此结果,采用50、100、200 μmol/L的橄榄苦苷进行后续实验。
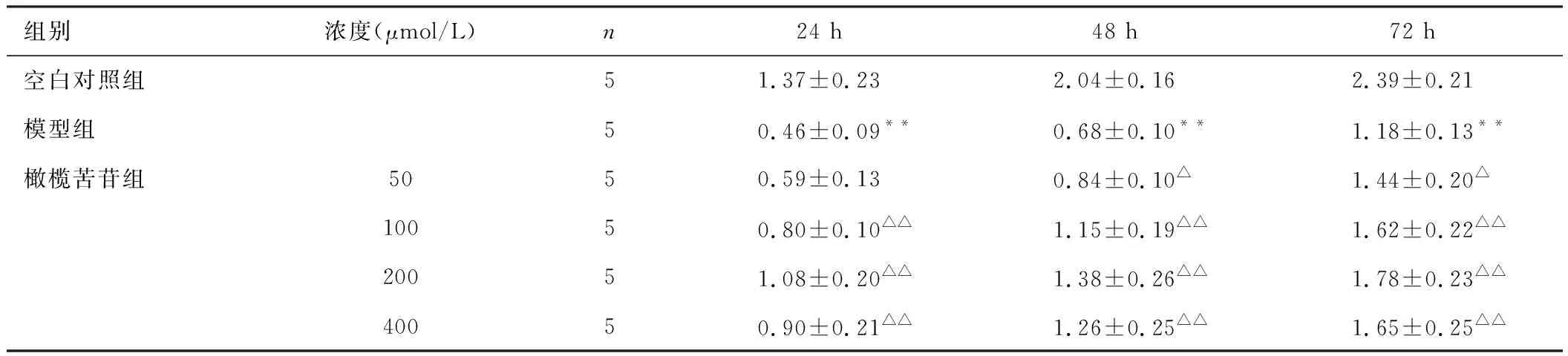
组别浓度(μmol/L)n24 h48 h72 h空白对照组51.37±0.232.04±0.162.39±0.21模型组50.46±0.09**0.68±0.10**1.18±0.13**橄榄苦苷组5050.59±0.130.84±0.10△1.44±0.20△10050.80±0.10△△1.15±0.19△△1.62±0.22△△20051.08±0.20△△1.38±0.26△△1.78±0.23△△40050.90±0.21 △△1.26±0.25△△1.65±0.25△△
注:与空白对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
2.2 TUNEL法检测橄榄苦苷对H2O2诱导的PC12细胞凋亡率的影响
结果见表2。橄榄苦苷组给予不同浓度(50、100、200 μmol/L)的橄榄苦苷分别作用24、48、72 h,与空白对照组比较,模型组的细胞凋亡率增加(P<0.01),差异具有统计学意义。与模型组比较,橄榄苦苷组的细胞凋亡率降低(P<0.05,P<0.01),凋亡率随着药物浓度增加及作用时间的延长逐渐降低。表明橄榄苦苷能够抑制H2O2诱导的PC12细胞凋亡率的增加。
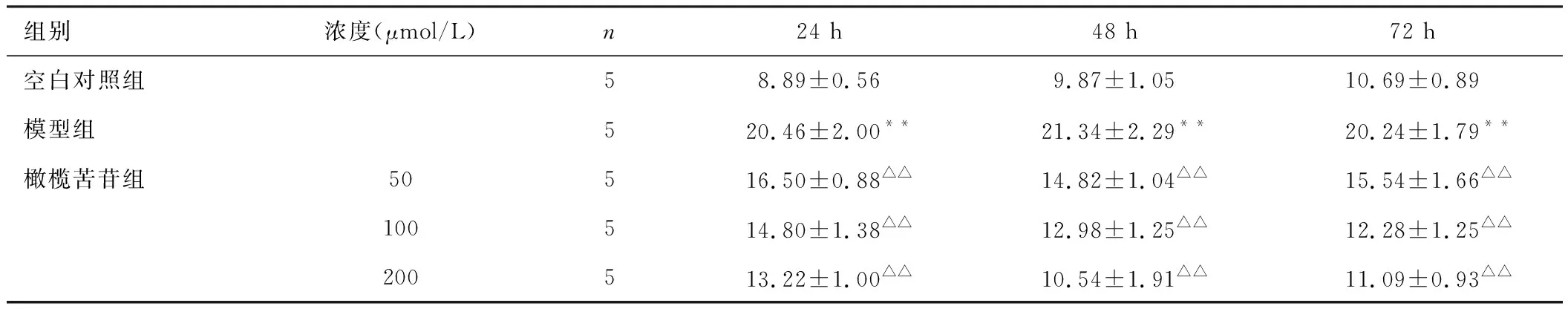
组别浓度(μmol/L)n24 h48 h72 h空白对照组58.89±0.569.87±1.0510.69±0.89模型组520.46±2.00**21.34±2.29**20.24±1.79**橄榄苦苷组50516.50±0.88△△14.82±1.04△△15.54±1.66△△100514.80±1.38△△12.98±1.25△△12.28±1.25△△200513.22±1.00△△10.54±1.91△△11.09±0.93△△
注:与空白对照组比较,**P<0.01;与模型组比较,△△P<0.01
2.3 橄榄苦苷对H2O2诱导的PC12细胞内超氧化物歧化酶(SOD)及谷胱甘肽过氧化酶(GSH-PX)活力的影响
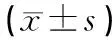
表3 橄榄苦苷SOD及GSH-PX活力的影响
注:与空白对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
结果见表3。与空白对照组比较,模型组细胞内SOD、GSH-PX活性显著降低(P<0.01,P<0.01),差异具有统计学意义。与对照组相比较,橄榄苦苷组细胞内SOD及GSH-PX的活性明显增加(P<0.01,P<0.05),差异具有统计学意义。
2.4 Western blot检测Caspase-3、Cyt-C表达
结果见图1。与空白对照组比较,模型组Caspase-3、Cyt-C表达增加(P<0.01,P<0.05),差异均具有统计学意义。与模型组比较,给予不同浓度的橄榄苦苷作用 48 h 后Caspase-3、Cyt-C表达显著降低(P<0.01,P<0.05),差异均具有统计学意义。

注:与空白对照组比较,**P<0.01;与模型组比较,△P<0.05,△△P<0.01图1 橄榄苦苷对Caspase-3 、Cyt-C表达的影响
3 讨论
在脑缺血疾病发生发展过程中,氧化应激损伤和抗氧化保护是研究的热点。正常的生理状态下存在着氧化应激平衡,当发生缺血再灌注(I/R)损伤时可破坏此平衡状态,导致神经细胞坏死、凋亡,造成病理的损伤。研究表明活性氧(H2O2)是氧化应激过程中促使细胞凋亡的重要因素,因此常用于体外细胞氧化损伤实验中[6]。本研究以H2O2诱导P12细胞制备氧化应激损伤的模型,用以从细胞水平研究橄榄苦苷抗H2O2诱导的PC12细胞凋亡的作用。
橄榄苦苷是从橄榄树中提取的主要酚类成分,具有广泛的药理作用,如抗氧化、抗炎、抗菌、抗肿瘤及心血管保护作用、防治骨质疏松、降血糖等作用[7-8]。研究者发现橄榄苦苷可能通过降低大脑神经细胞凋亡、降低Bax、提高Bcl-2的表达发挥神经保护作用[9],或通过增加大脑抗氧化能力、ATP酶和端粒酶活性等作用机制产生抗阿尔茨海默病的作用[1]。橄榄苦苷对I/R损伤有一定的保护作用。徐涛等[4]通过构建HK-2细胞缺糖缺氧损伤模型,发现10、50、100、200 μmol/L的橄榄苦苷能够提高HK-2细胞在缺糖缺氧环境下细胞的存活率,减轻由于缺糖缺氧引起的细胞凋亡。本研究结果表明,50~400 μmol/L的橄榄苦苷能够明显抑制H2O2的诱导PC12细胞活力的下降,本研究海发现橄榄苦苷的浓度达400 μmol/L时才引起P12细胞存活率的下降,这与徐涛等[4]的研究有差异。这可能与所用细胞株的状态、所构建的细胞模型及橄榄苦苷的实际浓度有关。
脑血管I/R损伤时神经细胞出现坏死和凋亡两种死亡形式,因此抑制神经细胞凋亡具有重要的意义。最近文献表明人参皂苷Rg1能够在细胞水平通过抑制细胞凋亡以及抗氧化途径改善冈田酸诱导的PC12细胞损伤,发挥细胞保护作用[10]。本研究结果表明,不同浓度的橄榄苦苷能够明显抑制H2O2的诱导PC12细胞的凋亡,并具有时间/剂量依赖性,提示橄榄苦苷通过降低凋亡率对抗H2O2诱导的PC12氧化应激损伤。
超氧化物歧化酶(SOD)可以清除机体内的自由基,保护细胞不受强毒性氧自由基的损伤。文献表明,SOD类似物可以通过清除氧自由基来发挥对心肌缺血再灌注损伤的保护作用[11]。谷胱甘肽过氧化物酶(GSH-PX)广泛存在于机体内,能够促进过氧化物(例如H2O2)的分解,避免细胞膜结构和功能遭到过氧化物损害,为机体抗过氧化能力指标之一。本研究发现H2O2诱导的PC12细胞内SOD及GSH-PX活力明显降低,橄榄苦苷则能够抑制这一作用。
目前普遍认为I/R损伤过程中细胞内氧自由基是导致细胞线粒体损伤主要原因[12]。氧化应激能够造成线粒体内膜产生非特异性孔道,细胞色素C 从内膜脱落释放到细胞质[13-14],细胞质中的细胞色素C激活Caspase-9并最终激活凋亡程序的执行者Caspase-3是[15]。本研究通过发现, H2O2诱导的PC12细胞胞内Caspase-3、Cyt-C蛋白表达增加,给予橄榄苦苷作用 48 h 后Caspase-3、Cyt-C表达显著降低,提示橄榄苦苷通过抑制Caspase-3、Cyt-C表达发挥抗凋亡作用,从而对氧化应激损伤的细胞发挥保护作用。
总之,橄榄苦苷能够通过增加H2O2诱导的PC12细胞内SOD及GSH-PX水平、抑制Cyt-C、caspase-3的释放从而抑制H2O2诱导的PC12细胞的凋亡,最终减少氧化应激作用造成的细胞损伤,发挥细胞保护作用。
