高场强MRI检测JNK抑制剂作用的apoE-/-小鼠颈动脉早期斑块
2019-07-23陆静姚玉宇李冰马根山
陆静,姚玉宇,李冰,马根山
东南大学附属中大医院心血管病研究所,江苏南京 210009; *通讯作者 姚玉宇 yaoyuyunj@hotmail.com
动脉粥样硬化(atherosclerosis,AS)是心血管疾病的主要驱动因素[1]。AS斑块发生在动脉后壁及动脉分支开口处,缓慢的血流及湍流是AS形成的重要原因[2]。通过对apoE-/-小鼠颈动脉远端结扎或在动脉外安放套管造成动脉近端血流速度下降形成低剪切力,从而形成颈动脉斑块是研究AS斑块的一种常见有效的动物模型[3-4]。apoE-/-小鼠颈动脉低剪切力可造成局部内皮细胞损伤,致炎因子分泌,巨噬细胞聚集并进入内膜形成AS斑块[5]。
MRI具有高分辨率、多序列成像、可重复及无辐射等特点,已用于检测AS斑块大小、斑块成分甚至判断斑块稳定性[6]。小动物7.0T高分辨MRI可用于小鼠主动脉、颈动脉斑块的检测。本课题组前期采用MRI及超声对 apoE-/-小鼠和 C57小鼠颈动脉低剪切力所致的斑块进行动态观察,并建立数学模型对斑块稳定性进行预测。研究显示,MRI能活体、动态、高效、准确地检测斑块的进程[7]。本研究拟在apoE-/-小鼠颈动脉分支结扎模型上,使用 c-Jun NH2-terminal kinase(JNK)抑制剂,应用超高场强7.0T Micro-MR检测 JNK抑制剂对低剪切力诱导的颈动脉 AS斑块的作用。
1 材料与方法
1.1 动物模型建立 所有动物实验均经我院实验动物委员会批准。apoE-/-小鼠20只(购于常州卡文斯实验动物有限公司,许可证号:SCXK 2015-0013),2月龄,雄性。高脂饮食2周(Western Diet 21%脂肪,0.15%胆固醇,购于南京协同生物有限公司)。
1.1.1 小鼠颈动脉分支结扎术 采用 10%水合氯醛0.3 ml/100 g麻醉小鼠后,仰卧位固定于手术台,沿颈部正中线切开皮肤 1 cm,钝性分离左侧颈总动脉和4支分支血管(颈外动脉、颈内动脉、枕动脉和甲状腺上动脉),用6-0缝合线结扎左侧颈外动脉、颈内动脉和枕动脉,保留甲状腺上动脉,缝合创口。造模小鼠随机分为对照组和JNK-I组,每组10例。对照组腹腔内注射溶剂PBS/DMSO;JNK-I组腹腔内注射JNK抑制剂SP600125 0.1 mg/(kg·d)。2组小鼠分别于术后7 d和14 d行MRI检测,第14天完成MRI后处死动物。
1.1.2 MRI检查 所有扫描在Micro-MR小动物扫描仪(7.0T Bruker PharmaScans,Bruker Biospin,Ettlingen,Germany)进行。孔径大小为89 mm,射频线圈直径为25 mm,气体麻醉剂异氟烷由山东科源制药有限公司生产。小鼠在术后7 d及14 d分别进行超高场强 MR扫描。小鼠异氟烷诱导麻醉后,仰卧位放至24 mm ID显像床内,异氟烷以低浓度、低流量维持,以控制小鼠呼吸频率影像图像质量并避免扫描过程中体温过低而死亡,连接呼吸监控。控制呼吸40次/min。成像序列及参数:MSME-PD-T2WI自旋回波序列,进行小鼠颈总动脉成像。成像参数:TR 1206.9 ms,TE 12.8/34.2 ms,视野2.5 cm×2.5 cm,翻转角180°,矩阵256×256,分辨率141 μm×141 μm×800 μm,层厚0.5 mm,平均激励次数4次。扫描使用流动饱和使血液信号流空,使用压脂技术减少化学位移伪影,每序列扫描18层。
1.1.3 MR图像分析 所得图像采用 ImageJ 1.41软件测量小鼠颈动脉管腔直径及斑块体积。
1.2 Western blot检测JNK的表达 MRI扫描后,采用大剂量10%水合氯醛腹腔注射麻醉处死小鼠。剥离颈总动脉周围组织,暴露游离两侧颈动脉,剪开右心房,由心尖部注入生理盐水40 ml直至血管冲洗干净,分别从主动脉弓出和颈内、外动脉分叉处离断血管。离断颈动脉,放入液氮,研磨后加入蛋白裂解液用于蛋白提取。蛋白定量后,蛋白样品上样于聚丙烯酰胺凝胶系统电泳,经过转膜,封闭。一抗孵育过夜(兔抗P-JNK,1∶1000,Cell Signaling公司;兔抗JNK,1∶1000,Cell Signaling公司),兔抗血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)抗体(1∶1000,Abcam公司)。随后经过洗膜,二抗孵育,ECL曝光显色。
1.3 血管组织中 VCAM、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)mRNA表达检测 颈动脉组织加入Trizol 200 μl,液氮研磨,按试剂盒方法进行RNA抽提及cDNA逆转录。以上述小鼠血管组织的cDNA为模板,用引物进行实时定量PCR扩增。VCAM-1引物:上游5′-AGTTGGGGATTCGGTTGTTC-3′,下游 5′-CATTCCTTACCACCCCATTG-3′;MCP-1引物:上游5′-CCTGCTGTTCACAGTTGC-3′,下游5′-TCATTGGGATCATCTTGC-3′;β-actin 引物:上游 5′-GTACCACCATGTACCCAGGC-3′, 下游5′-AACGCAGCTCAGTAACAGTCC-3′。以 β-actin 作为内参照,各组随机选取3只小鼠检测病变血管组织中VCAM-1及MCP-1 mRNA的表达。
1.4 病理检测 离断颈动脉立即OCT包埋,置于-80℃冰箱,待做冰冻切片。将OCT包埋的血管用恒温冰冻切片机连续切片,每片8 μm。血管间断取切片进行HE染色,普通光镜观察形态学改变。免疫组织化学染色(Universal Elite ABC,Vector)检测巨噬细胞的标记CD68(Chemicon,1∶200)的表达。
1.5 统计学方法 采用SPSS 19.0软件,符合正态分布的计量资料以表示。组间比较采用成组资料t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 低剪切力诱导颈动脉斑块体积比较 对血清脂质的检测显示,对照组及 JNK-I组胆固醇分别为(12.1±1.9)mmol/L 和(11.9±2.3)mmol/L,三酰甘油分别为(2.2±0.2)mmol/L 和(2.2±0.3)mmol/L,组间比较差异均无统计学意义(P>0.05)。对照组7 d时患侧表现为血管腔狭窄,血管壁增厚,14 d时狭窄程度显著增加(图1A);对照组与JNK-I组14 d患侧血管管腔直径[(0.31±0.02)mm比(0.42±0.01)mm]、斑块体积[(1.14±0.13)mm3比(0.58 ±0.06)mm3],差异均有统计学意义(P<0.01)。
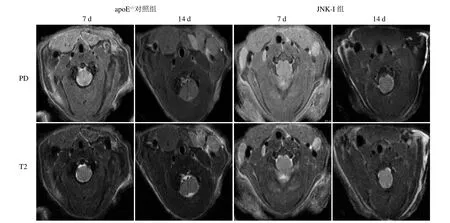
图1 MRI显示JNK抑制剂显著抑制低剪切力诱导的颈动脉斑块体积。14 d血管壁增厚,管腔显著狭窄;JNK-I组可见血管壁无明显增厚
2.2 JNK抑制剂抑制低剪切力诱导的斑块形成和炎症反应 对照组管腔显著狭窄,而JNK-I组仅少量血管内膜形成,与MRI结果相符合。CD68染色显示对照组14 d时,CD68阳性细胞为(36.8±4.1)/高倍视野;JNK-I组14 d时,CD68阳性细胞为(13.7±3.6)/高倍视野。组间CD68阳性细胞比较,差异有统计学意义(P<0.05)。结果显示,JNK-I组的动脉粥样硬化明显抑制,且炎症细胞明显少于对照组(图2)。
2.3 Western blot及RT-PCR结果证实JNK抑制剂抑制低剪切力诱导的炎症 Western blot结果显示,与对照组比较,JNK-I组P-JNK水平显著下降;而趋化因子VCAM-1的表达在JNK-I组显著下降(P<0.05),见图3。
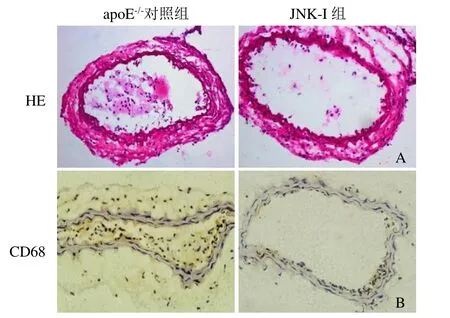
图2 JNK抑制剂抑制斑块形成的代表性的病理结果。A.低剪切力诱导的斑块形成,而JNK抑制剂显著抑制斑块形成(HE,×400);B.CD68免疫组化显示巨噬细胞在低剪切力组显著增加,而JNK抑制剂抑制巨噬细胞聚集(×400)
低剪切力组显著增加 MCP-1及 VCAM-1的表达,而JNK抑制剂抑制MCP-1及VCAM-1的表达,差异有统计学意义(P<0.05)。见图4。
3 讨论
AS是一种进展性的动脉病变,表现为血管内膜脂质、巨噬细胞、平滑肌细胞及细胞外基质等聚集形成斑块而造成动脉狭窄,是心脑血管疾病的主要原因[8]。多年来,通过对死后血管病理解剖的深入研究已对AS的病理及病理生理进行了一定程度的分析,但仅为回顾性结果。近十年,随着影像技术的发展,研究者们通过侵入性的检查,如血管造影、血管内超声、光学相干断层摄影、拉曼光谱、近红外光谱等,或者通过非侵入性检查,如 CT、PET、MRI等对血管壁斑块成像,极大地丰富了研究者对 AS的认识[9]。尽管血管造影和血管内超声已广泛应用于临床工作,但仍急切需要非侵入性的检查。
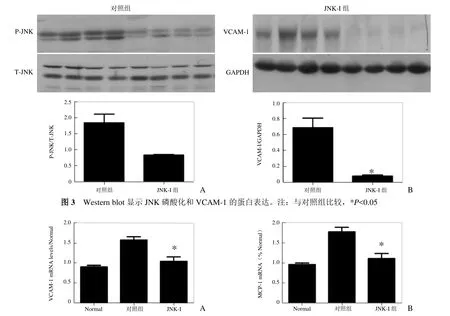
图4 RT-PCR检测各组VCAM-1及MCP-1的mRNA表达水平比较。注:与对照组比较,*P<0.05
MRI无创、无放射线污染并具有良好的高空间分辨率,日益得到研究者的重视。通过开发 MRI不同序列,如T1/T2弛豫时间、质子密度、扩散加权成像等,研究者不仅能判断动脉管腔的狭窄程度,还能明确AS斑块的成分[10-11]。本课题组一直致力于动脉斑块的MRI研究,并已构建Ox-LDL抗体、CTGF抗体、叶酸受体等不同靶向的磁性分子探针,在apoE-/-小鼠模型上观察Ox-LDL、CTGF及巨噬细胞在斑块中的分布[12-13]。本研究采用抑脂肪、黑血 MSME-PDT2WI自旋回波序列,T2WI对血管内外壁及斑块的边界显示较为清晰。PDWI信噪比较高,较T1WI和T2WI更能清晰地显示斑块的边界和血管腔[14]。本组对照组apoE-/-小鼠14 d无论PD或T2WI序列均可见颈动脉管壁明显增厚,管腔狭窄;而JNK-I组14 d可见颈动脉壁并无明显增厚。尽管本研究使用 7.0T高场强MRI,提示有较高的信噪比;但由于apoE-/-小鼠颈动脉的直径不足0.5 mm,管壁更薄,故仍然无法分辨斑块的各种成分。因此,在未来使用更高场强的MRI及发展匹配的专用线圈可进一步提高信噪比,开发有效的序列用于小血管 MRI,可深化小动物动脉血管AS研究。
炎症在 AS斑块形成中具有重要作用,巨噬细胞是AS发生、进展及出现并发症的中心环节。套管所致的低剪切力可导致内皮细胞损伤,释放大量的趋化因子,如VCAM-1、MCP-1等,趋化单核巨噬细胞至病变部位,穿过内皮细胞进入内膜,吞噬脂质并在局部沉积,导致AS斑块形成[15]。Wang等[4]采用apoE-/-小鼠颈动脉放置套管模型上连续输注JNK抑制剂10周,发现JNK抑制剂显著抑制斑块形成,研究认为JNK抑制剂通过抑制NF-κB抑制VCAM-1的表达。本研究采用结扎颈内动脉和颈外动脉的方法建立低剪切力模型,这种方法不会在颈动脉周围因异物形成继发性炎症。采用 MRI动态观察斑块的形成,发现对照组在7 d即可见斑块形成,14 d形成明显的斑块,造成管腔显著狭窄;而JNK-I组在14 d仅有少量斑块形成,HE染色证实了MRI结果。此外,CD68免疫组化染色显示对照组巨噬细胞显著增加,而JNK-I组仅少量巨噬细胞在内膜下聚集。Western blot显示P-JNK在抑制剂组表达显著下降,而T-JNK在两组间差异无统计学意义,表明JNK抑制剂抑制了JNK磷酸化,进而抑制了P-JNK活化所致的一系列信号通路。在炎症状态下,MCP-1是趋化单核细胞和淋巴细胞的重要趋化因子。研究发现,抑制MCP-1能抑制巨噬细胞进入血管壁[16-17]。JNK的磷酸化在MCP-1的表达及炎症细胞的活化中起重要的调节作用。本实验中可见JNK抑制剂SP600125显著抑制MCP-1的表达及炎症细胞的聚集。同时,VCAM-1也是一个重要的趋化因子,JNK通过磷酸化活化NF-κB活化VCAM-1[4]。研究显示,在结扎颈内动脉及颈外动脉分支后的斑块形成早期,VCAM-1高表达,SP600125显著抑制VCAM-1蛋白及mRNA表达。因此,SP600125通过抑制JNK的磷酸化抑制炎症抑制斑块形成。
总之,通过对apoE-/-小鼠颈动脉分支结扎模型使用JNK抑制剂,利用超高场强7.0T Micro-MRI检测JNK抑制剂对低剪切力诱导的早期颈动脉AS斑块的变化,发现抑制JNK能显著抑制颈动脉斑块形成,高场强的 MRI是一种有效的研究方法,可用于动态观察斑块进程。
