超声微泡介导的空化效应改善急性缺血组织局部灌注的实验研究
2019-07-23邱世锋杨莉李丹霞曹世平查道刚吴爵非
邱世锋,杨莉,李丹霞,曹世平,查道刚,吴爵非
南方医科大学南方医院,广东广州 510515; *通讯作者 查道刚 zha@smu.edu.cn
近年来,诊断超声联合微泡辅助声学溶栓改善血流灌注已逐渐成为国际研究的热点。研究表明,声学溶栓在外周血管溶栓[1-2]及冠状动脉闭塞再通[3]方面疗效较好,能增加血流灌注、改善局部微循环。荷兰、巴西的小规模临床试验证实声学溶栓在急性心肌梗死患者的有效性及安全性[4-5]。同时,研究证实超声联合微泡产生的空化效应在慢性下肢缺血动物模型中可增加肢体缺血组织灌注和辐照区域的局部血流[6-8],这种方法称为“声学辅助灌注”。
本研究拟建立贴近临床的大鼠下肢急性缺血模型,以探讨超声间断高机械指数脉冲联合静脉滴注微泡介导的空化效应对急性缺血组织灌注的影响。
1 材料与方法
1.1 实验动物 选取雄性SPF级SD大鼠24只,体重 180~250 g,由南方医科大学实验动物中心提供(实验动物质量合格证号:44002100016439)。本研究获得南方医科大学实验动物中心伦理委员会批准。
1.2 微泡混悬液制备 采用南方医院自制脂质微泡,由二棕榈磷脂酰胆碱(DPPC)、二棕榈酰磷脂酸(DPPA)、二棕榈酰磷脂酰乙醇胺-聚乙二醇 500(DPPE-PEG 500)、甘油、1,2-丙二醇等脂质材料及全氟丙烷气体按一定比例制得。库尔特计数器(MultisizerⅢ,美国)测得微泡浓度为(2.98±0.17)×109/ml,平均直径为(2.45±0.14)μm。取2.5 ml微泡与7.5 ml生理盐水预混稀释成微泡混悬液,超声造影中用微量泵以400 μl/min缓慢静脉输注微泡混悬液,治疗过程中以600 μl/min持续输注。
1.3 建立大鼠急性下肢缺血模型 腹腔注射3%戊巴比妥(50 mg/kg)麻醉大鼠,将大鼠仰卧固定于恒温鼠板,维持体温37℃,备皮、消毒。采用无菌操作于大鼠左侧下肢腹股沟韧带下缘作一长约 1.5 cm的纵行切口,分离左侧髂外动脉及其分支后,在髂外动脉远端进行结扎10 min,同时避免损伤周围静脉及神经,右侧下肢不做处理。结扎大鼠左侧髂外动脉10 min后,超声造影观察到结扎侧下肢血流灌注减少 50%以上(平台期微泡充盈面积较基线减少50%以上),表明大鼠急性下肢缺血模型建立成功。分离出颈静脉,在颈静脉内作一“V”形切口,插入PE50管,建立大鼠静脉输液通道。
1.4 超声参数设定 ①成像超声参数设定:使用西门子Sequoia 512超声诊断仪,17L5探头,选择对比脉冲序列(CPS)模式,调整图像增益,调整成像超声频率为7.0 MHz,机械指数(MI)为0.18,动态范围为55 dB,选择大鼠下肢横切面(以髌骨上缘为垂足,垂直股骨的横切面)成像,调整切面至图像满意后,固定探头,造模前、造模后和治疗后均对大鼠双下肢进行低机械指数实时超声造影成像。②治疗超声参数设定:使用西门子Sequoia 512超声诊断仪,17L5探头,选择D Color模式,调整成像超声频率为10.0 MHz,MI为1.9,每次高机械指数脉冲破坏(flash)持续时间为3 s,间歇时间为5 s。
1.5 实验方案 按照不同治疗方法将大鼠随机分为3组,每组各8只。①空化组(超声+微泡):予间断高机械指数脉冲联合静脉滴注微泡 10 min;②单纯超声组:仅予间断高机械指数脉冲10 min,无持续静脉滴注微泡;③单纯微泡组:仅予持续静脉滴注微泡10 min,无间断高机械指数脉冲。
经静脉通道持续泵入微泡,连续成像超声进行双下肢同步超声造影灌注基础成像,存取为双下肢基线。结扎大鼠左侧髂外动脉,采用超声造影成像观察结扎侧下肢血流灌注减少50%以上(平台期微泡充盈面积较基线减少50%以上),等待10 min后行超声造影灌注成像。将大鼠双下肢同时在不同条件下持续治疗,治疗10 min后立即再次行超声造影灌注成像。
1.6 图像分析 全部造影图像存储于光盘,根据美国Virginia大学创立的经典方法[9],使用MCE软件(俄勒冈健康与科学大学,美国)对造影图像进行脱机分析。人工描绘大小、形态及位置一致的骨骼肌灌注区为感兴趣区(ROI),根据对比剂在局部组织的声强度与时间间隔函数关系 Y(t)=A×[1-e(-β×t)],计算骨骼肌的平台声强度(A值)和对比剂再充填速率(β值),A值反映局部微血管血流容积(相当于毛细血管密度),β值反映微泡在局部组织毛细血管流动的速度;两者的乘积(A×β)代表局部组织微血管的血流量(microvascular blood flow,MBF)。
1.7 统计学方法 采用SPSS 19.0软件,正态分布的计量资料以±s表示,同一治疗组同侧下肢不同时间血流灌注情况比较采用单因素方差分析;同一治疗组不同下肢同一时间血流灌注情况比较采用独立样本t检验。不同组别同侧下肢同一时间血流灌注情况比较采用单因素方差分析,组间差异有统计学意义时,采用Bonferroni方法进行事后检验。P<0.05表示差异有统计学意义。
2 结果
2.1 空化前后的超声造影图像 空化组双下肢空化前后的超声造影图像见图1。造模前,缺血侧和正常侧血流灌注的充盈时间相似。造模后(即空化前),缺血侧血流灌注的充盈时间延长,高于正常侧(P<0.05)。空化后,缺血侧的充盈时间仍高于正常侧(P<0.05)。对于缺血侧,空化后血流灌注的充盈时间明显较空化前提前(P<0.05)(表1)。

图1 空化组大鼠双下肢空化前(A)与空化后(B)的超声造影图像。正常侧:空化前后约8 s达血流灌注充盈稳态;缺血侧(红色方框内):空化前14 s达充盈稳态,空化后提前至11 s达充盈稳态
表1 空化组大鼠双下肢平均血流灌注充盈时间比较(±s,s)

表1 空化组大鼠双下肢平均血流灌注充盈时间比较(±s,s)
注:与造模前比较,*P<0.05;与空化前比较,ΔP<0.05;与正常侧比较,#P<0.05
部位 造模前 空化前 空化后缺血侧(n=8) 8.13±0.69 14.19±0.84*# 11.38±1.25Δ#正常侧(n=8)8.10±0.818.29±0.678.25±0.83
空化组双下肢 ROI内空化前后定量分析拟合的时间-强度曲线见图 2。空化后缺血侧 A值、β值和MBF均较空化前明显增加,主要表现为A值增加;而正常侧空化后A值、β值基本同前。
2.2 3组缺血侧A值、β值及MBF的变化 造模前,3组缺血侧与正常侧的超声造影成像中A值、β值和MBF差异均无统计学意义(均P>0.05,表2),提示各组大鼠造模前双下肢血流灌注一致,排除实验前自身有周围动脉疾病的大鼠。
造模后,超声造影成像见缺血侧平台期微泡充盈面积较基线减少50%以上,且血流灌注达到充盈稳态时间明显延长;缺血侧血流灌注较结扎前显著减少(65.0±9.3)%(P<0.001)。
治疗后,空化组缺血侧A值明显高于治疗前(P<0.05),甚至超过基线(P<0.05),β值、MBF也高于治疗前(P<0.05)。超声组治疗后缺血侧A值、β值和MBF较治疗前略增加,但差异无统计学意义(P>0.05)。而微泡组治疗后缺血侧A值、β值和MBF均无显著变化(P>0.05)(表2)。
空化组缺血侧空化后A值(F=72.354,P<0.001)、MBF(F=37.781,P<0.001)明显高于超声组和微泡组,差异有统计学意义;但 β值差异无统计学意义(F=2.941,P>0.05)。
2.3 3组正常侧A值、β值及MBF的变化 对于正常侧(非缺血性)下肢,造模前与造模后超声造影见平台期微泡充盈面积及血流灌注充盈时间均无明显变化。空化治疗后,空化组正常侧组织血流灌注也较前轻度增加,但差异无统计学意义(P>0.05),主要表现为β值增加,A值无明显变化。而超声组中正常侧组织血流灌注也较前轻微增加,但差异无统计学意义(P>0.05);而微泡组中正常侧微循环血流灌注基本无改变(P>0.05)(表2)。

图2 空化组大鼠双下肢空化前(A)与空化后(B)的时间-超声造影强度曲线
表2 各组大鼠下肢缺血侧和正常侧A值、β值及MBF比较(±s)
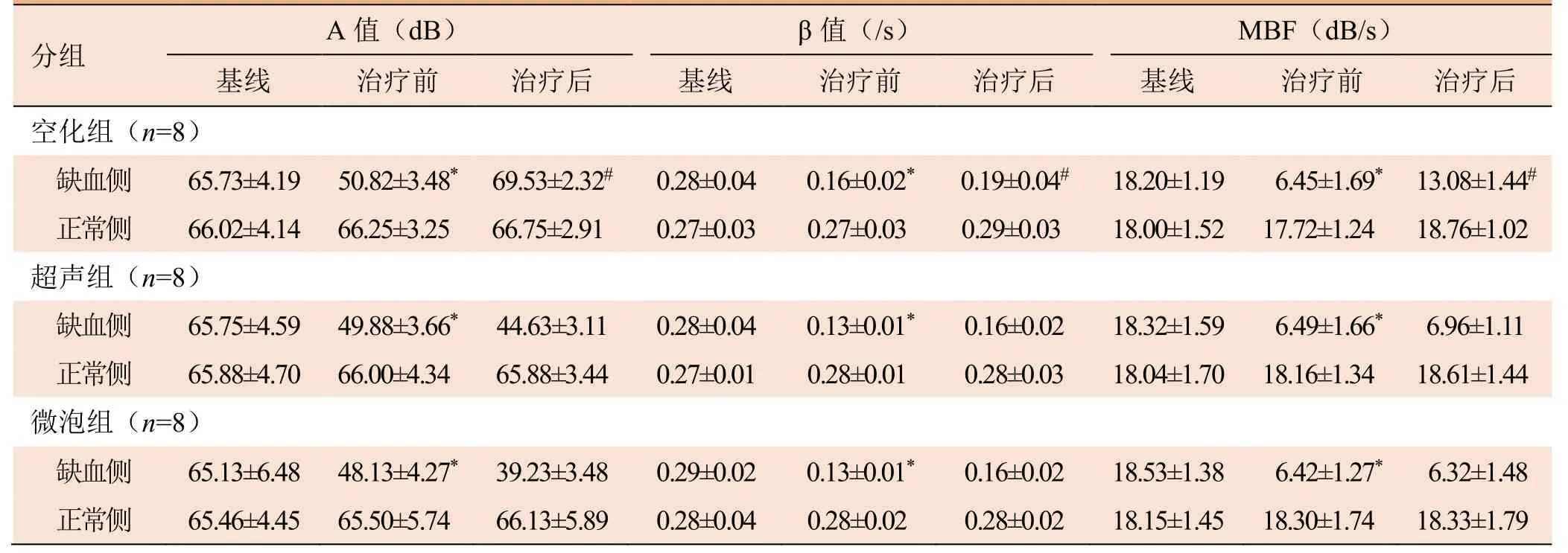
表2 各组大鼠下肢缺血侧和正常侧A值、β值及MBF比较(±s)
注:与基线比较,*P<0.05;与治疗前比较,#P<0.05
分组A值(dB) β值(/s)MBF(dB/s)基线 治疗前 治疗后 基线 治疗前 治疗后 基线 治疗前 治疗后空化组(n=8)缺血侧65.73±4.1950.82±3.48*69.53±2.32#0.28±0.040.16±0.02*0.19±0.04#18.20±1.196.45±1.69*13.08±1.44#正常侧66.02±4.1466.25±3.2566.75±2.910.27±0.030.27±0.030.29±0.0318.00±1.5217.72±1.2418.76±1.02超声组(n=8)缺血侧65.75±4.5949.88±3.66*44.63±3.110.28±0.040.13±0.01*0.16±0.0218.32±1.596.49±1.66*6.96±1.11正常侧65.88±4.7066.00±4.3465.88±3.440.27±0.010.28±0.010.28±0.0318.04±1.7018.16±1.3418.61±1.44微泡组(n=8)缺血侧65.13±6.4848.13±4.27*39.23±3.480.29±0.020.13±0.01*0.16±0.0218.53±1.386.42±1.27*6.32±1.48正常侧65.46±4.4565.50±5.7466.13±5.890.28±0.040.28±0.020.28±0.0218.15±1.4518.30±1.7418.33±1.79
3 讨论
近年来,超声联合微泡的临床应用越来越广泛,超声造影可定量评估不同器官的微循环灌注改变[10-11],靶向微泡联合超声可以更精准有效地进行肿瘤的靶向治疗,靶向超声联合微泡有望通过血-脑屏障治疗部分神经系统疾病[12]。在高能量超声作用下,微泡会产生剧烈共振,甚至破裂,称为微泡的空化效应[3]。由于微泡可以通过微循环,在低能量超声下发生共振压缩,因而可以放大微循环中内皮细胞或红细胞介导的剪切力及机械力,进而增加局部组织血流,称为“声学辅助灌注”[6-8]。
声学辅助灌注越来越受到关注,并试图探索其在心血管疾病或严重外周动脉疾病中发生的急性或慢性缺血组织中增加血流灌注的临床价值。Belcik等[6-7]研究证实,声学辅助灌注可使小鼠慢性缺血下肢组织灌注增加 2倍,在患外周动脉疾病的小鼠模型中逆转组织缺血长达 24 h,并且使镰状细胞病患者的组织灌注加倍,其潜在机制可能是空化介导的eNOS活化和剪切力增加。在大鼠下肢止血带结扎的缺血模型或犬左前降支闭塞模型中,27 kHz超声可通过磷酸化eNOS(p-eNOS)和NO的产生改善灌注。机械压力和剪切力增加可以激活 NOS,并增加内皮 NO的产生[13]。然而,既往大多数研究均集中在慢性缺血动物模型上。
本研究为国内首次在急性下肢缺血动物模型上探索,观察到声学辅助灌注可以改善急性缺血肢体组织灌注。
通过对比双下肢的超声造影图像发现,缺血侧大动脉血流灌注明显减少,血流灌注充盈稳态时间延长,但微循环的血流灌注无明显减少;空化后,缺血侧大动脉血流灌注无明显增加,但微循环的血流灌注明显增加且充盈加快,血流灌注充盈稳态时间提前。结合时间-超声造影强度曲线分析,缺血侧空化后A值、β值明显增加,但以A值增加为主。故推测声学辅助灌注改善急性缺血肢体组织灌注,主要是通过增加局部微血管血流容积(A值),即增加微循环灌注,进而增加辐照区域的局部血流。因扩张大动脉的程度不明显,故血流速度(β值)增加程度不如A值。
既往研究在慢性缺血动物模型上证实,超声联合微泡介导的空化效应进一步增强了动脉扩张的程度,其机制可能是超声的空化效应和微泡的增强作用增加了机械压力和剪切力,从而激活NOS并增加内皮NO的产生,进而扩张血管增加血流灌注[6-7,13]。此外,Goyal等[14]在微血管阻塞的体外和体内模型中证实了空化治疗后可恢复灌注,提示改善微循环灌注的重要性。
造模后,缺血侧A值、β值和MBF均下降。但缺血侧血流灌注显著减少主要体现在β值明显减少,反映了结扎后缺血下肢小动脉及微循环血流充盈速度明显减慢;A值下降提示下肢缺血后因组织灌注不足有部分微血管关闭,从而导致微血管血流容积减少;结合超声造影图像及时间-强度曲线可见,MBF下降主要是微循环灌注明显减少。
空化治疗后,大鼠缺血侧MBF增加1倍多,A值较治疗前明显增加,甚至超过基线值,β值也明显增加,但增加幅度不如A值;超声造影图像见缺血侧大动脉血流灌注无明显增加,但微循环的血流灌注明显增加且充盈加快,血流灌注充盈稳态时间提前,提示空化效应可能是短暂性扩大动脉直径,使血流充盈速度加快,一定程度上提高了血流灌注压使部分微血管开放,代偿性增加微血管血流容积,从而改善微循环灌注,进而增加急性缺血组织血流灌注。
超声组治疗后缺血侧组织血流灌注仅稍增加,证实超声对缺血组织有一定的治疗作用;微泡组中治疗后缺血侧微循环血流灌注基本无明显改变,提示单纯的微泡仅有超声造影的作用。因此,空化效应改善急性缺血组织灌注的效果明显优于单纯超声治疗和单纯微泡治疗。
因此,这种声学辅助灌注的效应不仅通过扩张大血管,也有选择性地在微血管水平产生影响,从而改善微循环灌注及缺血组织缺血缺氧的情况,减轻氧化应激等组织损伤过程,进而对缺血组织起到一定的保护作用。尽管这种效应有可能是短暂存在或有时效性[8]。总之,声学辅助灌注可有效改善急性缺血组织局部血流灌注。声学辅助灌注和声学溶栓作为非侵入性治疗,未来在临床上有望应用于急性或慢性缺血性心血管疾病[6-7,15],其改善急性缺血组织灌注的具体机制有待进一步研究。
