油茶籽饼粕中甲醇提取物抑制黄曲霉菌效果及成分分析
2019-07-23王亚萍费学谦陆宽宽姚小华郭少海王开良
王亚萍,费学谦,陆宽宽,姚小华,郭少海,王开良
油茶籽饼粕中甲醇提取物抑制黄曲霉菌效果及成分分析
王亚萍,费学谦※,陆宽宽,姚小华,郭少海,王开良
(中国林业科学研究院亚热带林业研究所,杭州 311400)
为了明确油茶籽饼粕中对黄曲霉菌有抑制作用的活性物质。该研究开展了油茶籽饼粕不同溶剂提取物对黄曲霉菌菌丝生长及产毒的影响研究。选用80%甲醇作为溶剂对油茶籽粕进行提取,提取液依次利用乙酸乙酯、饱和正丁醇进行梯度萃取,得到乙酸乙酯萃取相、正丁醇萃取相和水相,正丁醇萃取相对黄曲霉菌有较好的抑制效果,100 mg/mL浓度效果最好,抑菌圈直径为22.00 mm,菌丝干质量相比对照减少了42.88%,黄曲霉毒素未被检出,而乙酸乙酯萃取相和水相对黄曲霉菌的抑制效果较弱,甚至无抑菌效果。采用柱层析、超高效液相色谱串联三重四级杆飞行时间质谱法对正丁醇萃取相中的抑菌物质进行纯化鉴定,分离出了3种黄酮苷类化合物:1)山奈酚-3--[-D-吡喃葡萄糖苷-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷];2)山奈酚-3--[2---D-吡喃木糖基-6---L-吡喃鼠李糖]--D-吡喃葡萄糖苷;3)山奈酚-3--(6-反式-对-香豆酰基)--D-吡喃葡萄糖基-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷。以上研究结果为黄曲霉菌天然抑菌剂的研究和开发提供了参考,也拓宽了油茶副产物的加工利用途径。
种子;萃取物;活性组分;抑制;黄曲霉
0 引 言
油茶(Abel.)是山茶科山茶属植物,是世界四大木本油料树种之一[1]。油茶籽油是中国独有的极具营养、健康及经济、社会价值的特色油脂资源,其不饱和脂肪酸含量高达90%以上,还含有蛋白质、多糖、皂苷、酚类、VE、甾醇、角鲨烯等多种功能性成分[2],在各项主要指标上接近甚至超过橄榄油,能充分平衡人体营养,有利身体健康[3]。随着人们生活水平的提高和保健意识的不断增强,油茶籽油日益受到消费者的青睐,油茶籽的开发利用日益受到重视,随之而来的副产物的开发利用也逐渐被重视起来,但在质量控制方面仍存在不少问题,油茶籽在采收、贮存、加工及运输过程中存在着被有毒有害物质污染的风险,如苯并芘、黄曲霉毒素等[4]。
黄曲霉菌()是一种是常见的腐生真菌,易侵染花生、玉米和坚果等粮食经济作物,可以产生黄曲霉毒素(aflatoxins,简称AFs)[5],低剂量的黄曲霉毒素对人及动物肝脏组织有破坏作用,会增加肝癌的发生率,高剂量的黄曲霉毒素可导致剧毒而致死[6]。黄曲霉毒素被世界卫生组织(WHO)的癌症研究机构划定为Ι类致癌物,可使人类和多种动物诱发原发性肝细胞癌,是目前已发现的最强的化学致癌物[7-9]。据联合国粮农组织(FAO)研究,世界范围内1/4的粮食作物受到真菌毒素的污染,且主要是受黄曲霉毒素的污染。它主要来自受污染的粮油及其制品如花生、花生油、玉米、大米、面粉、坚果、棉籽、牛奶等[10]。如何有效地防止黄曲霉污染已经成为一个亟待解决的重大问题。
长期以来人们对黄曲霉菌及毒素的研究还主要集中在检测技术的优化和毒素的脱除[11-13]。目前,植物和微生物源活性物质对黄曲霉和黄曲霉毒素的防治越来越受到人们的重视[14]。笔者前期研究表明,油茶籽不易感染黄曲霉菌,仅在高温、高湿环境或黄曲霉孢子大量存在条件下会被黄曲霉菌侵染,但其侵染和产毒量远远低于花生、玉米等易感染黄曲霉菌的油料,而且在人为接种黄曲霉菌后,随着培养时间延长,黄曲霉毒素含量呈下降趋势[15]。由此推断可能由于油茶籽中含有某些能够抑制黄曲霉菌生长和产毒的天然拮抗物质。但其中哪种物质对黄曲霉产生拮抗作用仍未见研究,对此,本研究开展了油茶籽饼粕不同溶剂萃取物对黄曲霉菌生长和产毒的抑制效果,筛选出抑菌物质类型,并进一步分离纯化鉴定出抑菌活性成分。以期为黄曲霉菌天然抗菌剂的研发提供参考和指导,同时也有利于拓宽油茶副产物的加工利用途径。
1 材料与方法
1.1 试验材料
油茶籽:采自中国林业科学研究院亚热带林业研究所的油茶种植基地。成熟油茶籽采收后于60 ℃烘干至含水率约7%[16],液压榨油后对茶饼进行干燥、粉碎,索氏抽提除去残余油脂,于4 ℃保存备用。
产毒黄曲霉菌种:购自中国科学院微生物研究所菌种保藏中心(CGMCC No. 3.06305)。
PDA培养基、PDB培养基购自杭州微生物试剂有限公司。其他测定用试剂均为分析纯,检测黄曲霉毒素和活性物质鉴定所用试剂均为色谱纯。AFs混合标样购自上海安谱公司。
1.2 仪器设备
6YY-190液压榨油机(河南省洛阳市汝阳液压机械厂),DKS-12水浴锅(嘉兴中新医疗仪器有限公司),B-811索氏抽提器(瑞士Buch公司),BSC-1000ⅡA2生物安全柜(苏州苏净安泰空气技术有限公司);SHP-450生化培养箱(上海精宏实验设备有限公司);LDZF-30KB立式蒸汽灭菌器(上海申安医疗器械厂);DM-4B生物显微镜(德国Leica公司);BS-1F全温度振荡培养摇床(常州金坛精达仪器制造有限公司);Eppendorf mini Span离心机(德国Eppendorf公司);液质联用色谱仪(美国Agilent科技公司);UPLC-Triple-TOF/MS系统:AcquityTMultra型高效液相色谱仪(美国Waters公司),Triple TOF 5600+型飞行时间质谱(美国AB Sciex公司)。
1.3 黄曲霉孢子悬液的制备
用无菌吸管吸取0.4 mL无菌水,滴入干粉安瓿瓶内轻轻震荡,使黄曲霉菌粉末呈悬浮状态,吸取0.2 mL菌液移植于PDA斜面。于29 ℃培养箱培养48 h后,再转管一次,得到活化的黄曲霉菌种,培养5 d后,用含有0.1%吐温80的无菌水将孢子从PDA斜面洗下,采用梯度稀释法[17],利用血球计数板在显微镜下计数,调整孢子悬浮液浓度为1.0×106孢子/mL,菌悬液要现用现配。
1.4 油茶籽粕不同溶剂萃取物的制备
100 g脱脂的油茶籽粕加入1 000 mL 80%甲醇(体积比80:20),在60 ℃回流提取2 h,倾出提取液,再加入250 mL 80%甲醇,60 ℃提取1.5 h,将2次所得提取液合并,减压浓缩除去甲醇溶剂,水相部分依次用乙酸乙酯、饱和正丁醇进行梯度萃取,收集乙酸乙酯萃取相、正丁醇萃取相和水相,分别减压浓缩后于40 ℃真空干燥,于4 ℃冷藏备用。
1.5 不同溶剂萃取相的抑菌效果
乙酸乙酯相、正丁醇相和水相分别称质量1 g溶解于10 mL无菌水,配成100 mg/mL的溶液,再依次稀释成50、33.5、25 mg/mL,用0.22m醋酸纤维膜过滤[18]备用。
1.5.1 抑菌圈法
采用改良的牛津杯法[19]。用无菌吸管吸取100L黄曲霉孢子悬液(1.0×106孢子/mL)到PDA平板表面,涂布均匀。取3个内径6 mm的牛津杯轻置于平板表面。每个杯体内加入200L不同浓度的乙酸乙酯萃取相、正丁醇萃取相和水相,静置15 min,用封口膜固定培养皿,于4 ℃放置12 h使提取液充分扩散,取出后置于29 ℃培养箱培养,48 h后测量抑菌圈直径,每处理重复3次,以无菌水作对照。
1.5.2 菌丝干质量法
吸取200L的1×106/mL孢子菌悬液,加入装有20 mL已灭菌的PDB培养基的三角瓶中,加入1%吐温80使黄曲霉孢子均匀分散,再分别添加200L不同浓度的乙酸乙酯萃取相、正丁醇萃取相和水相,使最终浓度分别为100、50、33.5、25 mg/mL,每个浓度梯度做3个重复,于29 ℃、180 r/min恒温摇床培养5 d后取出,用滤纸过滤,挑出菌丝于45 ℃烘箱内烘干至恒质量,称量、计算菌丝干质量。保留滤液,用于测定黄曲霉毒素[20]。
1.5.3 黄曲霉毒素含量测定
1.5.2所得滤液经酶联免疫亲和柱净化处理后测定黄曲霉毒素,测定方法参考GB 5009.22-2016(第一法)。液相色谱条件:Symmetry C18柱(150 mm×3.9 mm,5m)。流动相A:0.1%甲酸+10 mmol/L乙酸铵, 流动相B:乙腈;柱温:35 ℃;流速:0.5 mL/min;进样量:10L;梯度洗脱:0 min,50%B;2 min 60% B;6~7 min,100% B;10~12 min,50% B。质谱条件:电喷雾离子源负离子模式(ESI+);毛细管压力:3.0 kV;离子源温度:100 ℃;脱溶剂气温度:450 ℃;脱溶剂气流量:650 L/h;锥孔气流量:50 L/h;扫描方式:多反应监测MRM。
1.6 正丁醇萃取相分离纯化和抑菌效果
采用柱色谱法。称取15 g正丁醇萃取物,加入50 mL蒸馏水,充分溶解后经AB-8大孔树脂柱层析,依次用2倍柱体积的乙醇水洗脱体系(蒸馏水、25%乙醇、50%乙醇、75%乙醇、100%乙醇)洗脱,流速为20 mL/min,分别收集各部分洗脱液,减压浓缩,冷冻干燥得到5种洗脱物。
分别称质量1 g上述5种洗脱物溶解于10 mL无菌水中,配成100 mg/mL的溶液,再依次用无菌水稀释成50和25 mg/mL,用0.22m醋酸纤维膜过滤[18]。采用抑菌圈法和菌丝干质量法,再测定黄曲霉毒素含量,具体方法同1.5.1、1.5.2和1.5.3。
1.7 活体上的验证试验
用75%乙醇对玉米和花生籽粒进行表面消毒,粉碎成较大颗粒,用无菌水调节含水量至20%以上,装入培养皿,接种1 mL黄曲霉孢子悬液(1.0×106mL),再加入100 mg/mL75%乙醇洗脱物,混匀,以等量的无菌水作为对照,每隔24 h检测黄曲霉菌的生长情况,5 d后测定黄曲霉毒素含量。
1.8 75%乙醇洗脱物中的活性物质鉴定
将75%乙醇洗脱物用50%甲醇(体积比)溶解配制成浓度5 mg/mL,于10 000 r/min离心20 min,取上清液进飞行时间液质联用仪检测。液相条件:流动相A:0.1%(体积比)甲酸-水溶液,流动相B:0.1%(体积比)甲酸乙腈;流速0.8 mL/min;检测波长280 nm;色谱柱为ZORBAX-SBC18(100 mm×4.6 mm(i.d.),1.8m,安捷伦公司);进样量5L;柱温30 ℃。质谱条件:电喷雾离子源负离子模式(ESI-),扫描范围/100~1 500;雾化气(GS1)50 psi;雾化气(GS2)50 psi;气帘气(CUR)35 psi;离子源温度550 ℃;离子源电压(IS):−4 500 V。检索谱库:Scifinder、Reaxy数据库。
1.9 数据分析
所有数据采用Microsoft Office Excel 2007和SPSS 17.0统计软件进行数据处理和分析,用检验法进行显著性检测,<0.05,认为存在显著性差异。试验结果采用平均值±标准误的形式表示。
2 结果与分析
2.1 油茶籽粕不同溶剂萃取相的抑菌效果
2.1.1 对抑菌圈直径的影响
本研究采用80%甲醇、乙酸乙酯、正丁醇依次对油茶籽粕进行梯度萃取,每种溶剂的萃取得率有所不同(表1),乙酸乙酯相得率最低,仅2.44%,其次是水相,得率为16.61%,正丁醇的极性最大,其萃取得率最高,为30.25%。
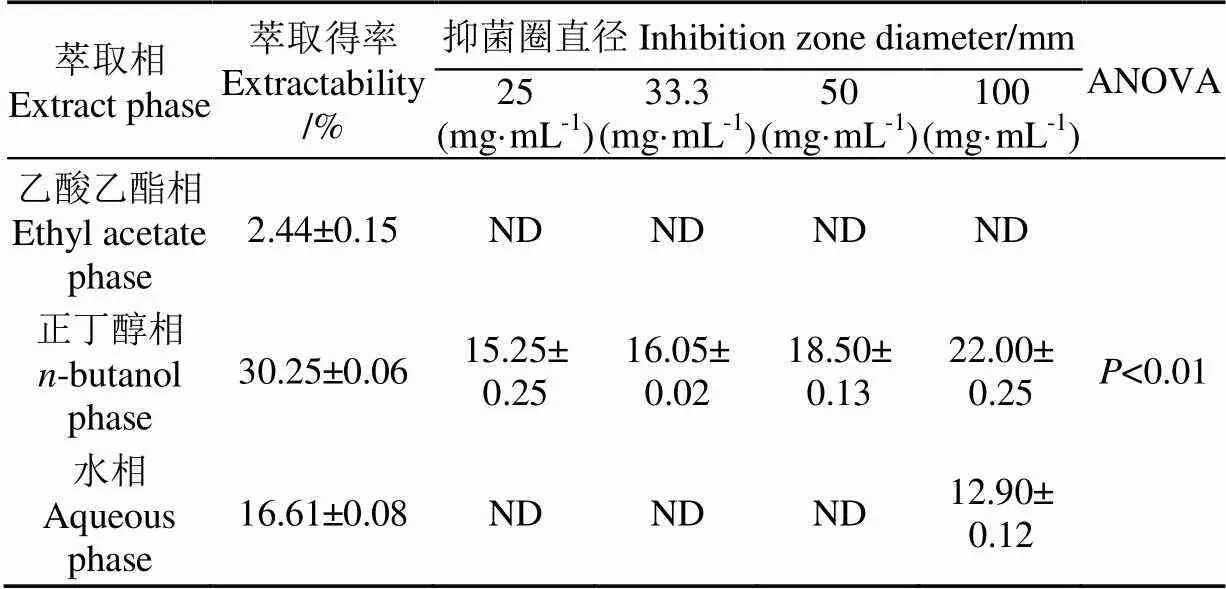
表1 油茶籽粕不同溶剂萃取相的得率和抑菌效果(抑菌圈直径)
注:ND为无抑菌圈,下同。
Note: ND is not detectable, the same below.
3种萃取相(乙酸乙酯相、正丁醇相和水相)对黄曲霉菌表现出不同的抑制活性(表1)。正丁醇相对黄曲霉菌的生长有明显的抑制效果,且随浓度增大,抑菌效果增强,抑菌圈由25 mg/mL时的15.25 mm增大到100 mg/mL时的22.00 mm。相比之下,水相对黄曲霉的抑菌效果较弱,仅在高浓度(100 mg/mL)时有抑菌效果,抑菌圈直径仅为12.90 mm。乙酸乙酯相对黄曲霉菌生长无抑菌效果,各浓度均无抑菌圈出现。
2.1.2 对菌丝干质量的影响
图1可见,乙酸乙酯相和水相对黄曲霉菌的菌丝生长无明显的抑制效果,相反地,水相在浓度较低(25、33.5 mg/mL)时会促进菌丝的生长。相比之下,正丁醇相明显抑制了黄曲霉菌丝的生长,菌丝干质量显著低于乙酸乙酯相和水相(<0.01),且随着浓度增大菌丝干质量明显减少,从25 mg/mL时的0.16 g减少到了100 mg/mL时的0.12 g,比对照减少了42.88%,可见,正丁醇萃取相浓度越大,对菌丝的抑制效果越好。
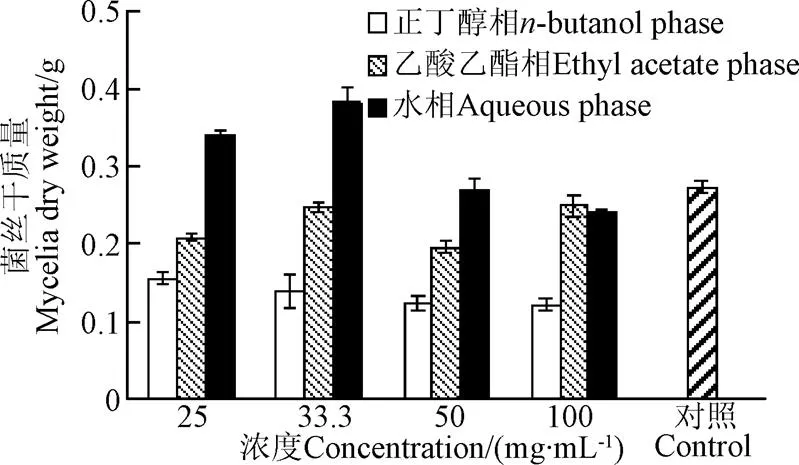
图1 油茶籽粕不同溶剂萃取相对黄曲霉菌丝干质量的影响
2.1.3 对黄曲霉菌产毒的影响
液质联用仪检测结果发现(表2),所有样品(乙酸乙酯相、正丁醇相、水相和对照)的PDB培养液中均未检出AFB2,添加乙酸乙酯相和水相的PDB培养液检出了AFB1,而在正丁醇相的处理中未检出AFB1,可见,正丁醇萃取物能有效抑制AFB1的产生。

表2 油茶籽粕不同溶剂萃取相对黄曲霉菌产毒的影响
注:不同小写字母表示在0.05 水平上差异显著,下同。
Note: Lower letters are significantly different on the0.05 level, the same below.
AFB1含量和菌丝生长的相关性分析结果表明,AFB1含量和抑菌圈直径呈显著负相关(=−0.937 6,=0.002 1),与菌丝干质量呈显著正相关(=0.581 0,=0.005 8)。可见,油茶籽粕80%甲醇提取物的正丁醇萃取相能有效抑制黄曲霉菌的生长和AFB1产生。
2.1.4 抑菌物质的初步确定
对正丁醇和乙酸乙酯两种溶剂进行了抑菌试验,结果发现(表3),二者对黄曲霉菌无明显的抑制效果,由此可以排除正丁醇和乙酸乙酯这2种溶剂本身对试验结果的干扰。此外,前人研究发现油茶籽粕正丁醇提取物中的主要化学成分是茶皂素[21-22],对油茶籽中提取的茶皂素的抑菌结果见表3,茶皂素对黄曲霉菌无抑制效果。由此推测对黄曲霉菌起抑制作用的是正丁醇萃取物中的其他活性成分,有必要进一步对正丁醇萃取相进行纯化和鉴定。
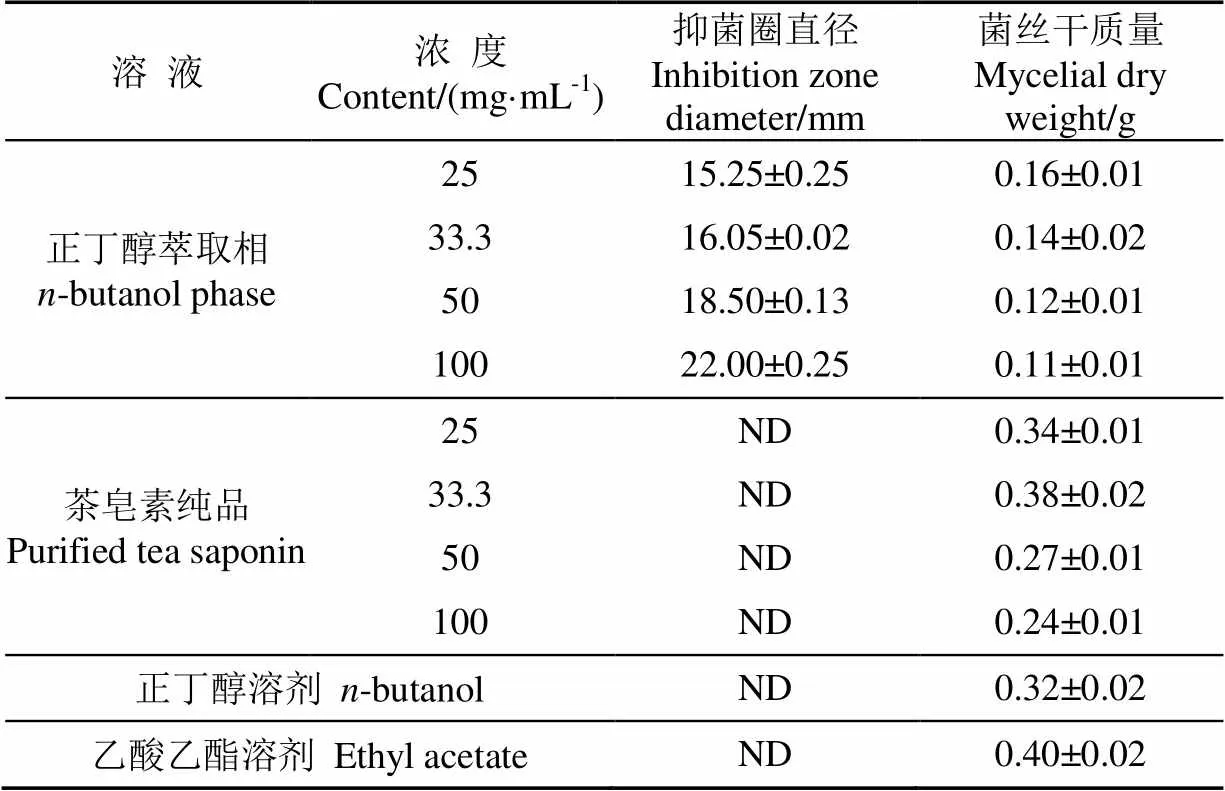
表3 正丁醇、乙酸乙酯、正丁醇萃取相和茶皂素的抑菌效果对比
2.2 正丁醇萃取相梯度洗脱物的抑菌效果
2.2.1 对抑菌圈直径的影响
由表4可见,正丁醇相的各洗脱物中,75%乙醇洗脱物对黄曲霉菌生长有明显的抑制效果,在50和100 mg/mL时抑菌圈直径分别为146.6和163.7 mm,且二者呈极显著差异(<0.01),在25 mg/mL时未出现抑菌圈,可见其最小抑菌浓度为50 mg/mL。其余各洗脱物对黄曲霉菌生长均无抑菌效果,未出现抑菌圈。
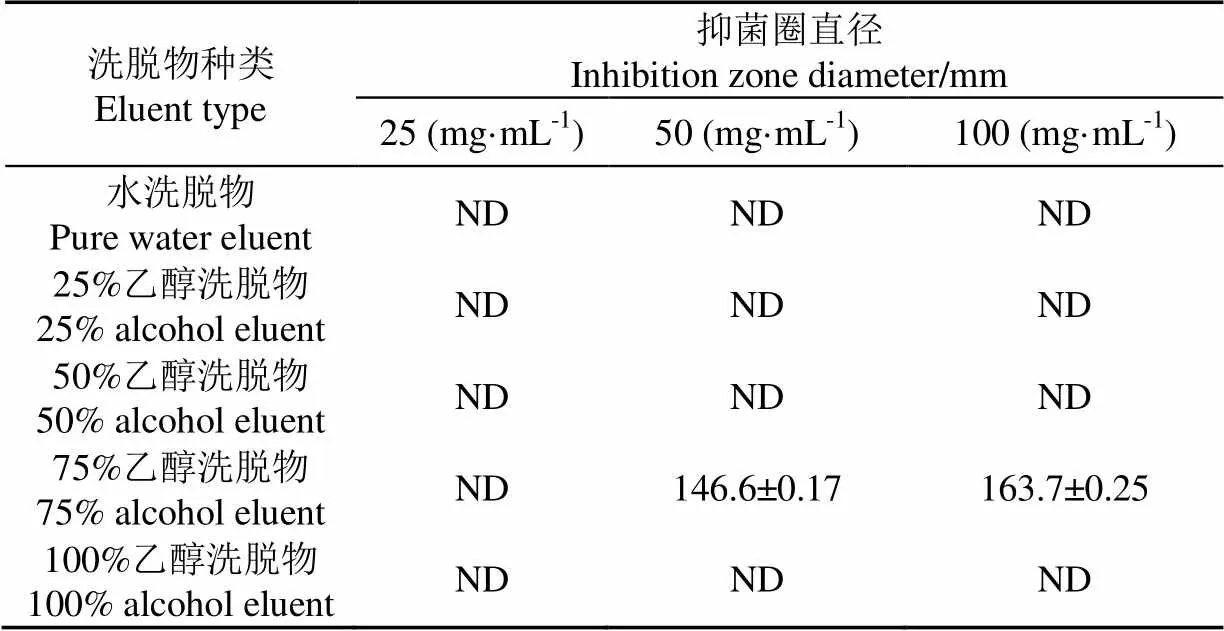
表4 正丁醇萃取相各洗脱物对黄曲霉菌的抑制效果
2.2.2 对菌丝干质量的影响
液体培养过滤后菌丝质量结果显示(图2),与对照相比,水洗脱物对黄曲霉菌丝生长无抑制作用甚至会促进生长,25%乙醇洗脱物和50%乙醇洗脱物对黄曲霉菌菌丝生长有少量的抑制作用但效果不显著(>0.05),100%乙醇洗脱物基本无抑制作用;75%乙醇洗脱物对黄曲霉菌的菌丝生长有显著的抑制作用(<0.01),且浓度越大,菌丝生长量越低,这一结果与固体培养结果一致。
2.2.3 对黄曲霉菌产毒的影响
表5可见,所有样品均未检测出AFB2,添加不同浓度的水洗脱物和25%乙醇洗脱物的PDB培养液中均含有AFB1,且含量较高,可见,水洗脱物和25%洗脱物对AFB1的产生无明显的抑制作用;50%乙醇洗脱物在25 mg/mL浓度时AFB1含量与对照相比有所下降,但未能完全抑制产毒,当浓度升高时才能完全抑制产毒;75%乙醇洗脱物对黄曲霉产毒能力的抑制效果较明显,各浓度处理均未检出AFB1;100%乙醇洗脱物仅在高浓度(100 mg/mL)时能完全抑制AFB1的产生。
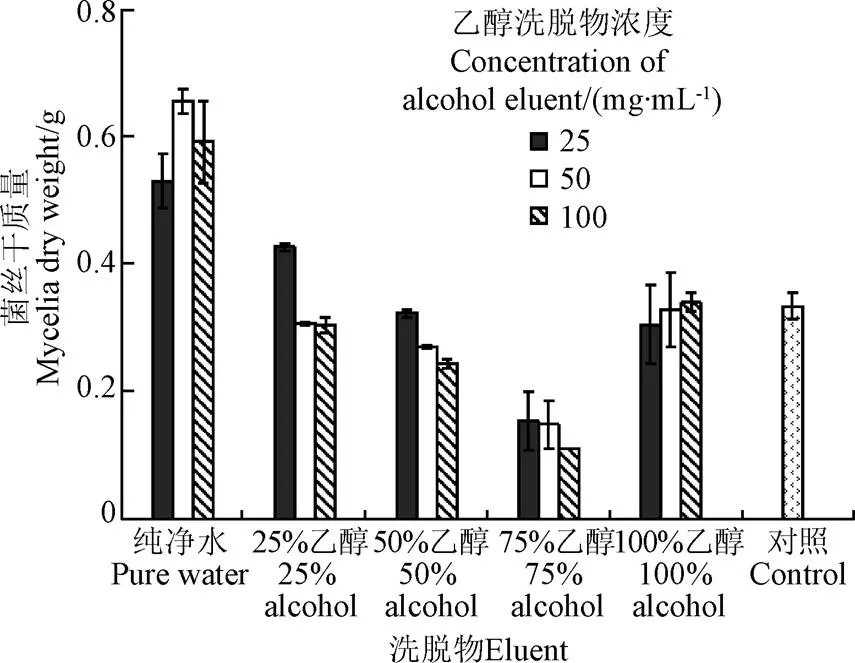
图2 正丁醇萃取相各洗脱物对黄曲霉菌菌丝干质量的影响

表5 正丁醇萃取相各洗脱物中黄曲霉毒素含量
综上分析表明,油茶籽饼粕梯度萃取的正丁醇萃取相各洗脱物中,75%乙醇洗脱物能够显著抑制黄曲霉菌的生长,同时也能有效抑制黄曲霉毒素的产生。
2.2.4 活体验证试验
由活体验证试验可见,培养24 h时各处理及对照均有少量的黄曲霉菌生长,肉眼观察无明显区别,随后对照的黄曲霉菌生长明显加快,至48 h后玉米和花生表面均覆盖了一层白色菌丝,籽粒间开始出现黏连,而添加75%乙醇洗脱物后黄曲霉菌生长明显减缓,玉米和花生籽粒清晰可见(图3),此后处理与对照的区别更加明显,至72 h时对照样品上覆着一层较厚的菌丝膜,玉米和花生籽粒被菌丝黏连成块状,而75%乙醇洗脱物处理的样品籽粒仍为独立分开,仅在单个颗粒上出现少量菌丝。由此可见,75%乙醇洗脱物对黄曲霉菌生长有明显的抑制作用。5 d后对黄曲霉毒素进行测定,结果见表6,与对照相比,加入75%乙醇洗脱物后,玉米和花生中的AFB1含量呈现极显著的下降水平(<0.01)。以上结果有力验证了75%乙醇洗脱物对黄曲霉菌生长和产毒的抑制作用。

图3 75%乙醇洗脱物对玉米、花生中黄曲霉菌生长的影响(48 h)
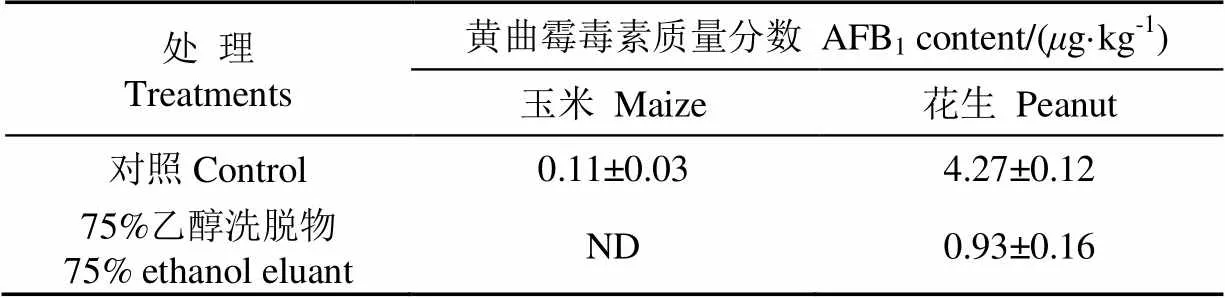
表6 75%乙醇洗脱物对玉米、花生中黄曲霉产毒的影响(5 d)
2.3 抑菌物质的结构鉴定
对75%乙醇洗脱物进行负离子模式分析,得到紫外色谱图(图4)。根据高分辨质谱结果拟合可能的分子式,通过Scifinder和Reaxy数据库检索结合二级质谱信息,推测化合物结构,分析鉴定出3种化合物。
化合物1:该化合物的出峰时间为9.822,[M-H]-为755.204 8,根据高分辨质谱结果拟合的分子式为C33H40O20,根据二级质谱,化合物母核质荷比为285,结构中存在3个6碳糖结构,根据Scifinder和Reaxy数据库检索,推测该化合物为山奈酚-3--[-D-吡喃葡萄糖苷-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷](kaempferol-3--[-D-glucopyranosyl-(1→3)----rhamnopyranosyl-(1→6)---D-galactopyranoside] )。
化合物2:该化合物的出峰时间为10.61,[M-H]-为725.1940,根据高分辨质谱结果拟合的分子式为C32H38O19,根据二级质谱,化合物母核质荷比为285,结构中存在1个5碳糖结构,根据Scifinder和Reaxy数据库检索和推测该化合物为山奈酚-3--[2---D-吡喃木糖基-6---L-吡喃鼠李糖]--D-吡喃葡萄糖苷(kaemferol-3--[2---D-xylopyranosyl-6----rhamnopyranosyl]--D-glucopyranoside)。
化合物3:该化合物的出峰时间为15.26,[M-H]-为901.2427,根据高分辨质谱结果拟合的分子式为C42H46O22,根据二级质谱,化合物母核质荷比为285,比化合物1多一个多羟基香豆酸结构,根据Scifinder和Reaxy数据库检索和推测该化合物为山奈酚-3--(6-反式-对-香豆酰基)--D-吡喃葡萄糖基-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷(kaempferol-3--[6-trans-p-coumaroyl)-D-glucopyranosyl-(1→3)---L-rhamnopyranosyl-(1→6)---D-galactopyranoside])。
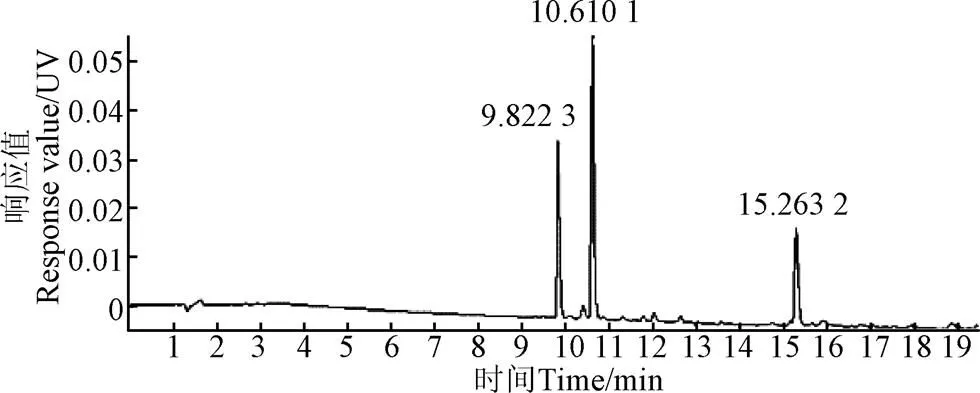
图4 75%乙醇洗脱物紫外(320 nm)色谱图

表7 75%乙醇洗脱物中化合物的UPLC-Q-TOF/MS分析参数
3 讨 论
植物材料中活性成分的成功预测在很大程度上取决于提取过程中所用溶剂的种类,传统上许多活性成分是用水作为溶剂进行提取的,但甲醇和乙醇提取物显示出更强的效果[23],大多数活性成分在有机溶剂中的溶解度要优于非有机溶剂[24]。本研究采用甲醇提取脱脂油茶籽饼,这是由于抑菌活性成分在80%甲醇溶剂中有更好的溶解性,而这些成分在水和其他溶剂中的不能被充分溶解[25]。
由于植物中的化学成分极其复杂,在提取活性成分时,仅用某一种溶剂有时候不可能将植物的活性组分都提取出来,因此有必要采用极性不同的几种溶剂对同一植物进行提取,使得各成分依其在不同溶剂中的溶解度差异而分离出来,从而避免最强活性物质的漏筛。本研究采用80%甲醇、乙酸乙酯、正丁醇依次对油茶籽粕进行梯度萃取,研究结果发现,甲醇和正丁醇萃取物的抑菌效果具有明显的剂量依赖效应,即浓度越大,抑菌效果越好,这一发现与前人的研究结果一致[26-27]。不同萃取相中,正丁醇的提取效率最高,萃取物抑菌效果最好,可见其中包含了更多的活性物质,有效干扰和破坏了黄曲霉菌菌丝的正常生长,这可能是由于正丁醇萃取物使得黄曲霉的细胞壁和细胞膜受到损伤,细胞生长受阻,菌丝衰败,从而导致了菌丝质量显著减少[28]。
自然界产生的黄曲霉毒素主要包括AFB1、AFG1、AFB2和AFG2(按照毒性由高到低的顺序),黄曲霉菌可产生B类毒素,寄生曲霉菌可产生B类和G类毒素[29]。其中AFB1最常被检出,也是目前已知致癌性最强的天然毒素,AFM1、AFG1次之,AFB2、AFG2较弱[30,11]。在本研究中,所有样品均未检出AFB2,仅有AFB1被检出,这与之前的研究结果一致[15]。AFB1是目前已知最强的致癌性化学物之一,被FAO和WHO列为I级致癌物,是诱发恶性肿瘤原发性肝细胞癌的主要因素之一。
适于真菌生长的培养基有马铃薯葡萄糖琼脂培养基、沙氏培养基、察氏培养基、麦芽汁琼脂培养基、酵母浸膏蔗糖培养基等,黄曲霉毒素的产生需要一定的条件,影响黄曲霉毒素合成的因素很多,如菌种、碳源、温度、空气、湿度等因素[31]。马群飞[32]、庄振宏[33]等对不同培养基对比研究发现,与其他培养基质相比,大米培养基更有利于AFB1的产生。也有研究认为,YES培养基可以较好地诱导黄曲霉菌的产毒[34-35]。本研究中使用的培养基为PDA和PDB培养基,试验结果显示AFB1的产量普遍偏低,分析其原因可能与所选择使用的培养基种类有关,也有可能是所选用的黄曲霉菌种本身的产毒能力偏低。
油茶籽粕正丁醇提取物中的主要化学成分是茶皂素[21-22]。茶皂素除具有发泡、乳化、去污、洗涤等用途外,还具有多种生理活性和生理功能,对一些病原菌有较好的抑制效果,如酵母(),黑曲霉(),青霉(),大肠杆菌(),产朊假丝酵母(),蕈状芽孢杆菌(),白色念珠菌()和枯草芽孢杆菌()[36-42]。然而,茶皂素对于黄曲霉菌抑制作用的研究还未见报道。本研究中正丁醇萃取物对黄曲霉菌的生长和产毒有明显的拮抗效果,而茶皂素对黄曲霉菌的生长无抑制效果,可见油茶籽粕正丁醇萃取物中对黄曲霉菌起抑制作用的不是茶皂素,而是茶皂素以外的其他活性成分。这为开发为可以广泛用于食品、医药等领域的植物源抑菌剂提供了良好的理论基础,也为油茶籽饼粕的开发利用提供了更好的途径,提高了油茶副产物利用水平。
4 结 论
本研究发现,油茶籽饼80%甲醇提取液的正丁醇萃取物对黄曲霉菌的生长和产毒有明显的拮抗效果,且随浓度增大抑菌效果增强,100 mg/mL时抑菌圈直径达22.00 mm,菌丝干质量相比对照减少了42.88%,黄曲霉毒素未被检出。对正丁醇萃取物进一步纯化鉴定,确定抑菌活性成分为3种黄酮苷类化合物:山奈酚-3--[-D-吡喃葡萄糖苷-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷],山奈酚-3--[2---D-吡喃木糖基-6---L-吡喃鼠李糖]--D-吡喃葡萄糖苷,山奈酚-3--(6-反式-对-香豆酰基)--D-吡喃葡萄糖基-(1→3)---L-吡喃鼠李糖-(1→6)---D-吡喃半乳糖苷。
[1] 庄瑞林. 中国油茶(第二版)[M]. 北京:中国林业出版社,2008.
[2] 姚小华. 油茶资源与科学利用[M]. 北京:科学出版社,2012.
[3] 王亚萍,费学谦,石晓丽,等. 采收期和处理方法对油茶籽及其油脂营养物质积累的影响[J]. 中国油脂,2017,42(4):20-23.
Wang Yaping, Fei Xueqian, Shi Xiaoli, et al. Effect of harvest time and treatment methods on nutrient accumulation of oil-tea camellia seed and its oil[J]. China Oils and Fats, 2017, 42(4): 20-23. (in Chinese with English abstract)
[4] 费学谦. 油茶籽油加工业现状、问题及对策分析[J]. 食品工业科技,2011(10):449-452.
Fei Xueqian. Study on current status, problems and countermeasures of oil-tea camellia seed oil processing industry[J]. Science and Technology of Food Industry, 2011(10): 449-452. (in Chinese with English abstract)
[5] Yu Jiujiang. Current understanding on aflatoxin biosynthesis and future perspective in reducing aflatoxin contamination[J]. Toxin, 2012, 4(11): 1024-1057.
[6] Kensler T W, Roebuck B D, Wogan G N, et al. Aflatoxin: A 50-year odyssey of mechanistic and translational toxicology[J]. Toxicological Sciences, 2011, 120(1): 28-48.
[7] Saori A, Nancy P K.[J]. Annual Reviews of Phytopathology, 2011, 49: 107-133.
[8] Allameh A, Safamehr A, Mirhadi S, et al. Evaluation of biochemical and production parameters of broiler chicks fed ammonia treated aflatoxin contaminated maize grains[J]. Animal Feed Science Technology, 2005, 122(3/4): 289-301.
[9] Elsamra I A, Shama S M, Hamza A S, et al. Effect of some mould inhibitors and herbal plants on mycotoxins production byand Fusarium verticilloides in vitro and in stored corn grains[J]. Archives Phytopathology Plant Protection, 2012, 45(15): 1861-1878.
[10] Teniola O D, Addo P A, Brost I M, et al. Degradation of aflatoxin B1by cell-free extracts ofandsp. nov. DSM44556T[J]. International Journal of Food Microbiology, 2005, 105(2): 111-117.
[11] Ji Ning, Diao Enjie, Li Xiangyang, et al. Detoxification and safety evaluation of aflatoxin B1in peanut oil using alkali refining[J]. Journal of Science Food Agriculture, 2016, 96(12): 4009-4014.
[12] Verheecke C, Liboz T, Mathieu F. Microbial degradation of aflatoxin B1: Current status and future advances[J]. International Journal of Food Microbiology, 2016, 237(21): 1-9.
[13] 孙雪,郗存显,唐柏彬,等. 复合免疫亲和柱净化-液相色谱-串联质谱法测定动物源食品中6种黄曲霉毒素和6种玉米赤霉醇类真菌毒素残留量[J]. 分析化学,2016,44(6):970-978.
Sun Xue, Xi Cunxian, Tang Baibin, et al. Determination of aflatoxins and zeranols in animal-originated foods by high performance liquid chromatography-tandem mass spectrometry combined with immunoaffinity clean-up column[J]. Chinese Journal of Analytical Chemistry, 2016, 44(6): 970-978. (in Chinese with English abstract)
[14] 石程仁,张初署,杜咏梅,等. 不同植物抑制剂对黄曲霉菌生长和产毒的影响[J]. 食品安全质量检测学报,2017(8):2892-2897.
Shi Chengren, Zhang Chushu, Du Yongmei, et al. Effects of different plant inhibitors on the growth and toxin production of[J]. Journal of Food Safety & Quality, 2017(8): 2892-2897. (in Chinese with English abstract)
[15] Luo Fan, Fei Xueqian. The research of impact factor of aflatoxins in oil-tea camellia seed and oil-tea camellia seed cake[J]. Advanced Materials Research, 2012(550/551/552/553): 1946-1951.
[16] 王亚萍,石晓丽,姚小华, 等. 适宜含水率保持油茶籽贮藏品质[J]. 农业工程学报,2016,32(4):256-261.
Wang Yaping, Shi Xiaoli, Yao Xiaohua, et al. Suitable moisture content maintaining storage quality of oil-tea camellia seed[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE)2016, 32(4): 256-261. (in Chinese with English abstract)
[17] 封勇,舒青龙,左爱仁,等. 梯度稀释及微量点样法在环境-变形菌分离中的应用[J]. 生物技术,2015,25(3):281-285.
Feng Yong, Shu Qinglong, Zuo Airen, et al. Application of gradient dilution and simple drop plate method in isolation of environmentalproteobacteria[J]. Biotechnology, 2015, 25(3): 281—285. (in Chinese with English abstract)
[18] Zhang Yongwen, Peng Huashong, Huang Wei, et al. Facile preparation and characterization of highly antimicrobial colloid Ag or Au nanoparticles[J]. Journal of Colloid Interface Science, 2008, 325(2): 371—376.
[19] Thakur D, Das S, Sabhapondit S, et al. Antimicrobial activities of tocklai vegetative tea clones[J]. Indian Journal of Microbiology, 2011, 51(4): 450-455.
[20] Mohammedi Z, Atik F. Fungitoxic effect of natural extracts on mycelial growth, spore germination and aflatoxin B1production of[J]. Australian Journal of Crop Science, 2013, 7(3): 293-298.
[21] 靳燕,孙荣奇,吴达俊. 油茶皂甙提纯分离和结构鉴定方法综述[J]. 化学世界,2000(5):231-234.
Jin Yan, Sun Rongqi, Wu Dajun. Reviews on extraction, purification and characterization of camellia saponin[J]. Chemical World, 2000(5): 231-234. (in Chinese with English abstract)
[22] 肖瑜,刘以清,龚秋实,等. 油茶饼粕中茶皂素的提取纯化方法及应用研究进展[J]. 桂林理工大学学报,2014,34(1):113-118.
Xiao Yu, Liu Yiqing, Gong Qiushi, et al. Extraction, purification and application of tea saponin from[J]. Journal of Guilin University of Technology, 2014, 34(1): 113-118. (in Chinese with English abstract)
[23] Ye Yang, Li Xiqiang, Tang Chunping. Natural products chemistry research 2006`s progress in China[J]. Journal of Natural Medicines, 2008, 6(1): 70-78.
[24] Eduardo S, Norma H, Santos G. Inhibition of growth and mycotoxin production ofandby extracts ofe species[J]. International Journal of Food Microbiology, 2005, 98(3): 271-279.
[25] Boer H J D, Kool A, Broberg A, et al. Anti-fungal and anti-bacterial activity of some herbal remedies from Tanzania[J]. Journal of Ethnopharmacology, 2005, 96(3): 461-469.
[26] Igbinosa O O, Igbinasa E O, Aiyegoro O A. Antimicrobial activity and phytochemical screening of stem bark extracts from(Linn.)[J]. African Journal of Pharmacy and Pharmacology, 2009, 3(2): 58-62.
[27] Wakirwa J H, Ibrahim P, Madu S J. Phytochemical screening and in vivitro antimicrobial analysis of the ethanol stem bark extract ofLinn.(Euphorbiaceae)[J]. International Research Journal Pharmacy and Pharmacology, 2013, 4(3): 97-100.
[28] 马利平,郝变青,王静,等. 拮抗菌B96-II对芦笋枯萎菌的抑菌作用[J]. 应用与环境生物学报,2009,15(6):861-865.
Ma Liping, Hao Bianqing, Wang Jing, et al. Inhabitation of antagonistic bacterium B96-II to fusarium oxysporum[J]. Chinese Journal of Applied & Environmental Biology, 2009, 15(6): 861-865. (in Chinese with English abstract)
[29] Ines J, Alejandra C, Maria T G, et al. Aflatoxins and ochratoxin A and theircausal species in Tunisian cereals[J]. Food Additives & Contaminants: Part B, 2017, 10(1): 51-58.
[30] Limbikani M, Sulyok M, Njoroge Samuel M C, et al. Uncommon occurrence ratios of aflatoxin B1, B2, G1, and G2in maize and groundnuts from Malawi[J]. Mycotoxin Research, 2015, 31(1): 57-62.
[31] Shilpa H, Gurupada B B. Aflatoxins in food chain and their management[J]. Current Biotica, 2011, 5(2): 250-263.
[32] 马群飞,蔡一新,张荣标,等. 黄曲霉强产毒菌株的产毒规律研究[J]. 海峡预防医学杂志,1998,4(3):7-11.
Ma Qunfei, Cai Yixin, Zhang Rongbiao, et al. Study on aflatixion-producing feature of[J]. Strait Journal of Preventive Medicine, 1998, 4(3): 7-11. (in Chinese with English abstract)
[33] 庄振宏,郑传琦,汪世华. 黄曲霉培养条件的优化及黄曲霉毒素B1的提取[J]. 应用与环境生物学报,2010,16(5):724-729.
Zhuang Zhenhong, Zheng Chuanqi, Wang Shihua. Optimization ofculture conditions and extraction of Aflatoxin B1[J]. Chinese Journal of Applied & Environmental Biology, 2010,16(5): 724-729. (in Chinese with English abstract)
[34] 孙晶晶. 生态经济型作物花生和土壤中黄曲霉生防菌的筛选研究[D]. 阜新:辽宁工程技术大学,2014.
Sun Jingjing. Study on Screening of Biocontrolin Ecological Economic Crop Peanut and Soil[D]. Fuxin: Liaoning Technical University, 2014. (in Chinese with English abstract)
[35] 张初署,刘阳,邢福国,等. 七种培养基对黄曲霉分离效果的比较[J]. 核农学报,2013,27(2):208-212.
Zhang Chushu, Liu Yang, Xing Fuguo, et al. Comparison of seven media for the isolation ofgroup[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(2): 208-212. (in Chinese with English abstract)
[36] Yamauchi Y, Azuma K, Tomita M, et al. Development of a simple preparation method for tea-seed saponins and investigation on their antiyeast activity[J]. Japan Agricultural Research Quarterly, 2001, 35(3): 185-188.
[37] Tomita M, Yamamoto S, Yamaguchi K, et al. Teasaponin E1destroys the salt tolerance of yeasts[J]. Journal of Bioscience and Bioengineering, 2000, 90(6): 637-642.
[38] 侯如燕,宛晓春,吴慧平. 油茶总皂甙抑菌活性的初步研究[J]. 食品科学,2006,27(1):51-54.
Hou Ruyan, Wan Xiaochun, Wu Huiping. Preliminary studies on antimicrobial action of tea saponin[J]. Food Science, 2006, 27(1): 51-54. (in Chinese with English abstract)
[39] 魏婷婷,崔晓芳,文旭,等. 油茶粕中茶皂素纯化方法与抗菌活性研究[J]. 中国油料作物学报,2011,33(6):616-621.
Wei Tingting, Cui Xiaofang, Wen Xu, et al. Purification technology and biological activity of theasaponin from camellia cake[J]. Chinese Journal of Oil Crop Sciences, 2011, 33(6): 616-621. (in Chinese with English abstract)
[40] 黄继光,陈秀贤,徐汉虹,等. 茶皂素对12种植物病原菌的抑菌活性[J].华中农业大学学报,2013,32(2):50-53.
Huang Jiguang, Chen Xiuxian, Xu Hanhong, et al. Studies on inhibitory activity of tea saponin against twelve plant pathogenic fungi[J]. Journal of Huazhong Agricultural University, 2013, 32(2): 50-53. (in Chinese with English abstract)
[41] 文莉,芦苇,蒋倩,等. 茶皂素毒性刺激性试验及抑菌作用研究[J]. 中国油脂,2011,36(6):58-60.
Wen Li, Lu Wei, Jiang Qian, et al. Toxicity, irritation and bacteriostasis of tea saponin[J]. China Oils and Fats, 2011, 36(6): 58-60. (in Chinese with English abstract)
[42] 刘蓉,张利蕾,范亚苇,等. 茶渣中粗茶皂素的纯化及其抗氧化和抑菌活性[J]. 南昌大学学报:工科版,2013,35(1):17-21.
Liu Rong, Zhang Lilei, Fan Yawei, et al. Purification, Antioxidant activity and bacteriostasis effect of tea saponin from tea seed residues[J]. Journal of Nanchang University (Engineering & Technology), 2013, 35(1): 17-21. (in Chinese with English abstract)
Inhibitory effect ofand component analysis of methanol extraction from camellia seed cake
Wang Yaping, Fei Xueqian※, Lu Kuankuan, Yao Xiaohua, Guo Shaohai, Wang Kailiang
((),311400,)
() is a well-known diffused fungus that contaminates a great number of crops used for human and animal consumption. How to effectively prevent the contamination becomes a significant problem. Camellia (Abel.) is one of the four dominant, woody, oil species in the world. Oil from camellia seeds is rich in essential fatty acids and vitamins. This oil can alleviate malnutrition by balancing human nutrition to benefit human health, and it conforms to the consumption trends of modern edible oils, along with the utilization of its by-products is getting more and more attention. In recent years, the prevention and treatment ofand AFs by plant sources and active microbial substances have attracted more attention. Our previous study shows that camellia seed cake is not susceptible to. Based on the result, we propose that there may be a certain natural antagonistic substances that can inhibit the growth ofand the production of AFs in camellia seeds. This study was designed to evaluate the antifungal effect of the active substance in camellia seed cake on the growthand toxigenicity throughandantifungal tests, to make a determination of antimicrobial substances contained in the camellia seed cake. Camellia seed cake was extracted by eighty percent methanol (v/v), the filtrate was extracted with ethyl acetate and saturated-butanol. Among the extracts, the-butanol phase exhibited apparent inhibition activity on the growth and aflatoxin production ofThe concentration of 100 mg/mL worked best, because the inhibitory zone diameter was 22.00 mm, the mycelial dry weight was 42.88% less than the control, both of the two indicators were significantly better than other treatments (<0.01), and no AFs were detected. Whereas the aqueous phase and ethyl acetate phase exhibited weak antifungal activity and no activity, respectively. In addition, the-butanol phase inhibited the production of aflatoxin B1(AFB1) ofeffectively, AFB1was not detected in all concentration treatments. The main chemical component of-butanol extract phase of eighty percent methanol extract in camellia seed cake was tea saponin, the research showed that tea saponin had no inhibitory effect on. Therefore, it was speculated that the other active component (s) in the-butanol extract phase had inhibitory effect on.-Butanol extract phase was separated and purified by means of AB-8 macroporous absorbent column chromatography, among the macroporous resin fraction of 0%, 25%, 50%, 75%, and 100% ethanol (v/v), the 75% ethanol fraction showed the highest antifungal activity, the concentration of 100 mg/mL worked best, because the inhibitory zone diameter was 163.7 mm, the mycelial dry weight was significantly lower than the control, both of the two indices were significantly superior to other treatments (<0.01), and AFs were undetected. The 75% ethanol fraction was assayed by ultra-performance liquid chromatography-quadrupole time-of-fight mass spectrometry (UPLC-Triple-TOF/MS). The three compounds were identified which were 1) kaempferol-3--[-D-glucopyranosyl-(1→3)---L-rhamnopyranosyl-(1→6)---D-galactopyranoside]; 2) kaemferol-3-- [2---D-xylopyranosyl-6---L-rhamnopyranosyl]--D-glucopyranoside; and 3) kaempferol-3--[6-trans-p-coumaroyl)--D-glucopyranosyl-(1→3)---L-rhamnopyranosyl-(1→6)---D-galactopyranoside]. This study provides a reference and a guide for research and development of an antifungal agent for, and meanwhile broadens utilization of the by-products of camellia seed.
seeds; extraction; active compound; inhibition;
2019-01-10
2019-04-20
国家自然科学基金(31400577);中央级公益性科研院所基本科研业务费专项资金(CAFYBB2014QB036)
王亚萍,助理研究员,主要从事经济林采后处理及质量控制研究。Email:wypeasy@163.com
费学谦,研究员,主要从事经济林产品加工利用研究。Email:fxq6565@163.com
10.11975/j.issn.1002-6819.2019.11.037
S789.7
A
1002-6819(2019)-11-0322-08
王亚萍,费学谦,陆宽宽,姚小华,郭少海,王开良. 油茶籽饼粕中甲醇提取物抑制黄曲霉菌效果及成分分析[J]. 农业工程学报,2019,35(11):322-329. doi:10.11975/j.issn.1002-6819.2019.11.037 http://www.tcsae.org
Wang Yaping, Fei Xueqian, Lu Kuankuan, Yao Xiaohua, Guo Shaohai, Wang Kailiang. Inhibitory effect ofand component analysis of methanol extraction from camellia seed cake[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(11): 322-329. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2019.11.037 http://www.tcsae.org
