后纵韧带骨化致病相关候选基因及单核苷酸多态性研究进展*
2019-07-23陈峰江诗陶马鸿杰胡建华
陈峰江诗陶△ 马鸿杰胡建华**
(1.中国医学科学院北京协和医学院北京协和医院骨科,北京100730;2.郑州市骨科医院骨科,郑州450052)
后纵韧带骨化(ossification of posterior longitudinal ligament,OPLL)起病多隐匿,患病早期常无明显临床症状,随病情进展,后纵韧带块状骨化组织出现,脊髓因此受到由前向后的直接压迫,导致脊髓灰质压缩变形,进而引起运动、感觉神经细胞损伤、坏死,同时脊髓白质亦因压迫而出现脱髓鞘改变,在这个慢性病程中,如果压迫损伤加重则可能出现脊髓坏死加重或脊髓软化病变,造成患者神经功能障碍,严重影响生活质量,给家庭和社会带来沉重负担。有研究报道OPLL更常见于东亚人群,其中以日本人群发病率最高,为1.9%~4.3%。非亚洲人群,如欧美人群,其发病率约为0.01%~1.70%[1]。导致OPLL病因很多,主要包括基因、年龄、种族、创伤、生物力学因素等,因此发病机制较为复杂。近年来在上述各个方面都有较为深入的研究尝试阐释相关病因的发病机制,随着分子生物学及基因组学的飞速发展,对OPLL相关遗传因素,特别是基因和单核苷酸多态性的研究也取得了长足的进步。本文尝试就该领域内的研究现状进行综述。
1 OPLL相关候选基因与单核苷酸多态性(sin-gencetd oyopism SNP)
OPLL受多个基因影响,结合目前已有的研究结果,与OPLL相关的热点候选基因主要包括:转化生长因子(transforming growth factor,TGF)、骨形态发生蛋白(bone morphogenetic protein,BMP)、外核苷酸焦磷酸酶/磷酸二酯酶1(ectonucleotide pyrophosphatase/phosphodiesterase 1,ENPP1)、人类白细胞抗原(human leucocyte antigen,HLA)、胶原蛋白(collagen,COL)和成纤维生长因子受体(fibroblast growth factor receptor,FGFR)等。
1.1 TGF-β家族和SNP
TGF-β是一组新近发现的调节细胞生长和分化的超家族,包含超过40个成员,包括TGFβs,Nodal,Activin和BMPs[2]。 有研究[2]表明TGF-β/BMPs信号传导及其与MAPK,Wnt,Hedgehog,Notch和FGF信号通路的交互作用在骨形成中起重要作用。TGF-β在骨和软骨中大量存在,其中还含有大量TGF-β靶细胞。TGF-β通过自分泌和旁分泌维持和扩增间充质干细胞(mesenchymal stem cells,MSC)/祖细胞和成骨细胞祖细胞[2,3]。因此,TGF-β基因,特别是TGF-β1,由于其在调节骨代谢中的重要性,因此被认为是增加OPLL易感性的主要候选基因[4,5]。TGF-β常存在于异位骨化基质和软骨细胞中,通常不存在于MSCs和非骨化韧带中,这表明TGF-β可能在异位骨化的后期刺激骨形成[6]。
在OPLL发病机制中,TGF-β1基因外显子1的869T>C多态性已经得到较为深入的研究,但目前结果尚有一定争议。Kamiya等[4]最先报道了869T>C多态性是颈椎后纵韧带骨化易感性的遗传决定因素,869T>C的C等位基因是后纵韧带骨化遗传易感性的危险因素。然而,其他3项研究发现869T>C多态性与大规模研究中后纵韧带骨化的患病率无显著相关性[5,7,8]。然而,进一步的分层分析却显示,有869T>C的C等位基因的患者在颈椎、胸椎或腰椎中更频繁地出现后纵韧带骨化[9]。此外,TGF-β1启动子区的-509C>T多态性与后纵韧带骨化无显著相关性[8]。
2006年Horikoshi等进行一项病例对照研究表明,rs226862和rs22847的TGF-β3多态性与OPLL显著相关,其中rs226862多态性与OPLL的相关性最为显著,位于内含子深处[7]。已有研究[10]发现TGF-β受体2(TGFBR2)基因的3种多态性与OPLL相关:455-4T>A,571G>A和95-35C>T。TGF-β的生理功能在骨代谢中发挥重要作用,因此有理由认为其在OPLL的病理生理学中有关键的潜在作用,但是由于部分研究存在争议,仍需要额外的遗传和功能研究来揭示它们的真实性和具体作用。
1.2 BMP基因和SNP
作为TGF-β家族的一部分,BMPs是刺激成骨细胞和软骨细胞分化的最关键的生长因子,可以促进骨和软骨形成。BMP介导的Smad信号传导在调节许多转录因子中起重要作用,如Runx2,Osterix,Msx2,Dlx5/6和Sox9[11]。遗传和生化研究[12]表明这些转录因子对成骨细胞生成和软骨形成至关重要,其中BMP-2、BMP-7有促进骨融合的作用,缺乏BMP的调节后纵韧带部位则不易发生骨化。另外有研究表明BMP受体和BMPs在后纵韧带骨化组织中都有异常的表达模式。BMP受体在OPLL的骨化韧带中的表达水平显著高于非OPLL组织。此外,OPLL标本中后纵韧带的非骨化片段也比非后纵韧带骨化组织更大程度地表达BMP受体[13]。BMP-2存在于OPLL的相邻软骨区域的骨化基质和软骨细胞中,还存在软骨区域附近的MSC中[6]。这些研究表明BMP的分子改变先于OPLL的发展,即BMP可刺激间充质祖细胞的分化并且作为OPLL发展的起始因子发挥作用。诸多研究揭示了BMP的单核苷酸多态性与OPLL之间的关联。一些报道显示,OPLL中rs2273073(T/G)和rs235768(A/T)多态性的频率显著高于对照组。两个单核苷酸多态性都与中国汉族人群中OPLL的发生有关[14-17]。rs2273073(T/G)SNP的功能分析显示该突变可异常激活BMP-Smad信号传导。有研究[18]认为转染这种BMP2突变体可促进p-Smad1/5/8的活化,Smad4的表达并增加碱性磷酸酶(alkaline phosphatase,ALP)的活性。单轴循环拉伸可以促进成骨分化并可在有 rs2273073(T/G)的 BMP2基因突的C3H10T1/2细胞中促进BMP2的合成[14]。然而,Kim等[19]报道,在韩国人群中OPLL和非OPLL组间两种BMP2 SNP没有显著差异。这些数据的多样性可能是由于这两个种群间遗传背景的变化所致。
1.3 ENPP1
ENPP1是一种Ⅱ型跨膜金属酶,其功能是调节软组织钙化和骨组织矿化。它通过产生焦磷酸起到钙化抑制剂的作用[20]。OPLL小鼠模型能够表现脊柱韧带病理性骨化的自然发生过程,如后纵韧带骨化,髓核增大,纤维环软骨组织的再生增殖,原始间充质细胞和脊柱韧带成骨细胞的新生血管和化生等[21,22]。ENPP1在研究中被认为与该突变表型有关,即ENPP1基因的突变导致在该模型小鼠的基因组中插入了异常的终止密码子[23]。到目前为止,已发现ENPP1中的4个单核苷酸多态性与人类OPLL的发展或严重程度相关。一个是IVS15-14T,内含子15中的T→C转换[7,10],第二个是IVS20-del11T,内含子20中剪接受体位点上游11个核苷酸处的T缺失[24]。其余两个涉及编码区:A533C是外显子4中的A→C变化,其将蛋白质序列从K改变为Q,C973T是外显子9中的C→T取代。有IVS20-del11T或A533C的患者术后无疾病进展可能性为不具有该类基因人群的3倍以上。这可能成为手术预后的参考指标[25]。
1.4 胶原蛋白基因
COL主要参与骨和软骨的形成,并介导细胞外基质成分和细胞表面蛋白之间的相互作用。胶原基因的突变和/或异常表达可以在结缔组织中诱导各种病理表型。目前研究显示许多胶原蛋白基因与OPLL相关,包括 COL11A2[26-29],COL6A1[18]和 COL17A1[30]。COL11A2是XI型胶原蛋白,能与II型胶原蛋白结合,后者是软骨的主要胶原成分。已发现COL11A2与OPLL的易感性显著相关[26,29]。相关研究推测外显子7与COL11A2内含子6(-4A)中去除的外显子6一起在异位骨化过程中发挥保护作用[27,28]。另外,已发现COL6A1的3种不同单核苷酸多态性与OPLL相关:启动子(-572T),内含子 32(-29)和内含子 33(+20)[5,31-33]。Wei等[30]发现的COL17A1的两个单核苷酸多 态 性 ,即 rs805698(c.G1282A,p.G428S)和rs4918079(c.C2595T,p.R865R)与后纵韧带骨化症显著相关。尽管胶原基因在细胞外基质支架形成过程中发挥作用,并且可能促进软骨内骨化,但上述胶原基因的单核苷酸多态性在OPLL发病机制中的特定作用仍需要进一步研究。
1.5 HLA和FGFR-1
Sakou等[34]的研究表明位于6号染色体上的HLA单倍体型也涉及到脊柱韧带骨化的发生,OPLL患者的单核苷酸多态性常在调节骨、软骨、韧带代谢的基因中表现出差异;另一方面生物力学因素与脊柱生理功能失调会影响韧带组织内环境的稳态并最终导致其失去正常修复能力,最终引起炎症、加剧韧带组织异常修复,进而相关基因诱导异常表达最终导致韧带骨化的发生。
Jun等[35]为了确定FGF2基因、FGFR1、FGFR2基因和OPLL多态性之间的相关性,对9个基因(FGF2:rs1476217,rs308395,rs308397,rs3747676;FGFR1:rs13317,rs2467531;FGFR2:rs755793,rs1047100,and rs3135831)的SNPs进行了基因分型。在SNPs中,FGFR1中的SNP(rs13317)与OPLL在共显性中的易感性显著相关。并且FGFR-2的SNP与OPLL疾病状况及进展关系密切。
1.6 其他可能与OPLL相关的生物标志物
硬化蛋白(Sclerostin)和Dickkopf-1(DKK1)是Wnt/β-catenin信号拮抗剂,其在骨形成中起重要作用。Sclerostin水平反映了年龄相关骨量和周转率的变化。随着衰老,个体骨细胞的Sclerostin分泌增加[36]。删除DKK1基因的单个等位基因会导致骨形成和骨量增加。男性OPLL受试者组的血清Sclerostin水平显著高于对照组,与年龄和全髋骨密度呈正相关。血清Sclerostin和DKK1水平在男性OPLL受试者中呈负相关。在男性OPLL受试者中,Sclerostin的分泌也随着年龄的增长和更高的骨量而增加。
瘦素是一种脂肪细胞衍生的细胞因子,被认为是后纵韧带骨化发病的重要因素。Feng等[37]研究发现女性血清瘦素浓度高于男性。与非OPLL女性相比,OPLL女性中血清瘦素和ALP浓度显著增加。在OPLL受试者中,针对体质指数校正的血清瘦素浓度与ALP浓度呈负相关。在OPLL细胞中,应用瘦素后导致ALP和骨钙素(osteocalcin,OCN)的mRNA表达显着增加并形成矿化结节。研究认为瘦素在OPLL细胞中的成骨作用可以通过ERK1/2,p38 MAPK和/或JNK信号传导途径介导。
综上,后纵韧带骨化的相关候选基因及SNP位点汇总见表1。
目前还有白介素[44,45,49,58]、雌激素受体[5,49,50]、维生素[39,52]、Toll样受体[46]、α2-HS糖蛋白[5]、类视黄醇X受体-β[51]、人类血管紧张索转换酶[48]等相关基因及部分SNP位点也逐步被揭示。
2 OOPPLLLL发病机制假说
根据现有文献和理论体系,笔者提出后纵韧带骨化发病机制的初步假说。在机械应力、炎症反应、转录和通路负调控和基因突变的多重作用之下,可以引起BMP和TGF-β信号传导的异常激活,接着Smad蛋白和丝裂原活化蛋白激酶上调,Sox9,Runx2和Osterix的转录相应增加,其可以调节间充质干细胞,成骨细胞和软骨细胞的分化和增殖,并最终导致OPLL形成和进展(图1)。
3 研究展望
目前为了鉴定OPLL相关的遗传和环境因素研究者们已经进行了许多尝试。尤其最近基于大规模样本的GWAS分析显著缩小了可能含有OPLL的关联基因在染色体上的功能位置。然而,我们还需要更有效的研究方法和统计分析来鉴定来自这些区域的靶基因。尽管数十年来已经揭示了许多OPLL样本中出现的特定单核苷酸多态性,但大多数研究都基于小样本和少量样本序列。因此,基于全基因组或外显子组的下一代测序方法将有助于缩小该差距。关于TGF-β/BMP信号及下游信号转导通路的进一步研究可能会帮助我们更深入地理解后纵韧带骨化发生及进展的分子生物学机制,同时,随着研究进展我们会发现更多后纵韧带骨化发生的相关因素,理清各因素之间的主次关系及相互影响的机理将是未来研究的方向之一。
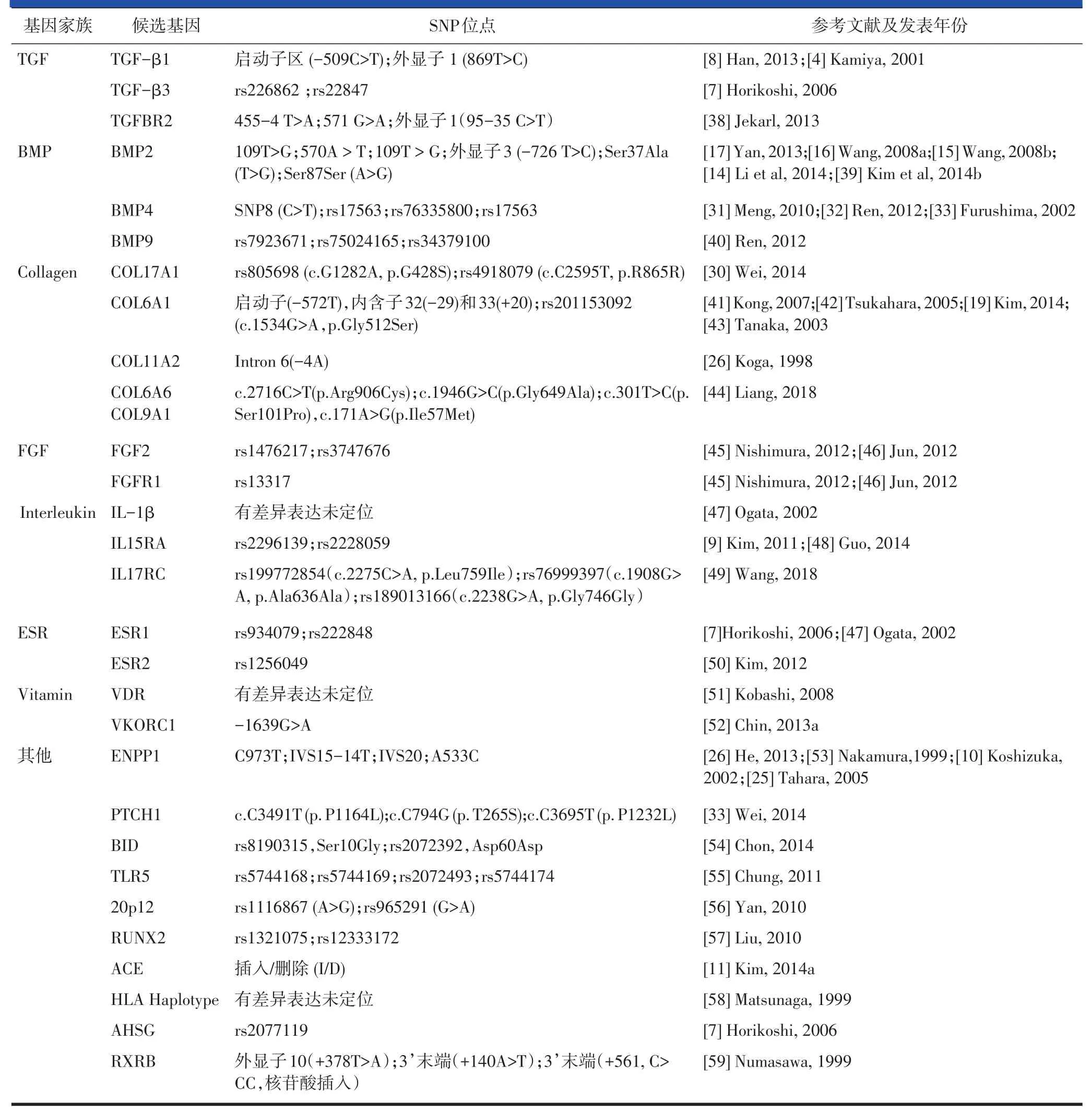
表1后纵韧带骨化候选基因及SNP研究结果汇总
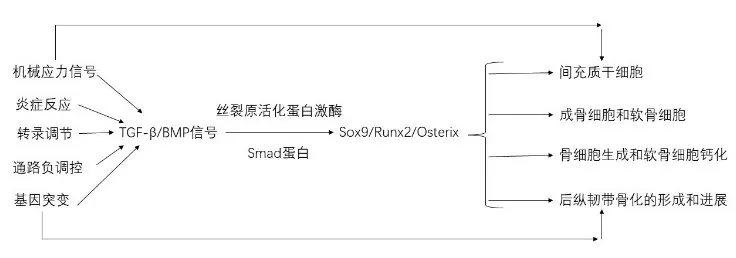
图1后纵韧带骨化发病相应因素及机制假说
