测定生物体内Cu2+的荧光探针构建及应用研究
2019-07-22李小露杨丽丽吴少平
李小露,杨丽丽,任 帆,吴少平
(1.西北大学 生命科学学院/糖生物学及药物化学国际联合实验室, 陕西 西安 710069)
重金属离子含量过多或过少都会对生物体产生较大的影响,而重金属铜在生物体内的许多生理过程中起着尤为重要的作用。人体内保持最佳的铜离子水平对平衡新陈代谢和保持人体健康至关重要。另外,由于金属铜被广泛的应用工业生产中,作为一种重要的环境污染物,工业废铜的排放也会对环境造成了很大的污染和危害[1-4]。
阿尔茨海默病 (Alzheimer′s disease, AD) 又称老年痴呆症,是一种原发性神经退行性脑病。目前普遍认为金属离子与AD有着密切的关系。金属离子诸如Cu2+一方面可以诱导β-淀粉样蛋白 (Αβ) 发生聚集,形成淀粉斑导致痴呆;另一方面具有氧化还原活性的金属离子如Cu2+与Αβ相互作用,可能会产生活性氧 (ROS) 而引起氧化应激,造成神经元功能丧失,最终导致AD的发生[5-8]。因此,设计高灵敏度、高选择性、原位检测铜离子的方法在生命科学中具有重要意义。
近年来,荧光检测技术在生命科学和环境化学领域发挥着不可替代的作用[9-11],因此,开发一种可靠,灵敏的探针,可用于有效监测铜生物系统的浓度波动是一项有吸引力和紧迫的任务。传统检测痕量铜的方法有电感耦合等离子体原子发射光谱(ICP),伏安法和原子吸收光谱法可等[12-16]。然而,这些方法存在一些缺点,包括复杂的样品处理过程和昂贵设备的需求,不能用于生理环境中铜的实时检测和监测。荧光探针由于其选择性,灵敏性,非破坏性和实时监测质量而被认为是最有力的工具[17]。
本论文设计了以罗丹明B为骨架,在罗丹明B骨架上引入噻吩杂环来合成新型的用来特异性的测定Cu2+的荧光探针。该探针上的噻吩杂环与Cu2+络合导致罗丹明B开环,在540 nm处出现一个强的发射峰,表现出强的荧光信号,从而在V(CH3CN)∶V(HEPES)=1∶1(pH=7.4) 缓冲溶液中实现了对铜离子的高灵敏高选择性荧光检测,对探针荧光性质进行了研究,探针在1~10 μmol/L范围内呈良好的线性关系,最低检测限为0.32 μmol/L。另外,由于该探针具有高选择性、高灵敏性和低毒性的特点,可以对生物体内的Cu2+进行实时监控。
1 实验部分
1.1 仪器与试剂
荧光分光光度计(F-7000,日立高新技术公司),紫外可见分光(UV-2550,日本岛津)日本岛津,超导核磁共振仪 (6001541ASP,VARIAN公司),电离飞行质谱仪(MALDI-TOFMass Spectrometer),激光共聚焦显微镜(OlympusFV-1000,日本Olympus公司),旋转蒸发仪(RE-2000A,上海亚荣生化仪器厂),循环水式多用真空泵(SHZSHZ-D(III,郑州科丰仪器设备有限公司),三用紫外分析仪(ZF-C型,上海康禾光电仪器有限公司)电子天平(BSA124S,赛多利斯科学仪器(北京)有限公司)。
1.2 探针BOTC及其参比的合成
1.2.1 化合物RBH (2a) 的合成 将罗丹明B(4.780 0 g)溶解在乙醇溶液(50 mL)中,在30分钟内缓慢滴加水合肼溶液(8 mL)。然后将反应混合物在85℃ 回流4h,直至溶液的荧光消失。反应溶液在室温下冷却并用乙酸乙酯(3×50 mL)萃取,有机相用无水Na2SO4干燥,过滤,旋干,粗产物通过硅胶柱V(DCM)∶V(EtOH)=40∶1纯化得到RBH (2a)。Rf:0.61(V(DCM)∶V(EtOH)=20∶1)。收率:95.7 %。1H NMR (600 MHz, CDCl3)δ7.94 (s, 2H), 7.52 (dd,J=11.4, 5.7 Hz, 1H), 7.49~7.44 (m, 2H), 7.33 (d,J=3.3 Hz, 1H), 7.14 (d,J=7.0 Hz, 1H), 6.91 (s, 1H), 6.66 (s, 2H), 6.35 (s, 2H), 6.27 (s, 2H), 3.32 (dd,J=14.3, 7.0 Hz, 8H), 1.15 (t,J=7.0 Hz, 12H)。13C NMR (151 MHz, CDCl3)δ176.07, 163.80, 161.51, 158.82, 142.46, 139.98, 138.03, 133.78, 132.92, 117.98, 114.52,107.93, 87.31, 87.10,
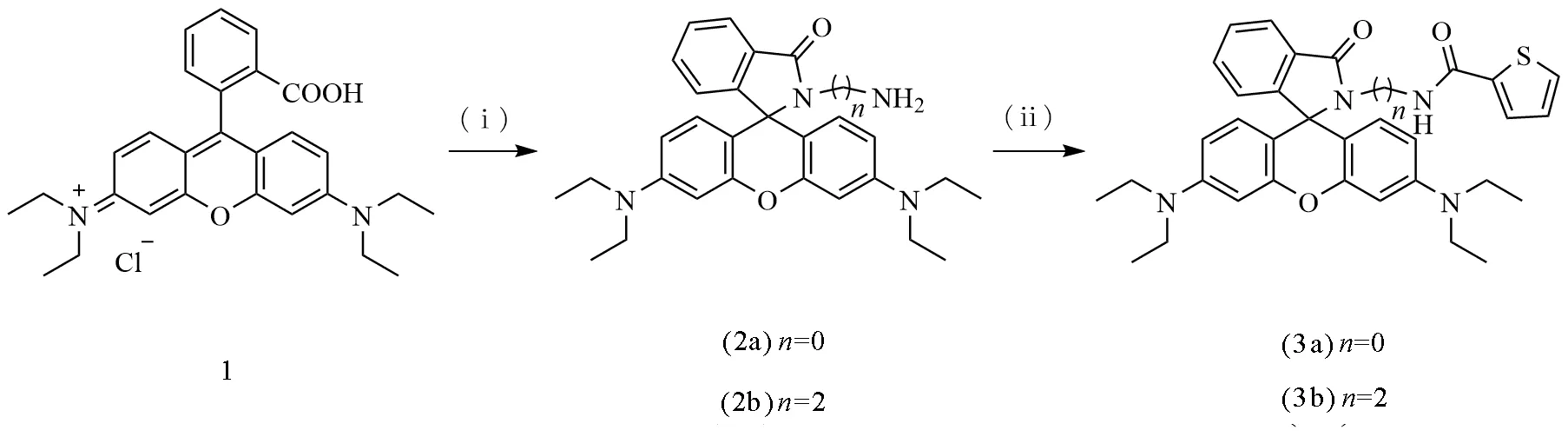
图1 探针BOTC及其参比的合成Fig.1 Schemel the synthesis of probe and reference
86.89,75.86, 54.33, 22.58。
1.2.2 探针BOTC (3a) 的合成 RBH(200.0 mg),NaH(52.8 mg),DMAP(26.8 mg)溶于无水乙腈(10 mL)中,然后加入2-噻吩甲酰氯(141 μL),回流2 h。反应结束后,过滤,将红色溶液旋干,残渣用DCM稀释并萃取(3×30mL),有机层用无水Na2SO4干燥,过滤,旋干,粗产物通过硅胶柱V(PE)∶V(EtOAc)=4∶1纯化得到探针BOTC (3a)。Rf:0.44V(PE)∶V(EtOAc)=1∶1。收率:64.6%。1H NMR (600 MHz, CDCl3)δ7.94 (s, 2H), 7.52 (dd,J=11.4, 5.7 Hz, 1H), 7.49-7.44 (m, 2H), 7.33 (d,J=3.3 Hz, 1H), 7.14 (d,J=7.0 Hz, 1H), 6.91 (s, 1H), 6.66 (s, 2H), 6.35 (s, 2H), 6.27 (s, 2H), 3.32 (dd,J=14.3, 7.0 Hz, 8H), 1.15 (t,J=7.0 Hz, 12H)。13C NMR (151 MHz, CDCl3)δ153.87, 149.04, 130.82, 129.50, 129.35, 128.27, 123.70, 108.06, 104.35, 97.84, 44.42, 12.74。HRMS (C33H34N4O3S): calcd. for [M+H]+567.2430; found: [M+H]+567.2432。
1.2.3 化合物2b的合成 将罗丹明B(2.500 0 g)溶解在乙醇(50 mL)中,加入乙二胺(6.7 mL),混合物在85 ℃下回流20 h。旋干溶剂得到粗品,用CH3CN重结晶得到化合物2b。Rf:0.47V(DCM)∶V(MeOH)=10∶1。产率:87.3%。
1.2.4 对照化合物3b的合成 化合物2b(100.0 mg),NaH(25.2 mg),DMAP(13.4 mg)溶于无水乙腈(5 mL)中,然后将2-噻吩甲酰氯(67.4 μL)加入该混合溶液中,回流2 h。反应结束后,过滤,将红色滤液真空浓缩,残渣用DCM稀释并萃取(3×30 mL),有机层用无水Na2SO4干燥,过滤,旋干,粗产物通过硅胶柱(洗脱液:V(DCM)∶V(MeOH)=40∶1)分离纯化得到对照化合物3b。Rf:0.78V(DCM)∶V(MeOH)=20∶1。收率:79.0 %。HRMS (C35H38N4O3S): calcd. for [M+H]+595.274 3; found: [M+H]+595.275 3。
1.3 实验样品的制备
探针BOTC标准溶液(1.0 mmol/L)的制备:准确称取探针BOTC 14.2 mg,用无水乙醇溶解并定容到25 mL容量瓶中,即得,将其存放在4℃冰箱中备用。
对照3b标准溶液(1.0 mmol/L)的制备:准确称取对照化合物3b 14.9 mg,用无水乙醇溶解并定容到25 mL容量瓶中,即得,将其存放在4℃冰箱中备用。
HEPES缓冲溶液(0.1 mol/L, pH 7.4)的制备:准确称取4-羟乙基哌嗪乙磺酸2.380 0 g,将其溶于80 mL蒸馏水中,用20%(质量分数)的NaOH调节pH至7.4,然后用蒸馏水定容到100 mL容量瓶中,即得。
Cu2+溶液的制备:准确称取Cu(NO3)2H2O 18.8 mg, 用V(EtOH)∶V(H2O)=1∶1溶解定容到100 mL容量瓶中,即得,将其存放在4℃冰箱中备用。
1.4 荧光光谱的测定
在比色管中加入50 μL探针BOTC(1.0 mmol/L),1 mL CH3CN,1.5 mL的Hepes缓冲溶液(0.1 mol/L,pH=7.4)以及不同浓度的待测离子溶液(100 μL),用蒸馏水将反应体系定容至5 mL后扫描该体系的荧光光谱及紫外吸收光谱。
1.5 细胞毒性试验
CCK-8法检测探针BOTC对SH-SY5Y 细胞的细胞毒性。在96孔板中加入100 μL的细胞悬液(每孔约1×105个细胞),将培养板放在培养箱预培养24 h(37℃,体积分数5%CO2),加入10 μL不同浓度(0,5,10,15,20和25 μmol/L)的探针BOTC溶液,接着在培养箱孵育24 h后向每孔加入10 μL CCK-8溶液(注意不要在孔中生成气泡,以免影响OD值的读数)。将培养板在培养箱内孵育1~4 h。用酶标仪测定540 nm处的吸光度。
1.6 细胞成像实验
在直径20 mm的共聚焦专用皿中加入 1 mL的细胞悬液,在培养箱中预培养24 h(37 ℃,体积分数5%CO2)。加入10 μmol/L的探针BOTC孵育10 min,加入20 μmol/L Cu2+溶液共孵育10 min,然后用PBS缓冲液(pH=7.4)洗涤3次,用质量分数4%的多聚甲醛溶液固定,最后在共聚焦显微镜下成像。
2 结果与讨论
2.1 探针BOTC的光谱性质
首先,我们测定了探针BOTC与Cu2+反应的荧光光谱和吸收光谱(图2),游离的探针是无色的,当加入Cu2+后,日光灯下呈红色,紫外灯下可以看到产生橙色荧光(图3)。
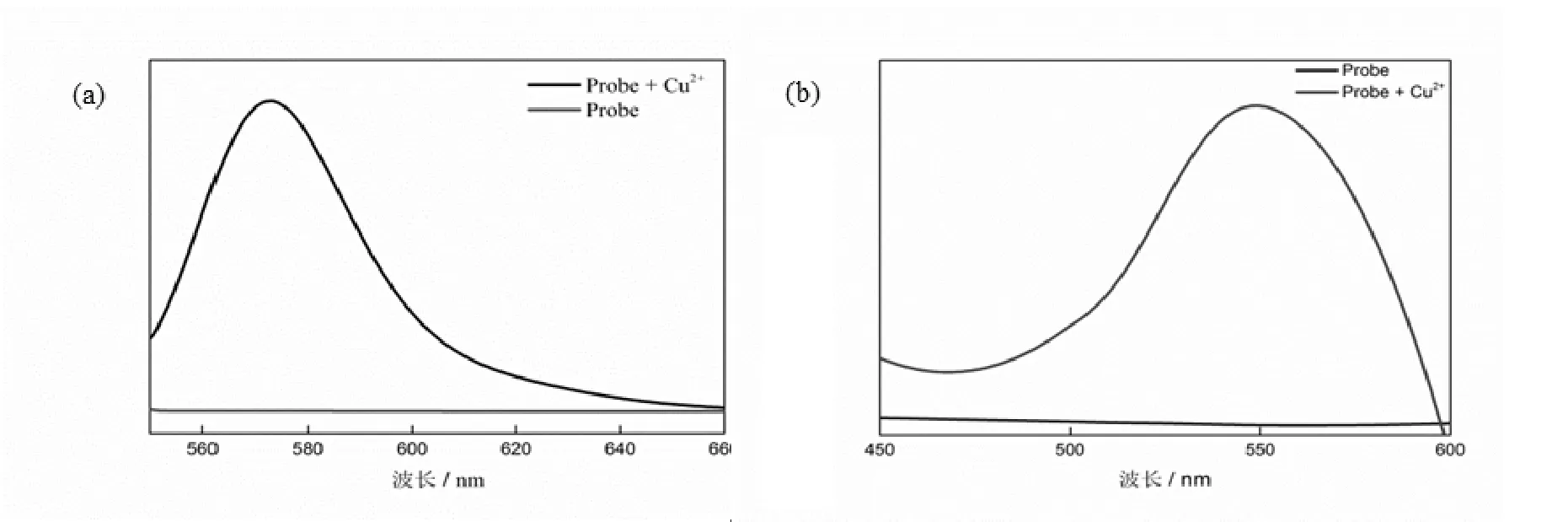
图2 探针BOTC与Cu2+反应的吸收和荧光光谱Fig.2 UV-vis absorption (a) and emission spectra (b) of probe BOTC in the absence and presence of Cu2+

图3 探针BOTC颜色变化Fig.3 Image of color change of probe after the addition of different metal ions
研究了不同浓度的Cu2+对探针BOTC吸收光谱的影响(图4)。可以看出,探针本身在555 nm处有强的紫外吸收,随着Cu2+浓度的增加(1~40 μmol/L),体系的紫外吸收强度逐渐降低,然后慢慢趋于稳定,体系的吸收强度在1~16 μmol/L的范围内成良好的线性关系,R2=0.995 3,检出限为0.32 μmol/L。接下来又研究了不同浓度的Cu2+对探针BOTC荧光光谱的影响(图5),在激发波长为540 nm下,探针本身在580 nm处没有荧光响应,当加入不同浓度的Cu2+(1~40 μmol/L)之后,随着Cu2+浓度的增加荧光响应逐渐增强并慢慢趋于稳定。体系的荧光响应与Cu2+浓度在1~10 μmol/L范围内成良好的线性关系,R2=0.997 2。
2.2 动力学研究
为了确定探针BOTC与Cu2+之间的反应速率,我们研究了该反应的动力学情况(图6)。可以观察到,游离探针的荧光信号随着时间的变化几乎保持不变,当加入Cu2+后,反应体系荧光信号迅速增强,随后荧光强度逐渐趋于平稳,结果表明了探针BOTC和Cu2+的反应十分迅速,响应时间小于1 min。
为了研究HEPES缓冲pH值的不同对探针BOTC以及加入Cu2+后的影响,我们检测了在pH 3~14的范围内体系荧光强度的变化(图6)。可以发现,探针本身的荧光强度随着缓冲液pH值的变化几乎保持不变,当向其中加入Cu2+后,在pH 3~8的范围内荧光强度逐渐增加,而在pH 9~14的范围内逐渐降低,最后我们取与生物体生理环境pH相近的pH 7.4作为后续工作测量的标准。由检测结果可以得知探针对pH的耐受范围广泛,可以满足生物体内测定的要求。
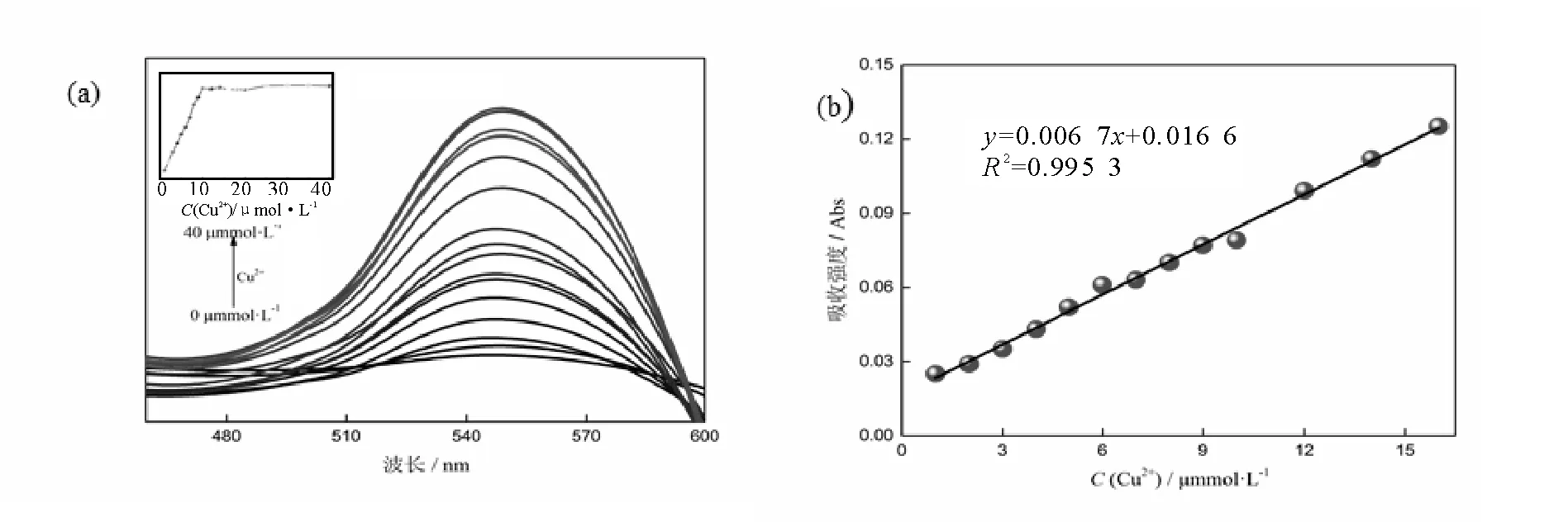
图4 探针BOTC与不同浓度Cu2+反应的吸收光谱及工作曲线Fig.4 Absorption spectra of probe upon the addition of Cu2+

图5 探针BOTC与不同浓度Cu2+反应的荧光光谱及工作曲线Fig.5 Fluorescence emission spectra of probe upon the addition of Cu2+
图6 探针BOTC与Cu2+反应的动力学曲线及pH影响Fig.6 Working pH and Time-dependent of BoOTC with Cu2+
2.3 选择性研究
为了研究探针BOTC对Cu2+的选择性能,我们检测了探针与其他生物活性物质的荧光响应情况(图7)和吸收(图8)。当向探针BOTC溶液中分别加入其他的活性待测离子后,体系的荧光信号并没有明显的变化,和探针自身的荧光信号强度几乎一致,而当向探针BOTC溶液中加入后Cu2+,体系的荧光信号明显增强。上述实验现象表明探针BOTC对Cu2+有独特的选择性,并且表现出很强的抗干扰能力。
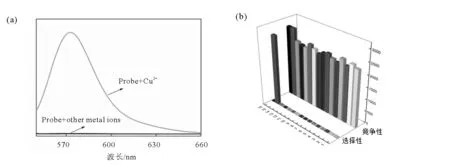
图7 探针BOTC对Cu2+选择性的荧光光谱Fig.7 The selectirlty of fluorescence spectra of BOTC
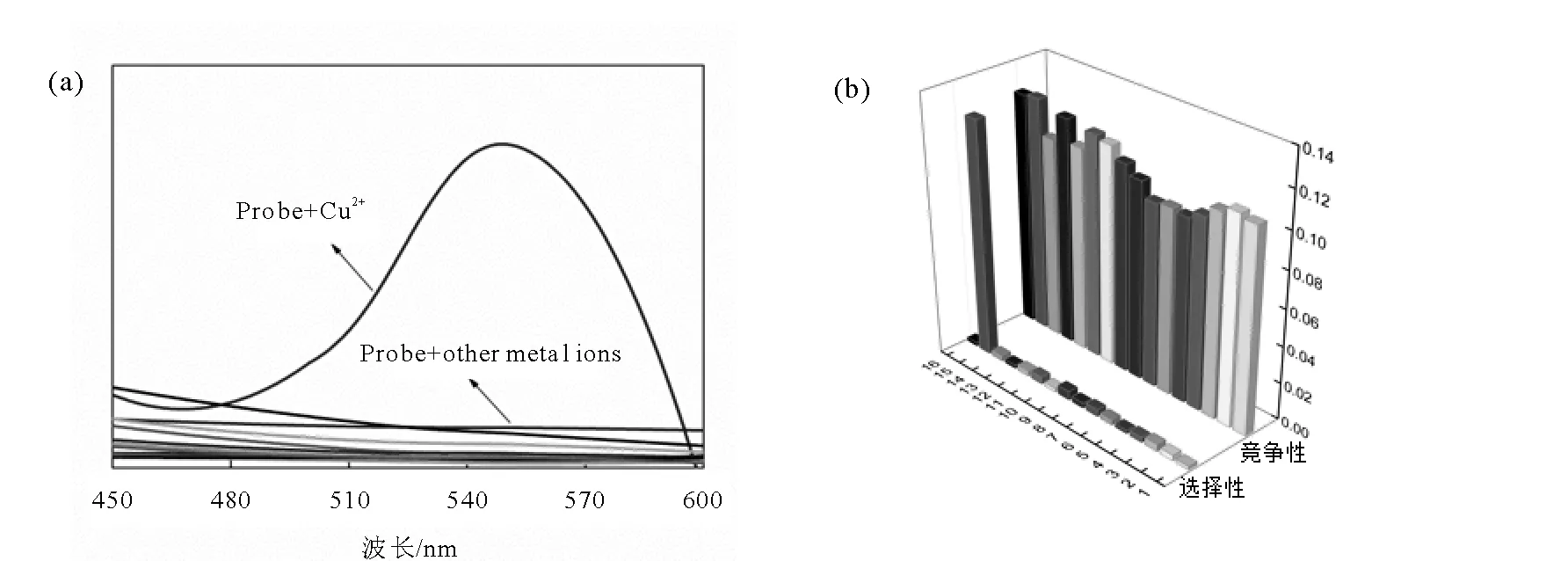
图8 探针BOTC对Cu2+选择性的吸收光谱Fig.8 The selectivity of UV-vis spectra of BOTC
2.4 反应机理探讨
以罗丹明B为起始原料,经过两步反应合成了探针BOTC(图1)。探针本身无荧光,当向探针体系中加入Cu2+后,Cu2+会和探针分子中的噻吩杂环络合,生成了相应的络合产物,改变了探针分子原有的结构,导致罗丹明分子开环,产生强烈的荧光,如图9所示。而参比化合物因为氮氮键之间有两个亚甲基,分子空间距离较大,与Cu2+不能络合,所以不会产生荧光。
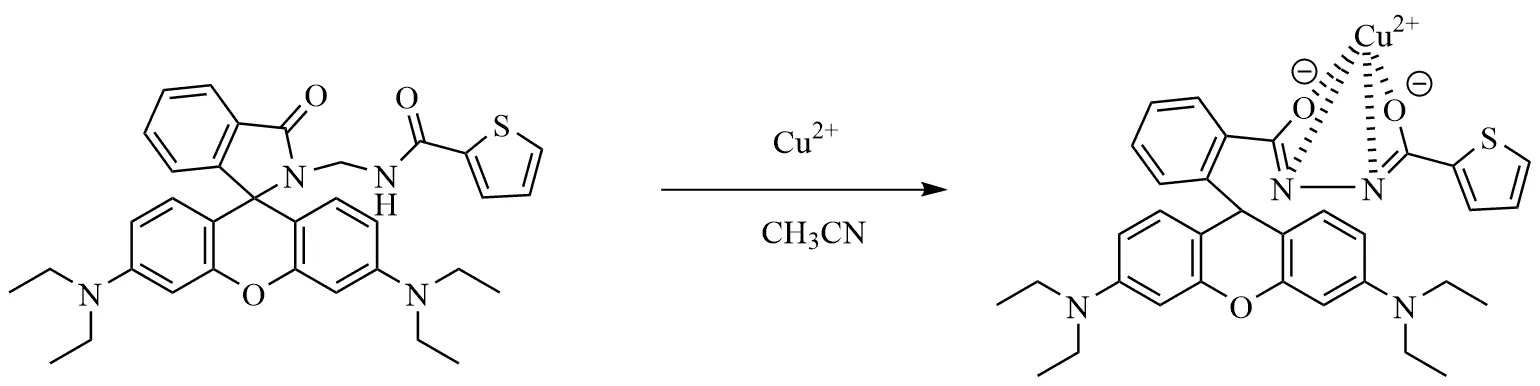
图9 探针反应机理Fig.9 The reaction mechanism of BOTC
2.5 生物应用
为了将探针BOTC应用于活细胞荧光成像中,采用CCK-8法实验来测定探针BOTC对细胞的毒性水平(图10)。将不同浓度的探针BOTC分别加入到神经母瘤SH-SY5Y细胞溶液中,在37℃条件下培养24 h后,用酶标仪检测细胞的存活数量,研究发现,当探针BOTC浓度高达25 μmol/L时,SH-SY5Y细胞的存活率依然很高,这说明探针对SH-SY5Y细胞表现出低的细胞毒性。

图10 探针BOTC的细胞毒性分析实验Fig.10 Cytotoxicity assay for SH-SY5Y cells treated with probe BOTC
在细胞毒性实验结果的基础上,我们选择了探针BOTC浓度为10 μmol/L进行了SH-SY5Y细胞成像实验研究(图11)。可以看出,探针本身在细胞中没有荧光,当加入20 μmol/L Cu2+,孵育5 min后,在540 nm处有强烈的荧光增强,这说明探针BOTC对SH-SY5Y细胞有很好的成像效果。
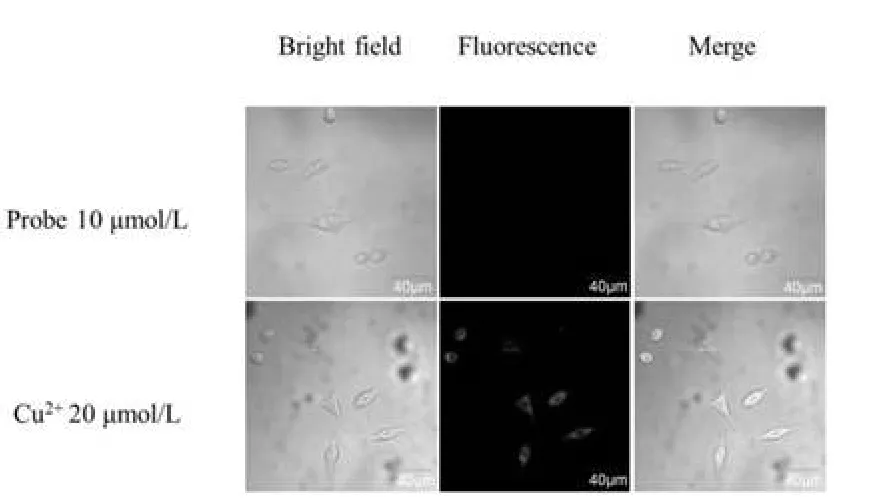
图11 探针BOTC在SH-Y5YS细胞中荧光成像分析实验Fig.11 Confocal fluorescence microscopic images of SH-SY5Y cells
3 结 论
将罗丹明B与水合肼在乙醇中合成罗丹明B酰肼,后加入2-噻吩甲酰氯,通过简单的两步反应合成探针分子BOTC,在缓冲液V(CH3CN)∶V(HEPES)=1∶1, pH=7.4中,检测其荧光性质。实验结果表明,只有加入Cu2+时,在540 nm处产生出现一个强的发射峰,表现出强的荧光信号,探针分子BOTC由无色变为红色,探针的荧光强度在Cu2+浓度为0~10 μmol/L范围内呈现良好的线性关系(R2=0.997 2),最低检测线为 0.32 μmol/L。该探针BOTC具有细胞毒性低,反应时间快,选择性好,灵敏度高,检出限低的特点,并且在SH-Y5YS细胞内有良好的荧光成像效果。该方法为生物体内的Cu2+的检测提供了新的思路。
