脾内移植肝细胞的功能和增殖情况探讨*
2019-07-17杨均均冯渊李德卫
杨均均, 冯渊, 李德卫
南充市中心医院(川北医学院第二临床学院) 1感染科, 2肝胆外科(四川南充 637000); 3重庆医科大学附属第一医院肝胆外科(重庆 400016)
肝细胞移植是治疗急性肝功能衰竭(acute liver failure, ALF)和代谢性疾病的有效方法之一,并在临床上取得了一定的疗效[1-2]。然而目前供体的严重短缺、肝细胞大规模增殖困难和不能长久维持其功能限制肝细胞移植在临床中广泛运用[3]。在肝脏受到急慢性损伤的条件下,可以诱导肝脏分泌一些细胞因子刺激移植到体内的肝细胞增殖和发挥其功能[4-5]。在肝脏无损伤的情况下,移植的肝细胞增殖能力和分泌功能较弱[6-8]。目前脾脏是肝细胞移植运用较多、最为成熟的部位之一,但关于脾内移植肝细胞功能和增殖情况却少有报道[9]。我们于2016年2月至2017年9月开展本实验研究D-氨基半乳糖(D-gal)诱导大鼠ALF后,经脾脏移植同种异体肝细胞进行治疗,观察ALF大鼠的肝功能变化情况、脾内肝细胞功能和增殖情况。
1 材料与方法
1.1 动物和试剂 45只SD大鼠,雌雄各半,体重(200±25)g,由重庆医科大学动物实验中心提供,饲养条件:20~25℃,充足的水和食物,12 h昼夜交换。胶原酶Ⅳ、牛血清白蛋白(美国Sigma公司),D-gal(重庆医科大学化学教研室),兔抗大鼠白蛋白单克隆抗体(美国Abcom公司),CFDA SE (上海碧云天生物公司),D-Hank′s、Hank′s液(北京solarbio公司)。
1.2 实验方法
1.2.1 肝细胞分离技术 原代肝细胞的分离采用改良两步法[10]。(1)先通过门静脉途径插管灌注D-Hank′s液,去除肝脏内的红细胞;(2)换用含0.05%胶原酶Ⅳ的Hank′s液门静脉灌注,消化肝细胞。将分离出的肝细胞和Hank′s液制成肝细胞悬液,取出小部分肝细胞通过台盼蓝染色,观察肝细胞的活性。
1.2.2 肝细胞荧光染料标记 将肝细胞重悬于含有10 μmol/L 示踪剂CFDA SE的 Hank′s液中,0℃孵育15 min,使细胞重吸收示踪剂。通过荧光显微镜检测肝细胞的标记情况,染色成功后弃上清液,再次加入4℃ Hank′s 液,制成肝细胞悬浊液。
1.2.3 ALF大鼠模型的建立 A、B组各20只SD大鼠腹腔内注射D-gal(剂量为0.8 g/kg),诱导ALF。
1.2.4 肝细胞移植 A组SD大鼠通过3%的水合氯醛腹腔麻醉后,腹部正中线切口,暴露脾脏,临时阻断脾脏动、静脉10 min,用1 mL注射器将0.4 mL Hank′s液注入脾脏,为了防止肝细胞漏和出血,用6-0细线结扎穿刺点。B组SD大鼠经D-gal(剂量为0.8 g/kg)诱导ALF 24 h后,通过同样的办法注射0.4 mL(约2×107个)肝细胞悬浊液。
1.3 监测指标
1.3.1 肝功能检测 分别在移植前1 d和移植当天,随机抽取3只SD大鼠通过尾静脉采血观察血清中ALT和总胆红素(T-BiL),观察肝衰竭模型的建立。分别在移植后第1、5、10、15天通过尾静脉采血观察大鼠的肝功能变化情况,使用赖氏法检测谷丙转氨酶(ALT),用溴甲酚绿法检测T-BiL,观察不同时间点大鼠肝功能的变化情况。
1.3.2 荧光标记检测 在移植术后7 d,取下荧光标记受体大鼠的脾脏、肝脏、肺叶送快速冰冻,6 μm厚度连续切片。使用60%甘油封片后,使用荧光显微镜观察CFDA SE标记的移植肝细胞在体内的分布情况。
1.3.3 白蛋白免疫荧光检测 (1)将取下的大鼠脾脏组织送快速冰冻,连续6 μm切片;(2)冻冰切片的组织使用4%多聚甲醛固定;(3)使用PBS水化冻冰组织2次,每次约10 min;(4)使用3% BSA常温封闭约30 min;(5)加入Ⅰ抗兔抗大鼠白蛋白单克隆抗体孵育2 h,避光;(6)再次使用PBS水化组织2次,约10 min。(7)最后使用60%甘油封片,共聚荧光显微镜观察白蛋白荧光信号。
1.3.4 组织学检测 取下的脾脏用4%的多聚甲醛固定24 h,石蜡包埋、切片,使用苏木素-伊红染色(HE)观察移植肝细胞增殖情况。

2 结果
2.1 肝细胞分离及荧光标记 原代肝细胞分离成功为单个细胞,台盼蓝染色活力为80%~85%。见图1。荧光标记见图2。
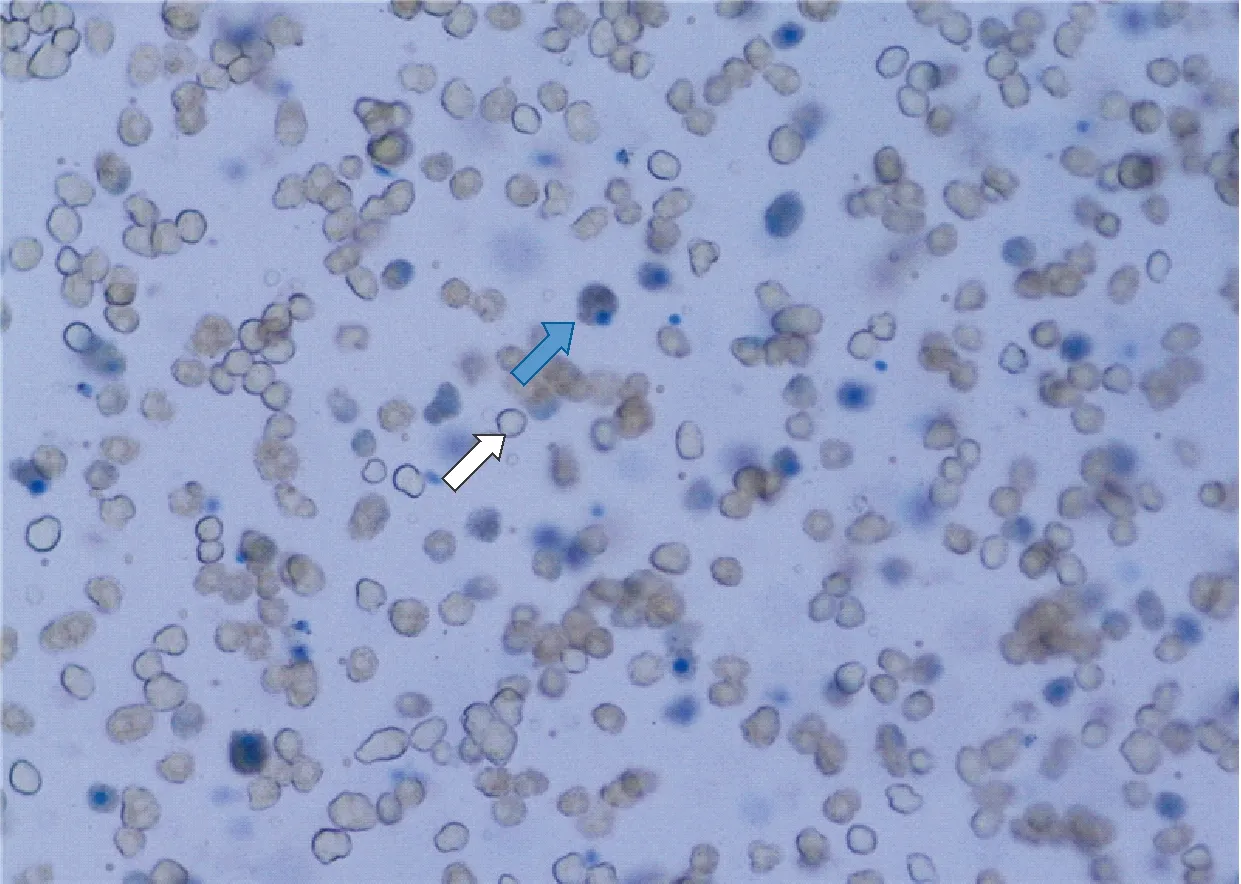
存活肝细胞显透亮不被台盼蓝着色,而壁破坏的肝细胞则染成蓝色,白细胞色箭头表示存活大肝细胞;蓝色箭头表示细胞壁破坏的肝细胞、死亡的肝细胞
图1分离的肝细胞 (台盼蓝,×200)
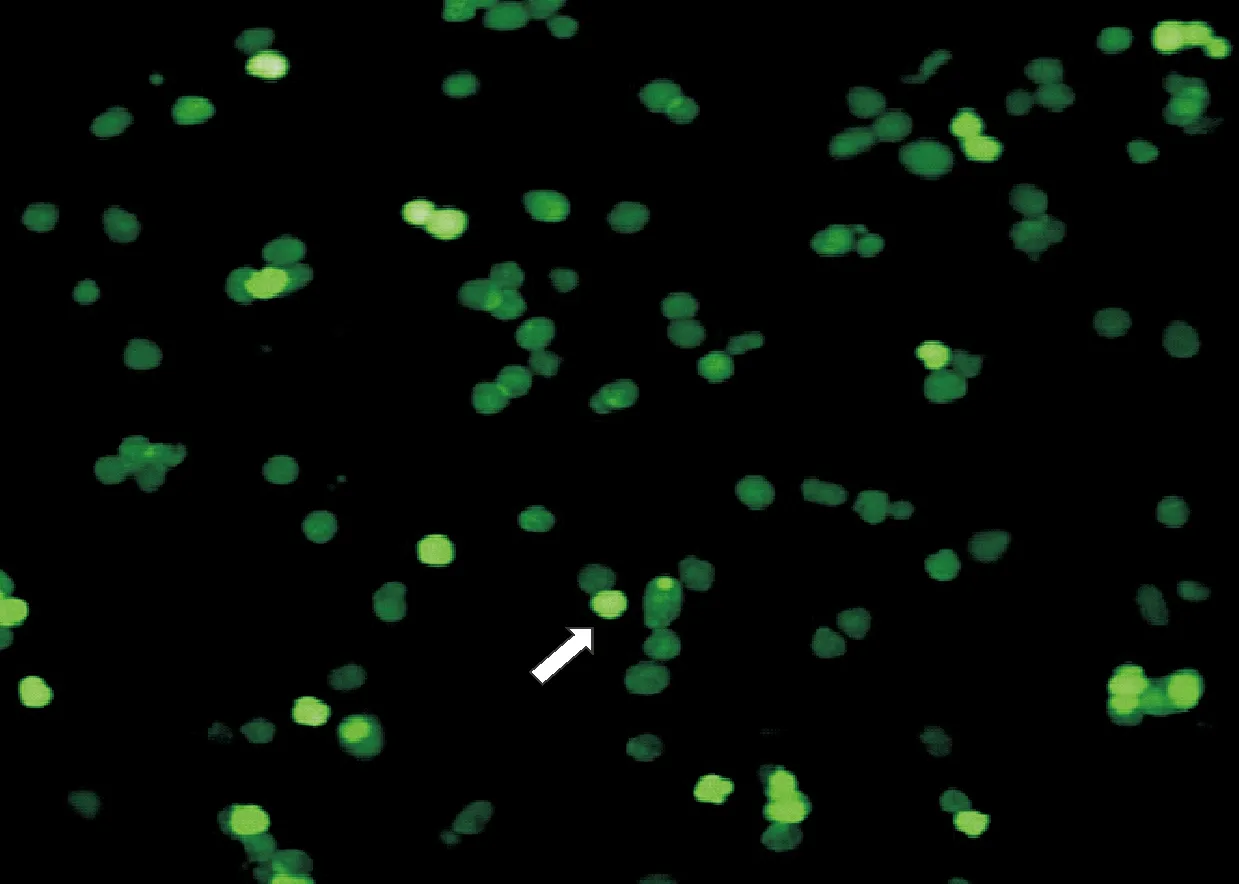
白色箭头为被CFDA SE荧光的肝细胞
2.2 肝功能检测 移植术后不同时间点的肝功能比较发现,在移植后第5天开始,B组ALT、T-BiL明显低于A组(P<0.05)。在第10天左右,B组大鼠的肝功能基本恢复正常,而A组大鼠的肝功能14 d恢复正常。见表1。
2.3 组织荧光标记 通过荧光显微镜,在脾脏发现CFDA SE标记的肝细胞散在绿色荧光。同时肝脏也发现少量的绿色荧光标记。肺部和其他部位尚未发现绿色荧光标记的肝细胞。移植后第7天脾脏内可观察到CFDA SE荧光标记的肝细胞。见图3。


时间组别ALT(IU/L)T-BiL(mol/L)移植术后1 d A组959.0±120.564.1±9.0B组707.7±70.058.5±5.1移植术后5 dA组559.0±82.543.9±7.3B组340.7±104.0∗31.2±1.4∗移植术后10 dA组97.7±33.732.1±7.2B组38.3±14.5∗17.9±2.1∗移植术后14 dA组35.7±16.514.2±7.4B组33.3±11.811.2±2.0
*与A组同时间点比较P<0.05
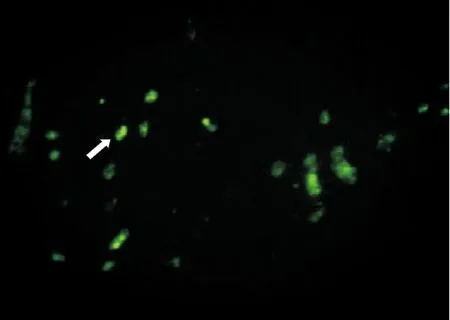
图3 移植后第7天脾脏CFDA SE荧光标记的肝细胞(×200)
2.4 白蛋白免疫荧光检测 B组移植术后60 d,白蛋白免疫荧光发现大量的绿色荧光标记。见图4。

图中蓝色代表细胞核,绿色代表白蛋白
2.5 脾内肝细胞增殖情况 光镜下,B组移植术后7 d,脾脏红髓中发现许多HE染色较红的肝细胞,胞浆丰富,圆形或椭圆形核位于中央,还可见双核,核膜清楚,核仁 1~2个。部分肝细胞周围有炎症细胞侵润,可以发现少量坏死区,细胞器结构模糊,细胞核消失。见图5。60 d后发现被脾脏俘获肝细胞簇集在一起,3、4个肝细胞形成细胞群,在脾脏红髓中安定下来。肝细胞形态、结构均正常,周围未发现炎症细胞浸润。脾脏髓质结构紊乱,仍可以发现一些陈旧性的坏死组织。见图6。
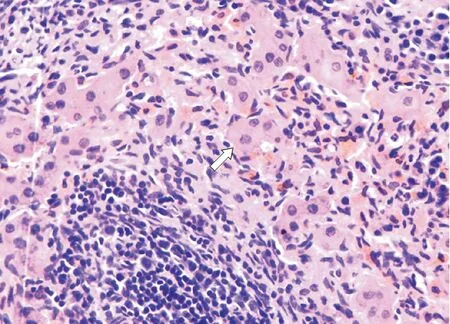
白色箭头指示为在脾脏髓质周围存活的肝细胞

白色箭头指示为在脾脏髓质周围增殖的肝细胞
3 讨论
在很多情况,肝细胞移植的增殖情况很难通过精确且无创的方法进行检查[5]。目前通过转基因技术荧光蛋白和荧光染色来追踪移植肝细胞的增殖情况。Koblihov等[8]通过荧光扫描可以观察移植的荧光标记的肝细胞,从而分析其短期增殖情况,但该技术只能作为短时间的追踪,由于半衰期的影响,远期观察效果较差,无法观察较长时间肝细胞的增殖情况。
CFDA SE可以通透细胞膜,进入细胞后可以被细胞内的酯酶(esterase)催化分解成CFSE,使整个细胞浆发出绿色荧光。通过CFDA SE示踪剂可以观察移植的肝细胞在体内的分布情况。移植后7 d,脾内和肝脏内都发现散在的绿色荧光标记,说明移植的肝细胞在脾脏和肝脏 “定居”。但CFDA SE由于半衰竭的原因,无法通过荧光染色长时间的观察。研究认为肝刺激因子(hepatic stimulator substance, HSS)为大鼠肝脏及部分切除后的再生肝细胞中首次分离得到, 由于其具有特异性刺激肝细胞增殖的特点, 故谓之肝刺激因子。肝细胞移植提高生存率的主要机制包括提供暂时的肝功能支持,以及可通过产生肝细胞生长因子(HGF)促进残存肝脏的再生和功能恢复[11-12 ]。本实验结果也证实B组大鼠肝功能恢复好于A组。白蛋白是肝细胞特异性表达的功能蛋白,是成熟肝细胞的功能指标,其表达数量可以直接反应移植肝细胞的分化程度和功能状态。移植60 d后,B组白蛋白绿色荧光信号阳性表达,HE染色发现B组移植的肝细胞被脾脏俘获簇集在一起,然后分布红髓中“安家落户”,说明移植的肝细胞在脾脏内增殖并发挥分泌白蛋白等生理功能作用。
关于原代肝细胞在脾内长期功能表达和增殖情况一直存在争议。许多研究认为在肝功能损伤的肝硬化、肝叶切除等动物模型中,肝细胞移植在脾内能长时间增殖并能分泌白蛋白[13-14]。相反,有研究认为在失代偿性肝硬化大鼠中,肝细胞脾内移植只能发挥短暂肝功能支持,移植一段时候后,脾内肝细胞失去其正常功能[14]。造成这种争论的原因可能与肝硬化动物模型严重程度(门脉高压、脾脏内淤血水肿)不同有关,直接影响了脾内移植的肝细胞长期增殖情况。
本实验表明ALF肝功能恢复之后,移植的肝细胞在脾内能长期增殖并发挥功能作用,其原因可能包括以下几个方面: (1)大鼠发生ALF之后,可以刺激肝脏分泌HGF、肝再生增强因子(augmenter of liver regeneration, ALR)、转化生长因子(transforming growth factor, TGF)-α等细胞因子的表达,促进移植的肝细胞增殖和发挥功能作用[12]。(2)ALF时机体的免疫功能下降,对移植的细胞排斥反应降低,减少脾内移植肝细胞的炎症反应和巨噬细胞的吞噬作用等[15-16]。(3)移植后长时间的增殖能力可能与原代肝细胞分离的纯度有关,本实验通过改进的原代肝细胞提取方法,获得较高的肝细胞纯度,分离纯度越高,诱发急性排斥反应的可能性越小。(4)原代肝细胞分离的活性,直接影响移植后的肝细胞增殖情况,如肝细胞活性较低,巨噬细胞会吞噬死亡的肝细胞,从而诱发急性炎症反应,分泌大量炎症介质,影响存活肝细胞的增殖,本实验在原代肝细胞分离过程中,得到了较高的肝细胞活性较高,从而长时间在脾内发挥其增殖能力和发挥其功能[15]。
综上所述, 同种异体肝细胞移植能改善ALF的肝功能,并能在脾内60 d后仍具有一定的增殖能力和发挥白蛋白分泌功能,为临床运用脾内肝细胞移植治疗ALF提供了理论依据。
