壶腹癌中B7-H1 和B7-H4的表达及与肿瘤T 淋巴细胞浸润的关系
2019-07-17祁紫娟吴鹤鸣周照旭姜虹
祁紫娟 吴鹤鸣 周照旭 姜虹
抗肿瘤免疫以T淋巴细胞介导的细胞免疫为主。T细胞的活化需要TCR介导的抗原信号和协同刺激分子提供的第二信号共同作用[1]。B7-CD28家族是重要的协同刺激分子,其成员有些是激发或增强免疫应答,有些是下调或终止免疫应答。B7-H1、B7-H4是B7-CD28家族新近发现的负性协同刺激分子,可通过抑制T细胞的活化和增殖来负调控T细胞的免疫应答[2],并已发现在多种肿瘤组织(如肺癌、卵巢癌、子宫内膜癌等)中异常表达,使人们注意到其在肿瘤的发生发展中的作用,与肿瘤的免疫逃逸有关。但B7-H1、B7-H4在壶腹癌中的表达情况未有文献报道。为对临床下一步研究工作提供借鉴,本研究应用免疫组织化学染色,检测壶腹癌中B7-H1、B7-H4的表达及其与肿瘤浸润T淋巴细胞的关系。
1 材料与方法
1.1 材料
黑龙江省医院2011年6月—2018年6月外科手术切除的壶腹癌标本62例,其中18例正常组织来源于肿瘤组织的癌旁部分。试剂:鼠抗人B7-H1及B7-H4单克隆抗体来自博奥森生物技术有限公司。CD3,CD8,CD68及检测试剂盒均来自北京中杉公司。
1.2 免疫组织化学染色
采用PV-6000-G二步法。肿瘤组织标本10%中性福尔马林溶液固定,石蜡包埋,4μm 连续切片,二甲苯脱蜡,阶梯酒精内水化;PBS液浸泡3次,每次5 min(3×5),浸于枸橼酸盐缓冲液1800 W高压修复组织抗原1.5 min.,PBS冲洗3×5;3% H2O215分钟阻断内源性过氧化物酶,PBS冲洗3×5;除去PBS液,加入一抗4℃孵育过夜;PBS冲洗3×5,滴加通用型二抗孵育30 min,PBS洗涤; DAB显色;蒸馏水冲洗;苏木素复染;梯度乙醇脱水;二甲苯透明;中性树胶封片。以PBS液代替一抗作为阴性对照。
1.3 染色结果评估
以细胞膜或细胞浆出现黄至棕褐色颗粒为阳性染色,在高倍镜下随机选择5个肿瘤区域进行细胞计数。B7-H1、B7-H4的染色强度根据阳性细胞的百分比进行半定量分级。结果判断:<20%为阴性;20%~100%为阳性。CD3+/ CD8+T淋巴细胞的数量为随机选择的5个癌视野在高倍镜下细胞计数的平均值。
1.4 统计学分析
本研究选择 SPSS 19.0 统计学软件,所涉计数数据表示方法及检验方法分别为%和χ2检验,而所涉计量数据表示方法和检验方法分别为均数±标准差和t检验,判定形成统计学意义的标准为 P<0.05。
2 结果
2.1 B7-H1、B7-H4在不同壶腹部组织中的表达
免疫组化结果显示,壶腹癌组织中B7-H1、B7-H4阳性染色定位在肿瘤细胞胞质和胞膜,呈弥漫性表达,大多数位于肿瘤实质腺体上皮细胞,肿瘤浸润淋巴细胞不表达两者。在62例壶腹癌中,B7-H1表达的阳性率为80.65%(50/62);B7-H4表达的阳性率为82.26%(51/62);B7-H1和B7-H4双阳性表达45例,占72.58%,双阴性6例,占9.68%.B7-H1和B7-H4表达呈正相关,相关系数rs=0.809,P <0.01。癌旁正常壶腹部组织中,B7-H1、B7-H4表达较弱或不表达,阳性率分别为38.89%(7/18)和44.44%(8/18),与其在壶腹癌组织中表达情况比较,差异有统计学意义(χ2=11.824,13.479,P<0.01)。见表1。
2.2 B7-H1、B7-H4表达与肿瘤T细胞浸润的关系
壶腹癌组织中CD3和CD8标记的肿瘤浸润T淋巴细胞阳性定位于胞膜。CD3+T、CD8+T细胞呈圆形或椭圆形,大部分聚集在癌巢周边的间质,呈灶状分布;少数可浸润癌巢,直接与肿瘤细胞接触。B7-H1阳性标本的CD3+T、CD8+T细胞明显低于B7-H1阴性标本。B7-H1阳性表达与CD3+T数量呈负相关(rs=-0.781,P<0.01),与CD8+T无关(rs=0.046,P>0.05)。B7-H4阳性中CD3+T、CD8+T低于B7-H4阴性中CD3+T。CD3+T、CD8+T数量与B7-H4阳性表达呈负相关(rs=-0.752,rs=-0.807;P<0.01)。见表2,表3。
3 讨论
壶腹癌是指生长于十二指肠乳头及附近黏膜、壶腹内黏膜、胰管开口及胆总管下段黏膜的恶性肿瘤[3],免疫系统缺陷、宿主对肿瘤抗原缺乏反应,使肿瘤细胞逃避免疫系统的监督是其发生和发展的重要因素。近年来,围绕肿瘤的免疫逃逸机制做了多方面研究,介导T细胞共刺激信号转导通路的B7-CD28家族是其中的一个热点,B7-H1和B7-H4是新近发现的B7家族成员,提供负性信号来限制、终止或削弱T细胞免疫应答。
B7-H1的受体是PD-1,B7-H1与其结合后发挥抑制效应,抑制T细胞增殖活化、诱导活化的T细胞发生凋亡、IL-2分泌,从而负性调控机体的特异性细胞免疫应答,参与肿瘤免疫逃逸的发生[4]。B7-H4mRNA在肾、子宫、睾丸、肝、脾等多种人类组织上广泛表达,蛋白水平上在人正常组织中却未检测到其表达。本研究发现,壶腹癌组织中B7-H1、B7-H4在肿瘤细胞胞质和胞膜呈弥漫性表达,大多数位于肿瘤实质腺体上皮细胞,肿瘤浸润淋巴细胞不表达两者。其阳性率明显高于癌旁正常壶腹部组织中B7-H1、B7-H4的阳性率(P<0.01),有统计学意义。结合两者在其他肿瘤组织中的文献报道,提示B7-H1和B7-H4确实参与了壶腹癌的发生[5]。笔者认为:在将来,需要进一步收集组织标本和患者的预后资料,来证实B7-H1和B7-H4共同表达的壶腹癌患者的死亡风险及预后的关系,有重要的临床应用价值。

表1 B7-H1、B7-H4 在不同壶腹部组织中的表达(%)
表2 B7-H1 表达与肿瘤T 细胞浸润的关系(个/μL)
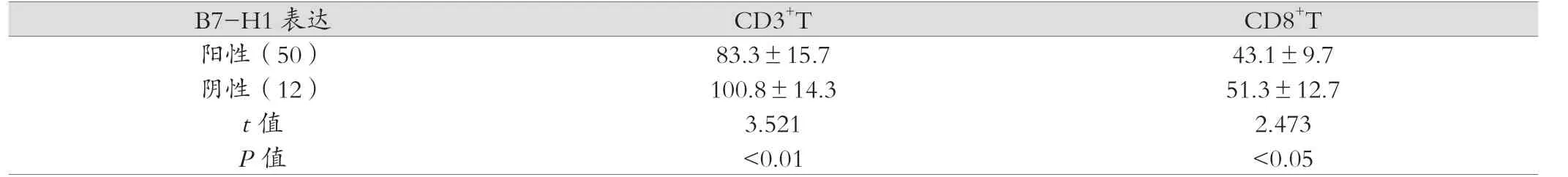
表2 B7-H1 表达与肿瘤T 细胞浸润的关系(个/μL)
B7-H1 表达 CD3+T CD8+T阳性(50) 83.3±15.7 43.1±9.7阴性(12) 100.8±14.3 51.3±12.7 t 值 3.521 2.473 P 值 <0.01 <0.05
表3 B7-H4 表达与肿瘤T 细胞浸润的关系(个/μL, )

表3 B7-H4 表达与肿瘤T 细胞浸润的关系(个/μL, )
B7-H4 表达 CD3+T CD8+T阳性(51) 81.5±12.9 41.4±8.5阴性(11) 110.9±11.3 59.8±6.5 t 值 6.992 6.749 P 值 <0.01 <0.01
为了了解壶腹癌中B7-H1和B7-H4表达与T淋巴细胞浸润的关系,本实验专注检测完全浸润的T细胞数量作为其是否增殖的标志[6]。尽管这种方法不能准确说明T细胞是否活化的问题,但有理由相信,如果B7-H1和B7-H4发挥其负性调控免疫应答中抑制T细胞增殖的作用,会使组织中T细胞的数量明显减少。CD3检测所有的T细胞的数量,CD8标记CTL[7]。结果发现,B7-H1、B7-H4阳性壶腹癌标本中CD3+T、CD8+T细胞的数量明显低于其阴性标本,B7-H1阳性表达与CD3+T数量呈负相关(P<0.01);CD3+T、CD8+T数量与B7-H4阳性表达呈负相关(P<0.01)。这些研究结果提示,B7-H1和B7-H4通过负性调控T细胞介导的抗肿瘤免疫反应,使肿瘤细胞逃避免疫系统的监督,抑制肿瘤细胞凋亡,从而促进肿瘤的进展。
癌组织内浸润的巨噬细胞为肿瘤相关巨噬细胞(TAM),可以促进肿瘤细胞的增殖、抑制自然杀伤细胞(NK)和T淋巴细胞的抗肿瘤活性,其浸润数量与恶性肿瘤的某些生物学行为和预后密切相关[8]。有关研究发现[9-11],卵巢癌组织中,TAM表面表达B7-H4,抑制T细胞免疫。而在本实验中,只观察到少数的巨噬细胞胞质B7-H4呈微弱表达而不是表达于细胞表面。这可能由于B7-H4被巨噬细胞的吞噬机制所吸收,而不是TAM本身表达B7-H4,需要进一步的实验确定TAM的B7-H4来源。B7-H1和B7-H4表达情况与TAM数量的关系尚未有研究报道,具体作用机制也未阐明。B7- H1阳性、B7-H4阳性标本癌细胞周围的炎症反应增强,作为重要的炎症反应细胞TAM增多,抑制T细胞增殖,从而介导免疫抑制效应。同时TAM也表达淋巴内皮生长因子受体(VEGF-C),通过刺激肿瘤淋巴管的形成促使肿瘤细胞的淋巴结转移[12]。
综上所述,负性协同刺激分子B7-H1和B7-H4在壶腹癌组织中高表达,与T细胞数量有关,参与壶腹癌细胞的免疫逃逸。
