全自动免疫亲和在线净化—高效液相色谱法快速测定粮食中赭曲霉毒素A
2019-07-17王松雪
谢 刚 李 丽 黎 睿 王松雪 王 硕
(天津科技大学食品工程与生物技术学院1,天津 300457)(国家粮食和物资储备局科学研究院2,北京 100037)
赭曲霉毒素主要是由曲霉属和青霉属产生的一类有毒的次生代谢物,其中赭曲霉毒素A(ochratoxin A,OTA)毒性最强,能产生如胚胎毒性、致畸性、致癌性、免疫毒性、肝毒性等严重的毒性,被世界卫生组织的国际癌症研究组织列为2B级疑致癌物质[1]。此外,OTA稳定存在于谷物、酒类、干果、坚果、咖啡和豆类等农作物及其制品中[2-3]。目前, GB 2761—2017中规定谷物及其制品中赭曲霉毒素A限量为5.0 μg/kg[4]。
常用的 OTA 检测方法主要有胶体金试纸条法[5-7]、酶联免疫法或免疫传感器[8]、生物传感器法[9]、间接竞争免疫分辨荧光免疫分析[10]、液相色谱法或液质联用法[11-15]等方法。薄层色谱法由于操作复杂,目前应用较少。胶体金和酶联免疫方法用于快速筛查。液质联用仪检测需要高端的质谱仪。离线净化的普通高效液相色谱方法目前应用较多,但存在净化过程操作繁琐、分析速度较慢等问题。早在1991年,就有报道使用离线自动固相萃取高效液相色谱法测定里谷物及其制品中黄曲霉毒素和赭曲霉毒素A的方法[16-17]。目前在日常液相检测中也常使用免疫亲和柱离线净化装置净化,这些离线自动净化方法提高了检测结果的可比性、节省了时间和人力成本,但样品前处理步骤较为繁琐,免疫亲和柱只能使用1次,离线净化检测耗材成本仍然较高,检测效率仍然较低[18]。2012年,研究人员尝试通过特殊处理的免疫亲和预柱(2.1 mm ID×50 mm)在线净化-柱后溴衍生-高效液相色谱法对花生、无花果干、红辣椒粉等样品中4种黄曲霉毒素检测方法进行验证[19-21],发现在线自动化净化样品显著提高了分析效率和重现性,降低了检测成本。
本研究采用全自动在线净化技术,使用将抗体耦合到耐压聚合物的免疫亲和柱(1 mm ID×10 mm),结合RIDA®CREST ICE在线固相萃取装置,建立了在线净化液相色谱检测玉米、小麦中赭曲霉毒素A的方法,增加了免疫亲和柱的使用次数,提高了检测的自动化水平和检测效率,降低了检测成本,以满足大规模样品准确定量的需求。
1 材料与方法
1.1 仪器与试剂
Spark通用全自动高效液相色谱,配RIDA®CREST 在线固相萃取系统、荧光检测器;OtaTest在线固相萃取柱;Pulverisette14 高速旋转粉碎机;SIGMA3-30K离心机;VX-Ⅲ振荡器。
赭曲霉毒素A标准溶液;甲醇、乙腈:色谱纯;Milli-Q超纯水;四鹏酸钠(硼砂)、曲拉通X-100(Triton X-100)、吐温-20、碳酸氢钠、氢氧化钠、浓盐酸、乙酸铵、乙酸(分析纯)。
1.2 赭曲霉毒素A标准溶液的配制
移取一定体积的赭曲霉毒素 A 溶液标准样品,使用流动相稀释成适当浓度的标准工作液,浓度为0.012 5 ~0.5 ng/mL。
1.3 试剂配制
1.3.1 样品提取液: 60%乙腈水(V/V),量取400 mL超纯水和600 mL乙腈,超声15 min。
1.3.2 样品稀释液:含3% Tween-20(m/V)水溶液,称取3 g Tween-20溶于100 mL超纯水。
1.3.3 流动相A:2%乙酸水,量取1 000 mL超纯水,加入20 mL冰乙酸,超声15 min。
1.3.4 活化液(1A):20 mmol 乙酸铵,调节pH至6.80-7.00。
1.3.5 淋洗液(1D):20 mmol乙酸铵 和22.5 mM硼砂以及0.9% Triton X-100的水/甲醇溶液(90/10,V/V/V),调节pH至8.3-8.5。
1.3.6 洗脱液:含20 mM乙酸铵的水/乙腈/乙酸(33/60/7,V/V/V)。
1.4 在线固相萃取-高效液相色谱法测定条件
液相色谱条件(表1):Agilent ZORBAX Eclipse Plus C18色谱柱(4.6 mm×150 mm,5 μm);进样量1 000 μL;流速1.0 mL/min;柱温27 ℃;荧光检测器激发波长:333 nm,发射波长:460 nm;流动相为2%乙酸水(A)∶乙腈(B)=50∶50。
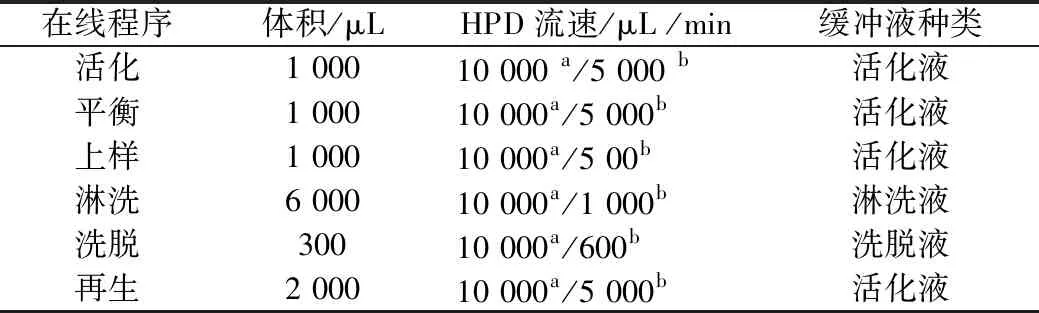
表1 RIDA® CREST 在线固相萃取条件
注:a为Aspirate(吸取);b为Dispense(分配)。
1.5 样品制备
将混合均匀的玉米粉、小麦粉样品及过夜后的加标样品5.0 g,加入20 mL提取液,振荡提取30 min,于8 000 r/min下离心5min,取适量上清液用稀释液稀释10倍,将稀释液置于进样瓶中备用。
2 结果与讨论
2.1 样品提取液的优化
通过查阅文献和现有标准,对粮食基体中提取赭曲霉毒素A的提取液进行汇总,结果见表2。

表2 不同粮食基体中赭曲霉毒素A提取液的选择
从表2可知,赭曲霉毒素A的提取方法主要为乙腈水体系、甲醇水体系。本研究考察60%乙腈水、80%乙腈水和80%甲醇水对小麦、玉米中赭曲霉毒素A提取效果的影响,确立最佳的提取溶剂。选用自然污染的、混合均匀的质控样品进行验证,其余处理方法按照1.4进行,检测结果见图1。

图1 不同提取液的提取结果(n=6)
从图1可知,小麦基质中乙腈水的提取效率优于甲醇水。通过单因素方法分析可知,80%甲醇水与60%的乙腈水和80%乙腈水间结果存在显著差异(F统>4.965),60%乙腈水和80%乙腈水间测定结果差异不显著(F统<4.965)。玉米基质中3种提取液的测定结果之间差异不显著(F统<4.965)。考虑OTA在线固相萃取小柱对乙腈耐受程度不高(<8%),为提高萃取柱重复使用次数,结合2种基质的提取结果,选择60%乙腈水作为提取液。
2.2 在线固相萃取系统中淋洗液的优化
研究优化RIDA®CREST 在线固相萃取条件中淋洗液参数,常用的淋洗液为:含有20 mM乙酸铵、22.5 mM硼砂和0.9% Triton X-100的水溶液,调节pH至8.3~8.5。本研究针对OTA的溶解特性,在常用淋洗液的基础上,添加甲醇,使淋洗液中甲醇含量分别为6%、8%、10%、12%和15%(V/V),考察淋洗效果。选用小麦样本基质液加标处理,结果见表3。

表3 淋洗液对回收率的影响(n=6)
从表3可知,当淋洗液中甲醇含量为10%时,回收率为99%,满足检测的需求。甲醇含量在6%和8%时,由于淋洗不干净、有杂质干扰、信号偏高,导致检测结果偏高。甲醇含量在12%和15%时检测结果偏高,可能由于甲醇含量过高改变了原有淋洗液酸碱度体系,导致其净化能力降低。综合考虑,选择甲醇含量为10%的淋洗液。
2.3 在线固相萃取系统中洗脱液体积的优化
OtaTest在线固相萃取柱推荐的洗脱液是含20 mol/L乙酸铵的水/乙腈/乙酸(33/60/7,V/V/V),在线净化的洗脱液全部注入液相色谱柱中,所以需要对洗脱液的洗脱体积进行优化。本研究主要考察了200、300、400L的洗脱体积对OtaTest在线固相萃取柱柱回收的影响。采用阴性小麦样本基质液加标处理,结果见表4。

表4 洗脱液体积对回收率的影响(n=6)
2.4 在线固相萃取柱重复使用次数的确定
通过阴性小麦样品加标回收率检测在线固相萃取柱重复使用次数,加标量为5.0g/kg,经在线赭曲霉毒素A免疫亲和柱净化、检测。连续进样60次。连续测定60次加标回收率的平均值100.7%,变异系数9.6%。参考GB 5009.22—2016 《食品安全国家标准 食品中黄曲霉毒素B族和G族的测定》[25]中免疫亲和柱柱回收率,大于等于80%即为可用商品。赭曲霉毒素A小柱完全满足检测需求。每支在线固相萃取柱重复使用次数为60次,使用成本与进口免疫亲和柱相当。在线净化系统可以连续使用24 h,同时,RIDA®CREST在线固相萃取仪支持2根在线固相萃取柱同步净化和分析, 24 h可净化并检测100个样品,显著提高了检测效率,节省了时间和人力成本,显著优于常规离线净化高效液相色谱检测方法。
2.5 方法的线性范围与检出限
按1.2配制赭曲霉毒素A系列标准工作溶液,在1.4的色谱条件下,经在线免疫亲和柱处理检测,以峰面积为纵坐标(y),对应赭曲霉毒素A质量浓度(g/L)为横坐标(x)绘制标准曲线,曲线的线性范围是质量0.012 5~0.5g/L,线性方程是y=158.378 8x+42.78,R2值为0.999 8,符合GB/T 27417—2017对方法线性的要求(定量方法R2≥0.99)[26]。根据3倍信噪比的峰响应值和样品提取净化的稀释倍数,计算出方法检出限为0.24 μg/kg,10倍信噪比的峰响应值和样品提取净化的稀释倍数,计算出方法定量限为0.50 μg/kg,优于GB/T 5009.96—2016赭曲霉毒素A的检出限和定量限,显著提高了灵敏度。

图2 赭曲霉毒素A标准品经免疫亲和柱处理线性范围液相色谱图
2.6 方法的精密度与准确性
采用OTA添加量为5 μg/kg的阴性小麦粉样品,考察方法的精密度。重复测量7 d,每天测 3次,5个平行样。采用本方法对添加OTA的小麦粉、玉米粉阴性样品考察方法的准确性。添加量分别为1、5、10 μg/kg,每个浓度做6个平行样检测,结果见表4。本方法的加标回收率为80.1%~106.9%,变异系数为2.4%~8.2%。OTA检测方法的日内相对标准偏差(RSD)为3.2%,日间RSD为8.7%,加标回收率为为80.1%~106.9%,变异系数为2.4%~8.2%。方法的精密度和准确性满足国内外相关标准的要求[27-28]。

表5 回收率实验结果(n=6)
2.7 在线净化液相色谱法、离线净化液相色谱法、稳定同位素稀释LC-MS/MS法比较
选用FAPAS能力验证玉米粉样品,经振荡提取后,提取液分成3份,1份用于同位素稀释LC-MS/MS法检测;1份用于在线净化-液相色谱系统进行分析;1份用于离线免疫亲和柱净化液相色谱法。结果见表6。

表6 在线净化、离线净化与LC-MS/MS三种方法测定结果比较
FAPAS玉米粉中赭曲霉毒素A的中间值为3.57 μg/kg,范围是2.00~5.14 μg/kg。从表6结果看,3种方法检测结果平均值均在中间值附近,极差接近。同时通过赭曲霉毒素A定性离子可以判断提取液中目标毒素为赭曲霉毒素A,说明使用的在线免疫亲和柱专一性符合要求。


图3 标准品和样品中赭曲霉毒素A二级质谱图比较
2.8 实际样品分析
应用本方法对来自某地区的 10 份粮食样品(小麦、玉米) 进行赭曲霉毒素A的分析,仅有1份小麦样品有污染,其含量为5.25 μg/kg,其余样品未检出或含量在0.5 μg/kg以下。实际样品分析结果表明,本方法能够满足对样品灵敏、快速、高通量的检测要求,适用于粮食中赭曲霉毒素A全自动在线净化的高通量测定。
3 结论
本研究建立了在线免疫亲和净化-液相色谱快速测定粮食中赭曲霉毒素A的方法,并对提取液和淋洗液条件进行了优化。结果表明,赭曲霉毒素A在0.012 5~0.5 μg/kg范围内呈线性相关,R2值为0.999 8。根据3倍信噪比的峰响应值,确定赭曲霉毒素A的检出限为0.24 μg/kg,赭曲霉毒素A在小麦、玉米样品中加标回收率为80.1%~106.9%,变异系数为2.4%~8.2%。本方法样品净化和检测同步在线进行,操作简单,灵敏度、准确度、精密度等均符合检测需要。同时,该方法支持高通量样品检测,一次装柱(2个),24 h可以检测100个样品,优于常规离线净化检测方法,检测效率高,可用于大批量粮食样品的处理检测。
