猪大肠杆菌性腹泻病的病原分离鉴定及药敏试验
2019-07-17孙晓莉高建潘乐欣胡涛孟斌金天明
孙晓莉,高建,潘乐欣,胡涛,孟斌,金天明
猪大肠杆菌性腹泻病的病原分离鉴定及药敏试验
孙晓莉,高建,潘乐欣,胡涛,孟斌,金天明通信作者
(天津农学院 动物科学与动物医学学院,天津 300384)
通过对天津市某规模化猪场腹泻病猪实质脏器及肠道内容物的细菌分离培养、染色镜检、生化试验、PCR检测及药敏试验,对腹泻病的病原进行分离鉴定。结果表明:分离菌株在显微镜下呈革兰氏阴性短杆菌,生化反应特性与大肠杆菌一致;PCR扩增16S rRNA基因得到1 373 bp的目的条带,经同源性分析,该分离菌株与WTPii241菌株同源性为99.9%,最终确定该分离菌株为大肠杆菌。药敏试验显示该菌株对头孢哌酮和哌拉西林敏感,对头孢曲松、头孢呋辛、卡那霉素、氯霉素中度敏感,对氨苄西林、头孢唑林等8种药物耐药,上述试验结果为猪大肠杆菌性腹泻病的临床用药提供了理论依据。
猪腹泻病;大肠杆菌;分离鉴定;药敏试验
大肠杆菌()又称大肠埃希氏菌,是食品卫生安全评价中重要的指标菌[1],普遍存在于人和动物肠道内,对人和动物具有致病性,常引起严重的败血症和腹泻病[2-3]。仔猪大肠杆菌病是由致病性大肠杆菌引起的仔猪消化道传染病,发病率和死亡率均较高[4]。近年来,仔猪腹泻病已经成为严重危害养猪业发展的疾病之一,常造成仔猪生长缓慢、增重迟缓、致死率增加,给养殖业造成巨大的经济损失[5]。由于养殖过程中不合理的使用抗菌药,导致病菌的耐药性不断增加,给该病的防治带来了极大的困难[6-7],同时对人类健康及公共卫生安全构成严重威胁[8]。
2018年3月,天津市某规模化猪场仔猪发生严重腹泻。通过对病死猪无菌采集病料、细菌分离培养、染色镜检,分离得到6株具有大肠杆菌典型特征的菌株,通过对分离菌株的生化鉴定、PCR检测、药敏试验及动物致病性试验,最终确定该分离菌株为大肠杆菌。
1 材料
1.1 病料
病料采自天津市某规模化猪场送检的5头病死猪实质脏器及肠道内容物。
1.2 试验动物
SPF昆明小鼠18只,购自军事医学科学院实验动物中心。体重20~22 g/只,雌雄各半。
1.3 主要试剂及菌株
MHA培养基、SS培养基、三糖铁培养基、伊红美蓝培养基、麦康凯培养基、胰蛋白胨和细菌微量生化鉴定管购自青岛海博技术有限公司,琼脂粉、革兰氏染液、酵母粉(OXOID)购自北京索莱宝科技有限公司,2×PCR Master Mix购自天根生化科技(北京)有限公司,引物合成、测序由上海捷瑞生物工程有限公司完成,血琼脂平板购自广东环凯生物科技有限公司,药敏纸片购自杭州天和微生物试剂有限公司,质控菌株大肠埃希菌ATCC 25922为实验室保存。
1.4 主要仪器
无菌洁净工作台(SW-CJ-2D型)、PCR扩增仪(BIO RAD)、恒温恒湿培养箱(上海福玛实验设备有限公司)、高压蒸汽灭菌机(山东新华医疗器械股份有限公司)、振荡培养箱(LRH-250-ZII)、电子天平(BIO RAD)、生物显微镜(重庆奥特光学仪器有限公司)。
2 方法
2.1 细菌分离与生长特性观察
剖检腹泻仔猪,无菌采集各实质脏器组织器官及肠道内容物,划线接种于LB琼脂平板上,37 ℃培养18~24 h,次日观察生长情况。从培养基上挑取形态大小不一的单菌落,接种于LB液体培养基中,培养18 h后获得分离菌的纯培养物。
将纯培养物接种于SS培养基、麦康凯培养基、伊红美蓝培养基、三糖铁斜面培养基和血琼脂培养基上,37 ℃培养18~24 h,观察菌落的形态特征,并筛除菌落形态大小相似培养基对应的菌株。
2.2 革兰氏染色镜检
对分离菌株进行革兰氏染色,油镜镜检后观察、记录菌体的形态特征。
2.3 生化试验
选取蔗糖、乳糖、木糖等14种细菌微量生化鉴定管对分离菌株进行生化试验。分别取100 μL细菌悬浊液加入细菌微量生化鉴定管中,37 ℃培养18~24 h后,观察颜色变化,并与《伯杰细菌鉴定手册》进行对比。
2.4 16S rRNA
选择通用引物27F(5'-AGAGTTTGATCCT GGCTCAG-3')和1 492R(5'-TACGGCTACCTT GTTACGACTT-3')扩增分离菌株的16S rRNA片段。PCR扩增体系(25mL)为:菌液 2mL、上下游引物各1mL、2×PCR Master Mix 12.5mL、ddH2O 8.5mL。PCR反应程序为:94 ℃ 5 min,94 ℃ 55 s,55 ℃ 30 s,72 ℃ 1 min,共进行30个循环;72 ℃延伸10 min。反应结束后,用1.2%琼脂糖凝胶电泳检测目的条带,并将PCR产物送至上海捷瑞有限公司测序。测序结果拼接后提交GenBank/Blast查找同源序列,并利用BioEdit软件进行序列分析比对。
2.5 动物致病性试验
将18只SPF昆明小鼠随机分成两组,每组9只。细菌浓度培养至OD600=0.5~0.8,离心后用新鲜LB液体培养基稀释至1×109CFU/mL,试验组小鼠按100 μL/只腹腔注射。对照组腹腔注射等体积无菌生理盐水,每隔2 h观察小鼠临床特征,小鼠死亡后立即对胸腹腔内实质性器官进行细菌学检查。
2.6 药敏试验
参照美国临床和实验标准协会(CLSI)M100-ED28和CLSI M02-ED13标准,对分离菌株进行药敏试验,质控菌株选择标准菌株大肠埃希菌ATCC 25922。从血琼脂平板上挑单菌落接种于LB液体培养基中培养18~24 h,调整菌悬液浓度至0.5麦氏浊度。取100mL菌悬液涂布于MHA平板上,待琼脂充分吸收菌液后,每个平板上放置5个药敏片,置37 ℃培养16~18 h后测量抑菌圈直径。
3 结果与分析
3.1 分离菌株的生长特性观察
从5头发病仔猪体内分离得到6株具有大肠杆菌典型特征的菌株。在麦康凯培养基上,分离菌株呈玫瑰红色、表面光滑湿润略凸起、边缘整齐的圆形大菌落;在伊红美蓝培养基上,呈黑色金属光泽的大菌落;在SS培养基上呈粉红色、表面光滑略凸起、边缘整齐的圆形小菌落;在三糖铁斜面培养基上,斜面和底部均变黄,底部产气;在血琼脂培养基上,分离菌株呈黄色、中等大小的菌落,且周围未发生溶血(图1)。从具有大肠杆菌典型特征的6株菌株中,随机挑选典型菌株进行后续试验。

图1 血平板试验
革兰氏染色后镜检结果表明,该分离菌株为两端钝圆的革兰氏阴性杆菌(图2)。
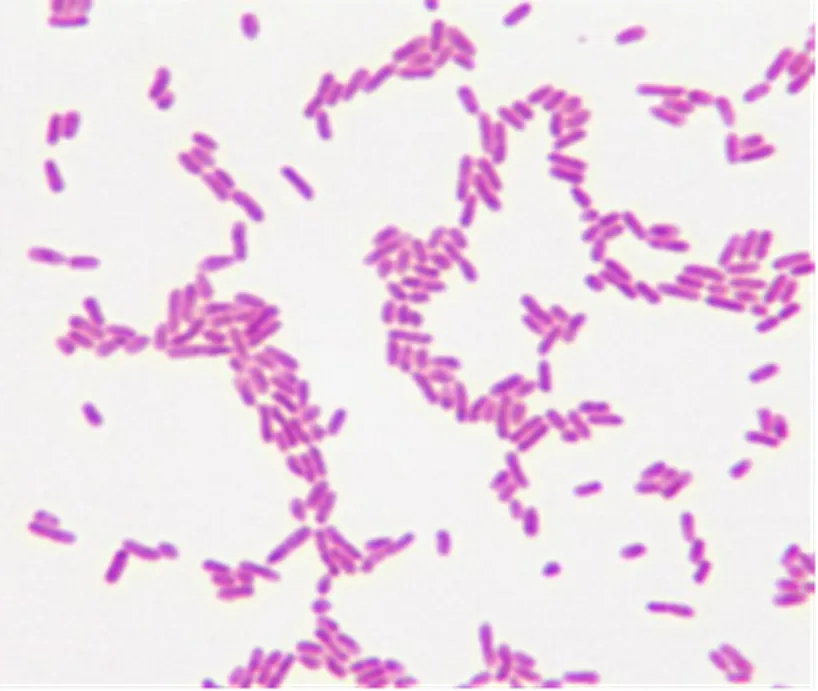
图2 革兰氏染色镜检结果(1 000×)
3.2 生化试验结果
分离菌株生化试验结果参照《伯杰细菌鉴定手册》,符合大肠杆菌的生化特征(表1)。
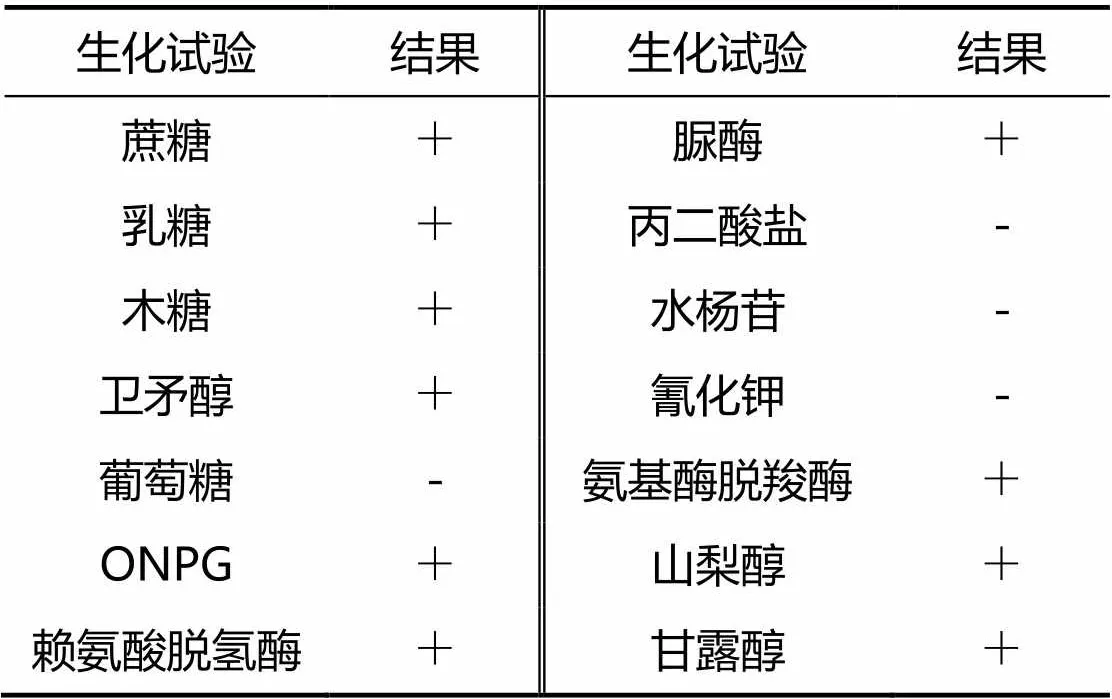
表1 生化试验鉴定结果
注:“+”表示阳性,“-”表示阴性
3.3 16S rRNA及序列比对
对具有典型大肠杆菌特征的分离菌株进行16S rRNA扩增及电泳后,其扩增条带大小为1 373 bp,与大肠杆菌的预期片段大小一致(图3)。经NCBI/blast分析,结果与大肠杆菌WTPii241菌株同源性较高。

图3 16S rRNA片段扩增结果
注:M为DL2501 Marker;1为分离菌株16S rRNA片段扩增结果
3.4 药敏试验结果
在测定的14种药物中,该分离菌株对头孢哌酮和哌拉西林敏感;对头孢曲松、头孢呋辛、卡那霉素、氯霉素中度敏感;对氨苄西林、头孢唑林等8种药物耐药(表2)。
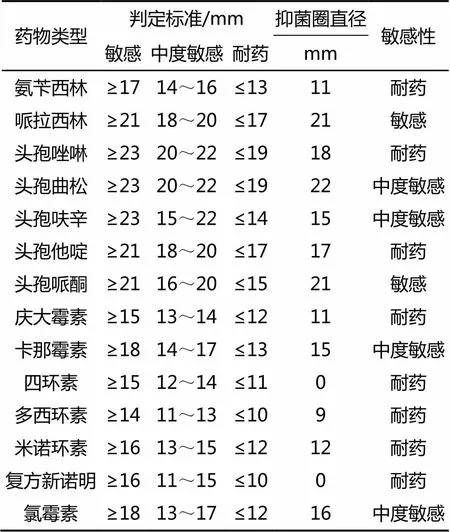
表2 分离菌株药敏试验结果
4 讨论与结论
菌悬液接种小鼠12 h后,试验组小鼠出现运动迟缓、食欲不振等临床症状,对照组小鼠运动和饮食均正常。细菌学检验结果显示,在麦康凯培养基上,分离于猪和小鼠的菌株均呈玫红色圆形菌落;在伊红美蓝培养基上,菌落均呈黑色金属光泽的中等大小菌落。革兰氏染色后菌体形态为两端钝圆的革兰氏阴性杆菌。对该菌株的16S rRNA基因片段进行序列测定,经NCBI/Blast数据库对比分析,该菌株与WTPii241菌株同源性为99.9%,综合上述结果,最终确定该分离菌株为大肠杆菌。药敏结果显示,该菌株仅对头孢哌酮和哌拉西林敏感,对头孢曲松、头孢呋辛、卡那霉素、氯霉素中度敏感,对氨苄西林、头孢唑林等8种药物耐药,故临床治疗药物选择范围窄。
大肠杆菌广泛分布于动物和人肠道内,属于正常寄居菌,其他各血清型大肠杆菌对人和动物均有致病性,主要以腹泻为主。尤其是初生仔猪,极易发生严重腹泻和败血症[9]。近年来,随着养猪业规模迅速扩大,由致病性大肠杆菌引起的仔猪黄痢和白痢发病率逐年增长,导致仔猪成活率低,极大地阻碍了养猪业的健康发展[10]。
本次药敏试验结果证明,分离得到的大肠杆菌对多种药物(例如青霉素类、头孢类药物等)具有较强的敏感性,这可能是由于猪场大量使用这些药物进行预防或在饲料中长期大量添加抗生素所致。另外,临床兽医工作人员在临床诊断治疗前应做药物敏感性试验,再制定针对性治疗。
综上所述,本试验对猪大肠杆菌病进行分离鉴定,并为有效防治该病提供了科学依据,对指导养殖生产具有重要意义和应用价值。
[1] Altalhi A D,Hassan S A. Bacterial quality of raw milk investigated byand isolates analysis for specific viru-lence-gene markers[J]. Food Control,2009,20(10):913-917.
[2] Duffy G,Lynch O A,Cagney C. Tracking emerging zoonotic pathogens from farm to fork[J]. Meat Sei,2008, 78(1-2):34-42.
[3] Badura A,Luxner J,Feierl G,et a1. Prevalence,antibiotic resistance patterns and molecular characterization offrom Austrian sandpits[J]. Environmental Pollution,2014,194(7):24-30.
[4] Zanella A,Alborali G L,Bardotti M,et al. Severe111 septicaemia and polyserositis in hens at the start of lay[J]. Avian Pathology,2000,29(4):311-317.
[5] Zhang W,Zhao M,Ruesch L,et al. Prevalence of viru-lence genes instrains recently isolated fromyoung pigs with diarrhea in the US[J]. Veterinary Microbiology,2007,123(1-3):145-152.
[6] Scott W J. Antimicrobial resistancein in companion animals[J]. Animal Health Research Reviews,2008,9(2): 169-176.
[7] Bennett P M. Plasmid encoded antibiotic resistance:Acquisition and transfer of antibiotic resistance genes in bacteria[J]. British J Pharmacol,2009,153(S1):347-357.
[8] 李淑红,王京仁,成钢,等. 猪大肠杆菌和葡萄球菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医,2012,39(8):195-198.
[9] 周宏伟,施万富,孙如林. 鹅大肠杆菌的分离鉴定[J].畜牧与饲料科学,2008(3):32.
[10] 吴利军,周丹娜,邵志勇,等. 仔猪腹泻大肠杆菌分离鉴定及血清型与耐药性分析[J]. 黑龙江畜牧兽医,2018,57(6):96-97.
Isolation and identification and drug sensitivity test ofof pigs
SUN Xiao-li, GAO Jian, PAN Le-xin, HU Tao, MENG Bin, JIN Tian-mingCorresponding Author
(College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China)
In order to provide a medication scheme for swinedisease, this experiment identified the isolation of strains by the separation of the bacteria culture, staining microscopy, biochemical experiment, PCR detection and drug susceptibility test methods and so on for diarrheal disease pigs’ parenchymal visera and intestinal contents in large-scale swine farms of Tianjin. The results showed that the isolates strain were gram-negative under microscope, which was short rod. Its biochemical reaction was the same as that ofand the strain was sensitive to cefoperazone and piperacillin and was moderate sensitive to ceftriaxone, cefuroxime, kanamycin and chloramphenicol, but resistant to eight drugs, such as ampicillin, cefazolin and so on. PCR amplified the 16S rRNA gene to obtain the desired target band(1 373 bp). Homology analysis results showed that the isolation strain was similar to the WTPii241 strain, with the similarity of 99.9%. The isolate strain was confirmed to bebased on the identification results. These results provide a theoretical basis for the clinical use of diarrhea.
swine diarrhea;; separation and identification; drug sensitive test
S852.61
A
1008-5394(2019)02-0057-04
10.19640/j.cnki.jtau.2019.02.013
2019-03-13
2017年大学生创新创业训练计划项目(201710061107);天津市科技计划项目(17ZXGSNC00030)
孙晓莉(1997-),女,本科在读,研究方向为动物药学。E-mail:361861379@qq.com。
金天明(1968-),男,教授,博士,研究方向为免疫病理学。E-mail:jtm680@163.com。
责任编辑:张爱婷
