大麦成熟胚愈伤组织诱导、继代及分化研究
2019-07-17李晨谢晓东王景太崔春阳王万坤陈小强
李晨,谢晓东,王景太,崔春阳,王万坤,陈小强
大麦成熟胚愈伤组织诱导、继代及分化研究
李晨,谢晓东,王景太,崔春阳,王万坤,陈小强通信作者
(天津农学院 农学与资源环境学院,天津 300384)
以大麦品种G1614成熟胚为研究对象,以MS培养基为基本培养基,探讨2,4-D质量浓度、碳源和成熟胚切割方式对大麦成熟胚愈伤组织诱导的影响,以及NAA/KT配比对大麦愈伤组织分化的影响。结果表明:2,4-D质量浓度为5 mg/L时,大麦成熟胚出愈率较高;30 g/L蔗糖作为碳源时,大麦成熟胚愈伤诱导率较高;纵切大麦成熟胚会促进大麦愈伤组织的诱导;在分化培养基中添加0.5 mg/L NAA和4.0 mg/L KT时,可使大麦愈伤组织获得较高的分化率。
大麦;成熟胚;愈伤组织;分化
大麦(L.)属禾本科植物,为第四大谷类作物,其品种遗传改良研究一直倍受重视[1]。目前,大麦主要作为啤酒生产的原料以及饲料作物使用。我国大麦的年需求量巨大且逐年增加,而国内大麦由于产量和品质等因素的制约难以满足国内市场的巨大需求,导致我国大麦严重依赖于进口,这在一定程度上制约了大麦及其相关产业的发展。因此,如何提高大麦的品质和产量成为我国大麦研究的重点。
组织培养在生物工程育种中扮演了十分重要的角色,是生物工程研究的基础,是遗传转化、植物改良等研究的重要环节之一,在水稻、小麦等禾本科作物上均有广泛应用[2-8]。本研究以MS培养基为基本培养基,以大麦品种G1614的成熟胚为研究对象,研究激素、碳源和切割方式对大麦成熟胚愈伤诱导、继代及分化的影响,旨在优化大麦遗传再生体系,改良大麦产量与品质,同时对大麦转基因等方面研究也具有重要的现实意义。
1 材料与方法
1.1 试验材料
大麦品种G1614种子成熟胚。
1.2 试验方法
1.2.1 培养基基本组成
诱导愈伤培养基1:MS+30 g/L蔗糖+2,4-D+7 g/L琼脂(pH=5.8~6.0),2,4-D质量浓度分别为3、4、5 mg/L。
诱导愈伤培养基2:MS+碳源+6 mg/L 2,4-D+7 g/L琼脂(pH=5.8~6.0),在纵切条件下,不同碳源浓度分别为30 g/L蔗糖、20 g/L蔗糖+10 g/L麦芽糖或30 g/L麦芽糖。
分化培养基:MS+30 g/L 蔗糖+NAA/KT+7 g/L琼脂(pH=5.8~6.0),NAA/KT浓度分别为0.3/3.0、0.3/4.0、0.3/5.0、0.4/3.0、0.4/4.0、0.4/5.0、0.5/3.0、0.5/4.0、0.5/5.0 mg/L。
1.2.2 大麦种子预处理
试验接种前,将保存于4 ℃冰箱的大麦种子取出,25 ℃水中浸泡14~16 h,剥除泡好种子的颖壳,在超净工作台中用75%酒精处理30 s,无菌水冲洗3~5次,5%次氯酸钠处理15 min,再用无菌水冲洗3~5次。
1.2.3 大麦种胚的获取与接种
在超净工作台中用无菌解剖针将消毒处理后大麦籽粒的胚挑出,进行整胚、纵切、横切3种处理,然后接种到培养瓶中,每瓶接种6个,每处理接种25瓶。在黑暗条件下培养15 d后,进行数据统计。
1.2.4 大麦成熟胚愈伤组织的继代
接种15 d后,将G1614成熟胚所诱导的愈伤组织转接到新鲜的继代培养基中,继代培养基为1.2.1中愈伤诱导最优培养基,每周继代1次,共继代3次。
1.2.5 大麦愈伤组织的分化
将连续继代3次之后的愈伤组织进行分化研究,选用KT和NAA为激素,分化培养基配方见1.2.1。每瓶接种5个愈伤组织,每处理接种20瓶,15 d后统计计算愈伤组织分化率。
1.3 培养条件
愈伤组织诱导和继代培养:25 ℃,黑暗条件。愈伤组织分化培养:25 ℃,光照16 h/d。
1.4 数据统计
出愈率(%)=大麦成熟胚出愈块数/大麦种胚接种个数×100%
分化率(%)=大麦分化愈伤块数/大麦愈伤接种块数×100%
数据采用SPSSAU数据分析软件进行数据分析。
2 结果与分析
2.1 2,4-D质量浓度对G1614纵切成熟胚出愈率的影响
由表1可知,在添加30 g/L蔗糖的培养基中,将大麦种子胚纵切,2,4-D质量浓度为5 mg/L时,可获得较高的出愈率,为78.33%。

表1 不同2,4-D质量浓度下大麦成熟胚的出愈率
由表2可知,2,4-D质量浓度和出愈率之间的相关系数值为1.000,并且呈0.01水平的显著性,说明2,4-D质量浓度和出愈率之间呈显著正相关关系。
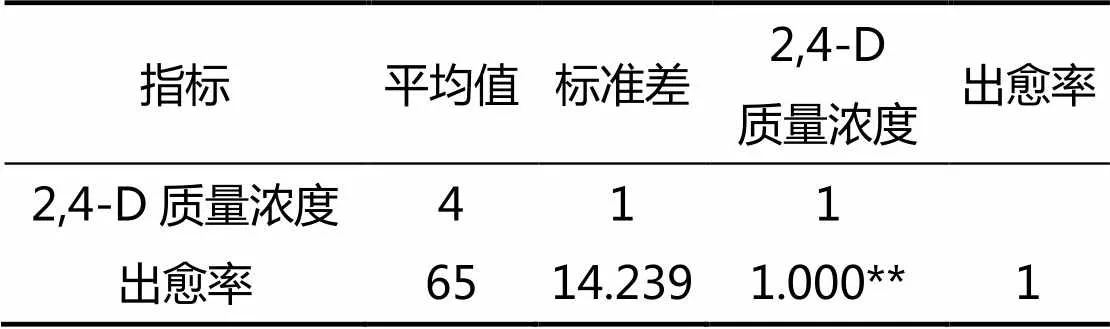
表2 2,4-D质量浓度与大麦出愈率Spearman相关性分析
注:**<0.01
2.2 不同种类碳源对G1614纵切成熟胚出愈率的影响
由表1可知,2,4-D质量浓度为5 mg/L时,有较好的出愈率,因此在分析碳源对大麦纵切胚出愈率的影响时,选择含有5 mg/L 2,4-D的培养基为基本培养基,同时添加不同碳源,将大麦种子胚纵切接种于培养基上,得到碳源对G1614纵切胚出愈率的影响。由表3可知,当培养基中添加30 g/L蔗糖时,可使G1614纵切胚具有较高的出愈率。

表3 碳源对大麦纵切成熟胚出愈率的影响
由表4可知,碳源和出愈率之间的相关系数值为0.500,并且>0.05,说明碳源和G1614纵切胚出愈率之间并没有相关关系。

表4 碳源和大麦纵切成熟胚出愈率Spearman相关性分析
2.3 切割方式对G1614成熟胚出愈率的影响
由表1和表3可知,当培养基中添加5 mg/L 2,4-D和30 g/L蔗糖时,有较好的出愈率,因此,在研究切割方式对G1614愈伤组织的影响时,选择添加5 mg/L 2,4-D和30 g/L蔗糖的培养基为基本培养基。由表5可以看出,纵切G1614成熟胚可以得到较高的出愈率。

表5 切割方式对G1614出愈率的影响
由表6可知,切割方式和出愈率之间的相关系数值为0.500,并且=0.05,说明切割方式和出愈率之间并没有相关关系。
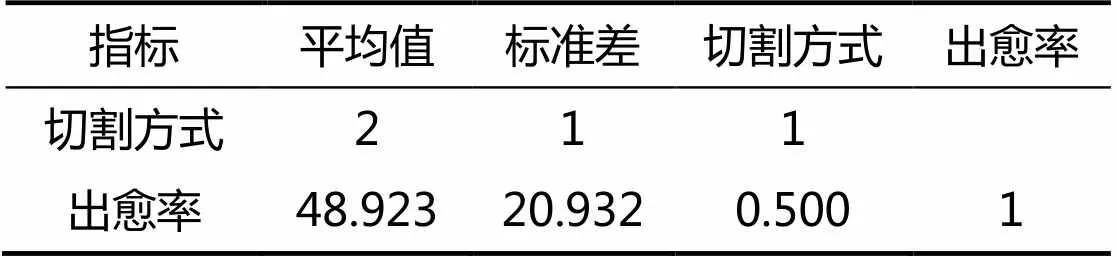
表6 切割方式和大麦纵切成熟胚出愈率Spearman相关性分析
2.4 G1614成熟胚的继代培养
G1614成熟胚在接种3 d后开始长出愈伤组织(图1),随着诱导时间的逐渐增加,愈伤组织的大小、颜色等形态结构都会发生变化,有的愈伤组织会直接发芽。如果培养基长时间不进行替换,因培养基营养成分的消耗等因素的影响,愈伤组织的生长会受到抑制甚至发生褐变,而影响愈伤质量。因此本研究在愈伤诱导15 d之后对愈伤组织进行继代处理,继代培养基为:MS基本培养基+10 g/L蔗糖+20 g/L麦芽糖+6.5 g/L琼脂+3.0 mg/L 2,4-D,每周继代1次,共继代3次。继代之后疏松的愈伤组织发生明显变化,淡黄色致密胚性愈伤组织数量逐渐增多(图2)。

图1 G1614初生愈伤组织

图2 G1614 胚性愈伤组织
2.5 G1614愈伤组织分化研究
对G1614愈伤组织进行分化研究,由表7可知,当NAA/KT浓度为0.5/4.0 mg/L时,愈伤组织分化率可达较高水平。

表7 G1614愈伤组织分化率统计
由表8可知,NAA/KT配比和分化率之间的相关系数值为-0.050,说明NAA/KT配比和分化率间并没有相关关系。
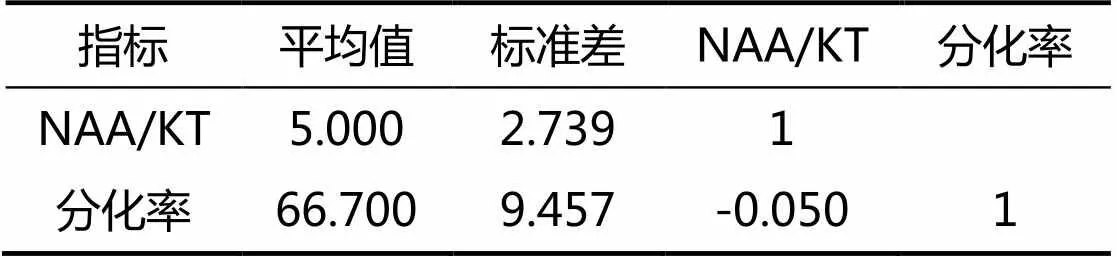
表8 NAA/KT配比和G1614愈伤组织分化率Spearman相关性分析
本研究结果表明,当培养基配方为MS基本培养基+0.5 mg/L NAA+4.0 mg/L KT+0.25 g/L肌醇+1 g/L脯氨酸+1 g/L CH+30 g/L蔗糖+7 g/L琼脂时,对G1614愈伤组织分化效果较为理想。
3 讨论与结论
3.1 大麦成熟胚诱导及其影响因素
大麦成熟胚诱导愈伤组织的影响因素众多,本试验选取了激素浓度、碳源、种胚处理方式对大麦成熟胚诱导愈伤组织的影响进行研究。
大麦成熟胚出愈率研究结果表明,2,4-D诱导大麦成熟胚愈伤组织的最适浓度为4~5 mg/L,而任江萍等用2.0 mg/L 2,4-D对大麦种胚进行愈伤诱导,获得较高的诱导率[9],这与本研究结果存在差异,可能是所选品种不同造成了2,4-D质量浓度对大麦种胚出愈率的影响不同。林国梁等认为添加2.0~5.0 mg/L 2,4-D有利于诱导成熟胚愈伤组织的形成[10]。
大麦成熟胚处理方式对愈伤组织的诱导也有明显影响,虽然本研究中Spearman分析表明切割方式和出愈率之间并没有相关关系。但研究发现,对大麦成熟胚进行整胚接种和横切接种时,在愈伤组织诱导过程中,均有一部分种胚直接发芽,这严重影响了愈伤组织的出愈率。而将种胚进行纵切处理,种胚的直接出芽情况明显减少,同时愈伤组织的出愈率也显著提高。陈升位等通过4种切割处理对成熟胚出愈率的影响进行分析,发现横切部分胚芽、横切部分胚芽-胚根以及纵切部分成熟胚均可提高多棱裸大麦成熟胚的出愈率,横切部分胚根对出愈率没有明显的促进作用[11]。此外,也有研究者将种胚进行刮碎处理,以破坏种胚的完整性,同样取得成功,并减少了种胚的发芽情况[12]。本研究表明在大麦成熟胚诱导愈伤组织时,将种胚进行纵切,愈伤诱导率较高,这与陆瑞菊等的试验结果相一致[13]。
不同种类碳源也会影响大麦成熟胚的出愈率。蔗糖是组织培养中最常用的碳源,在植物组织培养中,糖的用量不仅影响培养物的生长速度和生长量,还影响其代谢水平、次生代谢物的合成、以及细胞的形态和发生,是影响植物组织培养成功与否的关键因素之一[14]。本研究表明,在碳源质量相同时,使用蔗糖和麦芽糖(1∶2)比单纯使用蔗糖做碳源时的愈伤组织出愈率略高,Spearman分析表明没有显著相关性,说明碳源的成分和浓度虽然也会对大麦成熟胚诱导愈伤产生一定的影响,但影响不大。有研究表明,由于培养基的渗透压发生了变化从而对大麦成熟胚的出愈率产生了一定的影响。徐凤在以节节麦幼胚为试验材料、碳源为诱导因素的研究中也表明,碳源种类对节节麦幼胚愈伤组织的诱导没有显著性影响[15]。吕芝香认为葡萄糖、果糖、蔗糖和麦芽糖等碳源对培养组织生长速度虽有差异,但都是良好的碳源[16]。
3.2 愈伤继代及NAA/KT浓度配比对大麦愈伤组织分化的影响
大麦成熟胚愈伤组织分化主要受基因型、激素配比、愈伤组织质量等因素影响[17-18]。大麦成熟胚所诱导的愈伤组织形态和质量各不相同。总体来说愈伤组织分为两种,一种为疏松透明的非胚性愈伤组织,另一种为淡黄色致密的胚性愈伤组织。本研究选用较好基因型的大麦品种G1614作为试验材料,在愈伤诱导15 d后对愈伤组织进行继代处理,结果表明继代促进胚性愈伤组织的数量明显增多。前人也有研究结果表明,非胚性愈伤组织可通过继代转变为胚性愈伤组织[19],这有利于愈伤组织分化苗的形成。
在基因型一定的情况下,选择合适的激素配比是提高愈伤组织分化率的最好方法[20]。有研究表明,6-BA和IAA不同浓度配比对节节麦成熟胚愈伤分化有较大影响[21]。任江萍等认为,添加1.0 mg/L ZT和0.1 mg/L IAA,对愈伤组织诱导分化的效果比较理想[22]。愈伤组织分化培养时期,需降低或完全去掉生长素类物质,才有利于分化苗的形成[23]。添加 l mg/L 6-BA、2,4-D 对抑制愈伤组织的分化有明显效应[22]。本研究中将NAA/KT两种激素进行组合试验,结果表明NAA/KT不同浓度配比对大麦愈伤组织分化率的影响明显不同,从所选几个浓度来看,0.5 mg/L NAA配比4.0 mg/L KT,对G1614成熟胚愈伤组织分化效果较好。
3.3 结论
本研究得到如下结论:
(1)在愈伤诱导过程中,不同2,4-D质量浓度下大麦成熟胚愈伤诱导率存在差异,2,4-D质量浓度为5 mg/L时,大麦成熟胚出愈率较高。
(2)在愈伤诱导过程中,切割方式对大麦成熟胚出愈率影响没有显著性差异,但纵切胚和整胚与横切胚接种出愈率存在差异,纵切种胚的直接出芽情况明显减少。因此,诱导愈伤组织时,将大麦成熟胚进行纵切处理可获得较高的出愈率。
(3)大麦品种G1614愈伤最适分化培养基为:MS基本培养基+0.5 mg/L NAA+4.0 mg/L KT+0.25 g/L肌醇+1 g/L脯氨酸+1 g/L CH+30 g/L蔗糖+7 g/L琼脂。
[1] 胡有良,汪军成,司二静,等. 大麦茎尖愈伤组织的诱导和植株高频再生[J]. 麦类作物学报,2017,37(5):601-608.
[2] 王立艳,裴忠有,孙守钧,等. 不同的激素配比及培养基类型对苏丹草185愈伤组织诱导率的影响[J]. 天津农学院学报,2006,13(4):25-27.
[3] 裴忠有,何朝族. 水稻抗病基因转入3个粳稻品种的抗性初步分析[J]. 植物病理学报,2005,35(3):242-248.
[4] Raineri D M, Bottino P, Gordon M P, et al.- mediated transformation of rice (L.)[J].Bio/ Technol,1990,8(1):33-38.
[5] Chan M T, Chang H H, Ho S L, et al.- mediated production of transgenic rice plants expressing a chimeric alpha amylase promoter beta glucuronidase gene[J]. Plant Mol Biol, 1993, 22:491-506.
[6] Hieiy Y,Ohta S,Komari T,et al. Efficient transformation of rice (L.) mediated byand sequence analysis of the boundaries of the T-DNA[J]. Plant J,1994,6(2):271-282.
[7] 黄大年,朱冰,杨炜,等. 抗菌肽B基因导入水稻及转基因植株的鉴定[J]. 中国科学(C辑),1997,27(1):55-62.
[8] 黄璐,卫志明. 农杆菌介导的玉米遗传转化[J]. 实验生物学报,1999,32(4):381-389.
[9] 任江萍,李磊,王新国,等. 大麦幼胚离体培养条件的建立[J]. 麦类作物学报,2005,25(6):25-28.
[10] 林国梁,李佳春,王兴珍,等. 2,4-D和干燥处理对小麦成熟胚愈伤组织诱导与分化的影响[J]. 麦类作物学报,2012,32(5):858-862.
[11] 陈升位,胡扬帆,王楠,等. 切割处理和2,4-D对多棱裸大麦离体成熟胚出愈率的影响[J]. 麦类作物学报,2014,34(12):1645-1650.
[12] Lan Q,Yang J M, Hua W. Screening barley varieties with high regeneration rate using mature embryo culture[J]. Barley and Cereal Sciences,2012(2):1-6.
[13] 陆瑞菊,黄剑华. 胚分割对大麦成熟胚离体培养的影响[J]. 上海农业学报,1990,6(3):20-22.
[14] 王刚,陈宝刚,刘东升. 蔗糖在植物组织培养中的效应[J]. 林业勘查设计,2007(1):53-55.
[15] 徐凤. 节节麦幼胚和成熟胚再生体系建立[D]. 杨凌:西北农林科技大学,2016.
[16] 吕芝香. 碳源种类和浓度对愈伤组织生长的影响[J]. 植物生理学通讯,1981(6):1-5.
[17] 余桂红,张旭,孙晓波,等. 大麦苏啤4号幼胚愈伤组织的诱导及植株的高频再生[J]. 江苏农业学报,2013,29(5):953-956.
[18] 王锋. 农杆菌介导的耐盐基因对大麦幼胚及其愈伤组织的遗传转化[D]. 武汉:华中农业大学,2014.
[19] 郭晓琳. 大麦成熟胚高效再生体系的建立和改良直链淀粉的转基因研究[D]. 武汉:华中农业大学,2005.
[20] 包文泉,马晓璐,白玉娥,等. 西部沙樱枝条愈伤组织诱导、增殖及分化培养[J]. 分子植物育种,2018,16(13):4363-4367.
[21] He T, Jia J F. High frequency plant regeneration from mature embryo explants of highland barley(L.var. nudum Hk. f.) under endosperm-supported culture [J]. Plant Cell Tissure Organ Culture,2008,95(2):251-254.
[22] 任江萍,李磊,王新国,等. 大麦幼胚离体培养条件的建立[J]. 麦类作物学报,2005,25(6):25-28.
[23] 王镨,宋家祥,付群英. 药用植物决明的愈伤组织诱导与生长增值的培养条件研究[J]. 中草药,1997(12):739-742.
Study on callus induction, subculture and differentiation of mature embryo of barley
LI Chen, XIE Xiao-dong, WANG Jing-tai, CUI Chun-yang, WANG Wan-kun, CHEN Xiao-qiangCorresponding Author
(College of Agronomy and Resource Environment, Tianjin Agricultural University, Tianjin 300384, China)
In this study, G1614 was used as plant materials. The effects of different concentrations of 2,4-D, different kinds and concentrations of carbon source, and different cutting ways to mature embryos on the callus induction of mature embryos from barley G1614 were studied with MS medium as basic medium. And the effects of different concentrations of KT and NAA on the differentiation of barley callus were also studied. The results showed that inducing rate of callus were higher at 5 mg/L 2,4-D. Callus induction rate of mature barley embryos using 30 g/L sucrose as carbon source was higher. The induction rate of barley callus was promoted by longitudinal cut of mature embryo. The addition of 0.5 mg/L NAA and 4.0 mg/L KT in the differentiation medium resulted in a higher differentiation rate of G1614 callus.
barley; mature embryo; callus; differentiation
S512.3
A
1008-5394(2019)02-0008-05
10.19640/j.cnki.jtau.2019.02.002
2019-03-06
天津农学院大学生创新创业训练计划(201801024)
李晨(1996-),女,本科在读,研究方向:种子科学与工程。E-mail: 2450370740@qq.com。
陈小强(1976-),女,副教授,博士,主要从事植物细胞工程及遗传育种相关工作。E-mail: chenxia9663@126.com。
责任编辑:宗淑萍
