磷高效转基因水稻连续种植对土壤微生物功能多样性的影响
2019-07-17陈静怡刘瑞华王丽丽李静李刚杨殿林赵建宁通信作者
陈静怡,刘瑞华,王丽丽,李静,3,李刚,杨殿林,赵建宁,通信作者
磷高效转基因水稻连续种植对土壤微生物功能多样性的影响
陈静怡1,2,刘瑞华1,2,王丽丽2,李静2,3,李刚2,杨殿林2,赵建宁2,通信作者
(1. 天津农学院 农学与资源环境学院,天津 300384;2. 农业农村部环境保护科研监测所,天津 300191;3. 东北农业大学 资源与环境学院,哈尔滨 150030)
为评价磷高效转基因水稻对土壤微生物功能多样性的影响,以磷高效转基因水稻OsPT4为研究对象,设施磷和不施磷两种处理,基于Biolog生态平板法,分析比较了4个生育时期的OsPT4及其亲本‘日本晴’对土壤微生物功能多样性的影响。结果显示:OsPT4和‘日本晴’的土壤微生物群落平均吸光值均随培养时间的延长而增加,但不同生育时期最大值和生长趋势有所不同。土壤微生物多样性指数分析结果显示,OsPT4和‘日本晴’的Shannon多样性指数和Simpson优势度指数在全生育时期均表现为施磷处理高于不施磷处理;OsPT4的Shannon指数在分蘖期和拔节期差异显著,抽穗扬花期和成熟期则差异不显著,Simpson指数则表现为前3个生育时期差异不显著,而在成熟期出现显著差异;OsPT4和‘日本晴’的McIntosh均匀度指数均在分蘖期最大,且远高于其他3个生育时期;OsPT4的McIntosh指数在全生育时期均无显著差异。不同类型碳源利用显示,OsPT4和‘日本晴’均以糖类、羧酸类和氨基酸类为主要碳源。主成分分析显示,‘日本晴’呈聚集分布,OsPT4呈分散分布,表明二者在土壤微生物群落碳源的代谢利用上存在差异。综上所述,OsPT4与非转基因水稻相比,不同施磷条件和不同生育时期对土壤微生物群落活性、多样性指数、优势度指数和碳源主成分分布有所影响。
水稻;磷高效;转基因;土壤微生物;Biolog生态平板法
转基因生物技术在农业领域的应用与发展取得了令全球瞩目的成就,为未来可持续发展和短时间内解决饥饿与营养问题提供了一条新途径[1]。2016年,转基因作物商业化进入第21年,据国际农业生物技术应用服务组织(ISAAA)统计,2016年转基因作物全球种植面积已达1.85亿hm2,比上年增加了3%,是1996年的110倍[1]。但随着转基因作物的大面积种植,其潜在的风险性和安全性,引起了人们的担忧和争议[2]。
转基因作物直接或间接地对土壤微生物产生影响[3]。直接影响是外源基因表达产物如作物残体和根系分泌物等对非靶标土壤微生物作用而产生影响[4];间接影响是外源基因通过基因漂移水平转移到土壤微生物群落基因组中,从而对其功能结构产生影响[4]。土壤微生物是土壤生态环境中的重要组成部分,许多物质转化和能量交换等过程都离不开土壤微生物参与[5-7]。研究发现,保持土壤微生物群落多样性有利于维持生态系统的多功能性,进而对生态系统的稳定和可持续发展具有重大意义[8-9]。因此,转基因作物对土壤生态环境尤其是对土壤微生物群落多样性产生的影响成为研究的热点[10]。
目前,利用生物技术培育养分高效型转基因作物是应对我国施肥量不断增加、肥料利用率不高等问题的有效途径[11]。养分高效型作物可以有效改善和提高作物对土壤养分的利用[12]。如磷高效转基因水稻,就是通过生物技术手段培育出的可以提高水稻对磷素利用的新材料,经实验验证,与常规水稻相比,磷高效转基因水稻对磷的吸收和转运效率均有显著提升,可使水稻在低磷浓度情况下仍能获得大量磷素而满足自身生长发育的需要[13-14]。已有一些关于磷高效转基因作物对土壤微生物影响的研究,如金凌波等[15]认为磷高效转基因大豆对土壤微生物群落的数量及结构均没有显著影响;臧怀敏等[16]对磷高效转基因水稻进行研究发现,水稻在个别生育时期对土壤微生物的香农-威纳指数(Shannon-Wiener index)、丰富度和均匀度均有显著影响。
为继续探明磷高效转基因水稻对土壤微生物群落的影响,本研究以连续种植4年的磷高效转基因水稻OsPT4为研究对象,采用含有31种不同碳源的Biolog生态微平板分析法,分析碳源平均颜色变化率()、微生物Shannon指数、Simpson指数和Mclntosh多样性指数、6类碳源利用率、因子荷载值和主成分分析,研究OsPT4对土壤微生物生长活性、碳源代谢强度及功能利用多样性等的影响,以期为磷高效转基因水稻的生态环境安全评价提供一定的理论依据。
1 材料与方法
1.1 供试材料与试验地概况
供试材料为磷高效转基因水稻OsPT4及其非转基因亲本水稻‘日本晴’,均由南京农业大学资源与环境科学学院植物营养分子生物学实验室提供。
试验地位于天津市南开区农业部环境保护科研监测所网室内,每小区1 m2,供试土壤采自天津市津南区未种植过作物的荒地。供试土壤理化性质为:pH 8.21,有机质24.55 g/kg,全氮0.96 g/kg,全磷1.19 g/kg。
1.2 试验设计与处理
OsPT4和‘日本晴’均设施磷(15 g/m2)和不施磷两个处理,各5次重复,即OsPT4施磷、OsPT4不施磷、‘日本晴’施磷、‘日本晴’不施磷,各种植5个小区且小区随机分布。以磷酸二氢钾为磷源,全部用作基肥。氮源和钾源以尿素和硫酸钾为来源,分别施氮20 g/m2和施钾18 g/m2。其中,在种植前施用50%氮肥用作基肥,余下50%氮肥用作追肥,钾肥则全部用作基肥。
试验从2013年开始,连续种植4年。2017年5月将水稻种子在培养盘中培养半月,待幼苗长至15 cm左右时将其移栽到网室小区中,每小区移栽30株。试验过程中浇水量及管理条件保持一致,施肥情况按试验设计。分别在水稻的分蘖期(播种后50 d)、拔节期(播种后80 d)、抽穗扬花期(播种后110 d)和成熟期(播种后140 d)采集土样。采集土样时去除表面杂草和枯枝落叶,分别在各小区选取3株水稻,用直径3.5 cm的土钻在距水稻主茎2 cm处取20 cm深的土样,并将每小区的样品分别混合,用于土壤微生物多样性分析。
1.3 试验方法
首先对土壤样品、Biolog生态板和试验材料做预处理,在常温下(25 ℃)将土壤样品活化2 h,Biolog生态板常温下放置0.5 h,试验材料均做灭菌处理。将配制好试验所需的0.85% NaCl溶液,于高温高压灭菌锅内做灭菌处理,得到无菌NaCl溶液。取10 g新鲜土样放入无菌三角瓶中,加90 mL无菌NaCl溶液,用封口膜封口并留呼吸孔。将三角瓶放在恒温摇床上250 r/min水平震荡30 min,吸取5 mL上清液于新的无菌三角瓶中,加入45 mL无菌NaCl溶液,重复该过程,直至最终得到稀释比为1∶1 000混合悬浊液。在Biolog生态平板每孔中注入150 μL混合悬浊液,接种完成后进行微生物平板培养。将平板放入25~28 ℃恒温培养箱中培养168 h,每隔24 h测定一次平板在590 nm和750 nm波长下的吸光值。
1.4 数据处理与分析
(1)生态板孔中溶液平均吸光值(平均颜色变化率)用于描述土壤微生物代谢活性,见公式(1):
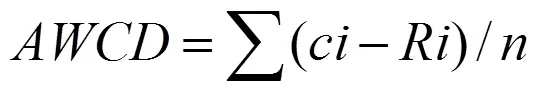
式中,为含有培养基孔的吸光值即590 nm波长下的吸光值,为对照孔的吸光值即750 nm波长下的吸光值,为培养基孔数,Biolog生态板=31。
(2)Shannon多样性指数用于评估物种的丰富度,见公式(2):
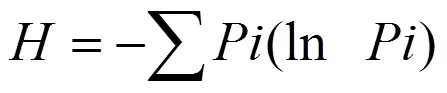
式中,为第孔的相对吸光值与所有相对吸光值总和的比值,见公式(3):
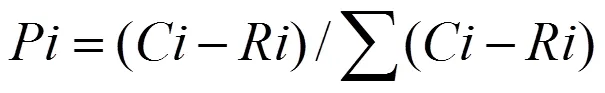
(3)Simpson 优势度指数用于评估某些最常见种的优势度,见公式(4):
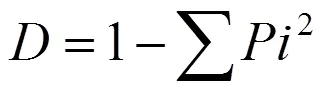
(4)McIntosh均匀度指数用于评估物种的均匀度,见公式(5):

微生物多样性指数显著性分析采用单因素方差分析,选取96 h平均颜色变化率对微生物碳源利用进行主成分分析(PCA),方差分析和主成分分析借助SPSS16.0 软件,图表用Origin9.1绘制。
2 结果与分析
2.1 土壤微生物群落AWCD变化特征
培养开始后,每隔24 h测定平板在590 nm和750 nm波长下的吸光值,得到平均吸光值,进而得到随时间的动态变化图(图1)。由图1可知,随培养时间的延长,OsPT4及其亲本‘日本晴’在不同生育时期的变化均呈增长趋势,但增长速率及最大值有所不同。
土壤微生物群落的值均在培养168 h时达到最大,分蘖期的最大值变化范围为0.4~1.0,其他3个生育时期的最大值均在0.4以下,表明分蘖期土壤微生物群落代谢活性比较强,高于其他3个时期。分蘖期土壤微生物群落从24 h开始增长,到120 h增长速率逐渐减缓。拔节期OsPT4在不施磷条件下72 h后增长速率骤然增加,值为0.2,96 h后趋于平缓,施磷条件下在96 h增长速率骤然增加,为0.15,120 h后趋于平缓,而‘日本晴’曲线平缓且接近于0,与磷高效转基因水稻形成鲜明对比,表明在拔节期土壤微生物代谢活性非常微弱。抽穗扬花期和成熟期的值曲线趋势基本一致,72 h前增长速率较小,72 h后增长速率明显增大,表明OsPT4和‘日本晴’在抽穗扬花期和成熟期72 h后土壤微生物群落代谢活性逐渐增强。
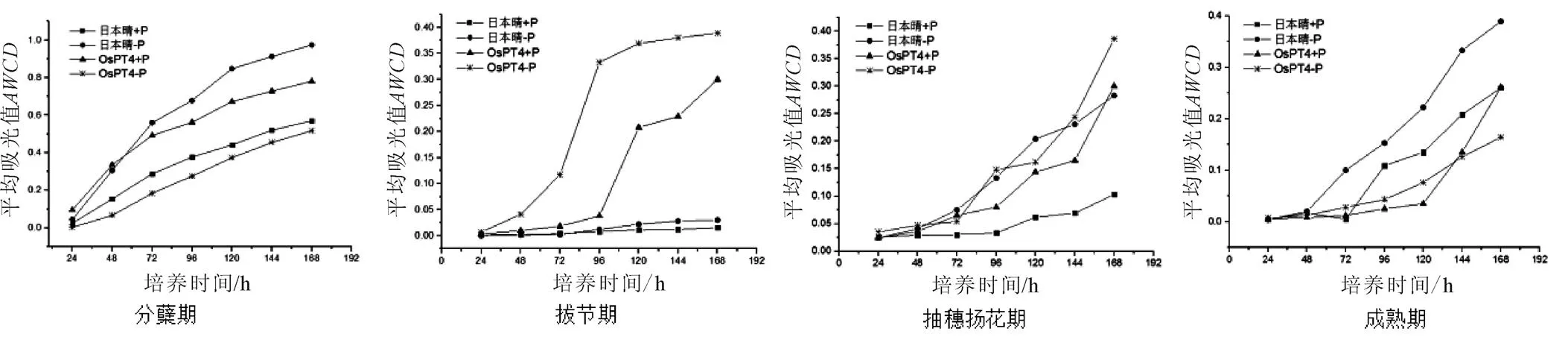
图1 土壤微生物群落AWCD值随时间的动态变化
注:+P为施磷处理;-P为不施磷处理。下同
2.2 土壤微生物群落功能多样性指数
对OsPT4及其亲本‘日本晴’进行多样性指数统计分析,如表1所示。OsPT4和‘日本晴’Shannon多样性指数在全生育时期均为施磷处理高于不施磷处理。OsPT4对比‘日本晴’Shannon指数,在分蘖期和拔节期有显著差异(0.05),抽穗扬花期不施磷处理也有显著差异(<0.05),成熟期则差异不显著(<0.05)。分析Simpson 优势度指数,得到与多样性指数相同的结果,OsPT4和‘日本晴’在全生育期均为施磷处理高于不施磷处理。OsPT4对比‘日本晴’Simpson指数,在分蘖期、拔节期和抽穗扬花期均无显著差异(<0.05),反而在成熟期出现显著差异(<0.05)。OsPT4和‘日本晴’McIntosh均匀度指数,均在分蘖期值最大,且远大于其他3个时期,OsPT4对比‘日本晴’在拔节期差异显著(<0.05),到抽穗扬花期和成熟期差异不显著(<0.05)。

表1 土壤微生物群落功能多样性指数
注:同列数据后不同小写字母表示差异显著(<0.05)
2.3 土壤微生物群落对不同类型碳源的利用强度
由图2可知,OsPT4和‘日本晴’的土壤微生物群落对不同类型碳源的利用均以糖类、羧酸类和氨基酸类为主,对这3类碳源的利用率达60%以上,其中对糖类利用率占20%~40%,对羧酸类利用率占15%~25%,只有未施磷条件下OsPT4成熟期对糖类、羧酸类及氨基酸类的利用未达到60%,同时对多聚物的利用占比较大。施磷条件下,OsPT4和‘日本晴’均在抽穗扬花期对3类主碳源的利用率最大,成熟期则大幅下降,是因为增大了对多聚物的利用率。未施磷条件下,OsPT4和‘日本晴’对糖类利用的变化趋势相同,均在分蘖期对糖类利用率最大,拔节期降到最低,在抽穗扬花期和成熟期又逐渐递增。
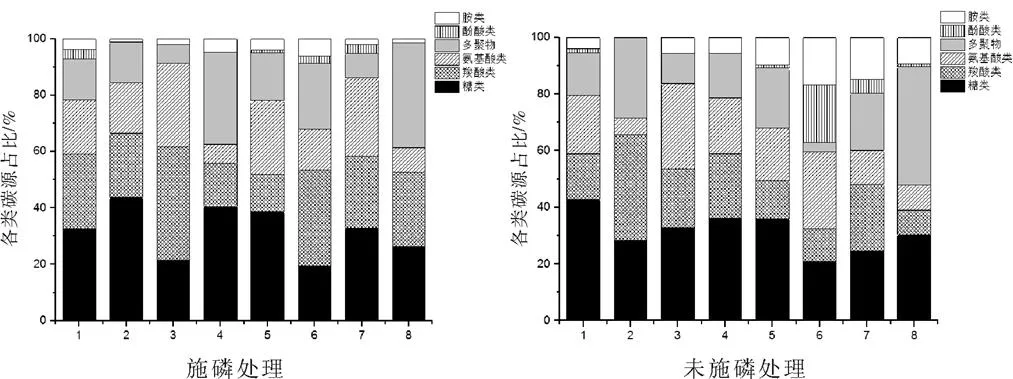
图2 土壤微生物群落对不同碳源的利用率
2.4 土壤微生物群落对不同碳源代谢的主成分分析
2.4.1 不同碳源在主成分上的载荷值
对OsPT4和‘日本晴’进行31种碳源的主成分载荷因子分析,结果如表2。与第一主成分(PC1)具有较高相关性的碳源有14种,其中糖类及其衍生物6种,氨基酸类3种,多聚物2种,酚酸类2种,羧酸类1种。表明影响第一主成分的碳源主要有糖类及其衍生物和氨基酸类。与第二主成分(PC2)具有较高相关性的碳源有4种,其中羧酸类2种,氨基酸类1种,胺类1种。表明影响第二主成分的碳源主要有羧酸类。

表2 31种碳源的主成分载荷因子
2.4.2 主成分分布
分析OsPT4和‘日本晴’的土壤微生物群落对第一、第二主成分的代谢利用,得到其分布特征,如图3。由图3可见,OsPT4特征值分布比较分散,而‘日本晴’特征值分布比较集中。在PC1轴上,OsPT4特征值大部分分布在PC1轴的正轴上,‘日本晴’则全部分布在负轴上;在PC2轴上,OsPT4特征值广泛分布,‘日本晴’则由于不同施肥处理特征值呈现不同分布,施磷处理均分布在正轴,未施磷处理分布在负轴。表明OsPT4和‘日本晴’的土壤微生物群落对第一、第二主碳源的代谢利用存在一定差异,不同施肥条件是引起差异的原因之一。
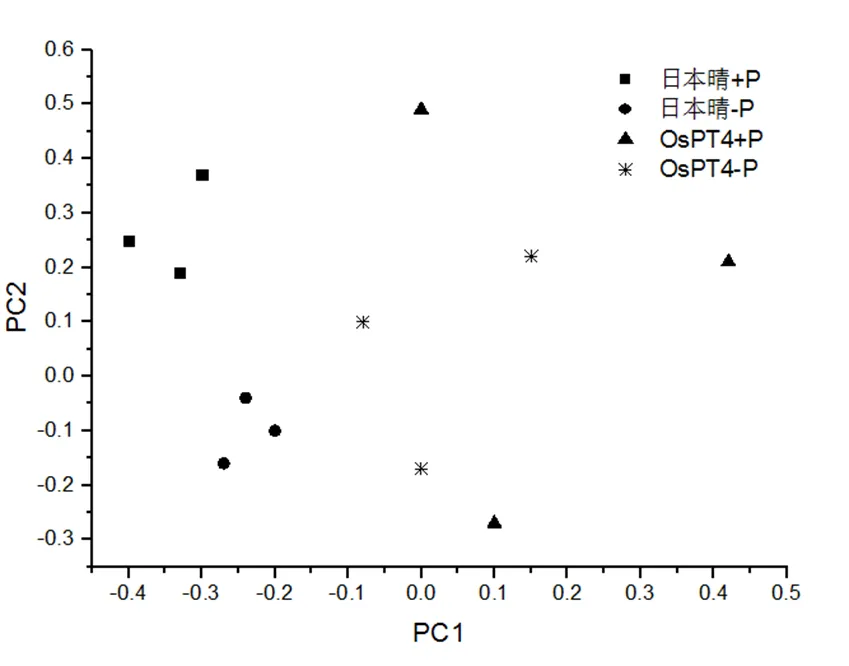
图3 土壤微生物群落碳源利用主成分分析
3 讨论
目前,国内外学者就转基因作物对土壤微生物群落的影响做了大量研究。如刘华等[17]从华东地区14个长期种植转基因棉花的区域采集了210个点的土壤微生物进行基因检测,试验结果显示均未得到目的条带,认为目的基因没有漂移到土壤微生物中,转基因棉花对土壤微生物没有产生影响。Saxena等[18]研究转基因玉米对比非转基因玉米土壤中可培养细菌、放线菌和真菌数量没有显著差异,之后又有学者采用多种分子生物技术证实,转基因玉米对土壤微生物群落多样性没有显著影响[19-20]。但也有一部分学者认为转基因作物对土壤微生物群落产生了一定的影响,但这种影响远不如作物的生育时期、生长季节、施肥条件、田间管理等对土壤微生物的影响大[19,21]。如陈晓雯等[22]研究发现,转基因水稻在生育旺盛期对土壤细菌数量、土壤微生物遗传多样性及功能多样性均有影响,但随着生育时期的延长,影响逐渐减弱,到成熟期影响逐渐消失。Siciliano等[23]对抗草甘膦的转基因油菜研究显示,转基因油菜对根际微生物群落的数量、种类和结构均有显著影响,但影响仅存在生长季,在收获后的冬季,转基因与非转基因油菜对根际微生物的影响则无显著性差异。也有一部分学者认为转基因作物对土壤微生物群落产生了显著影响,如王洪兴等[24]研究转基因水稻,认为其秸秆降解对土壤细菌有显著影响,是因为转基因表达分泌的Bt蛋白进入土壤从而影响土壤微生物。还有芮玉奎等研究显示,转抗虫棉发现其根际土壤的蛋白含量显著高于常规水稻[25]。
从本研究结果看,虽然每个生育期土壤微生物群落平均吸光值均表现为随时间延长对碳源代谢活性增强,但每个生育时期的变化趋势有所不同,对于变化趋势的研究有关学者得出的结果也不尽相同。本研究中分蘖期的土壤微生物群落变化趋势和王丽娟等[26]成熟期转基因大豆的研究结果相似,抽穗杨花期和成熟期的土壤微生物变化趋势与张瑞等[27]成熟期玉米-小麦轮作的研究结果相似,表明影响土壤微生物代谢活性的因素很多,如作物类型、土壤类型、生育时期、轮作管理等。
分析土壤微生物群落多样性指数,不同施磷处理对OsPT4和‘日本晴’土壤微生物群落的Shannon多样性指数和Simpon优势度指数有影响,且呈正相关,施磷可以提高其丰富度和优势度,表明施磷有利于多种土壤微生物群落生长且也有利于优势种群的生长。张恩平等[28]研究不同施肥处理对番茄土壤微生物群落多样性指数影响也得出同样的结果,其施肥处理的多样性指数和优势度指数均高于不施肥处理,认为施肥能显著提高土壤微生物种类,可见不同施肥处理对土壤微生物群落丰富度与优势度影响显著。OsPT4对比‘日本晴’,Shannon多样性指数在分蘖期和拔节期显示出差异显著,抽穗扬花期和成熟期则差异不显著;Simpon优势度指数在前3个生育期差异不显著,成熟期则出现差异,可以看出生育期对土壤微生物多样性指数有显著影响。多数学者认为在作物生长旺盛期微生物多样性指数有显著差异,但随着作物生育期延长,差异不显著。如陈晓雯等[22]通过研究转基因水稻对土壤微生物群落结构的影响得出,水稻生长旺盛期对土壤微生物数量、遗传和功能多样性有显著影响,但这种影响并不持续,随着水稻生长发育影响会逐渐消失。臧怀敏等[16]研究也发现,OsPT4的土壤微生物均匀度指数在拔节期和抽穗扬花期与其亲本‘日本晴’有显著差异,而在成熟期并没有显著差异。本研究通过连续4年的种植试验发现,OsPT4仅在个别生育时期对土壤微生物群落有显著影响。
分析碳源利用情况,OsPT4与‘日本晴’均以糖类、氨基酸类和羧酸类为主要利用碳源,利用率达60%以上,主成分分析结果表明,OsPT4和‘日本晴’的土壤微生物对碳源的利用存在显著差异,说明其代谢特征存在差异,而且不同施磷处理的OsPT4和‘日本晴’土壤微生物主成分代谢分布也存在差异,说明不同施磷处理会影响土壤微生物的代谢功能。郝晓晖等[29]研究分析主成分指出,不同施肥处理对土壤微生物群落碳源利用能力影响不同。时鹏等[30]研究发现,不同种植方式也会改变土壤微生物群落代谢特征。
Biolog生态平板法是一种广泛应用于研究土壤微生物群落功能多样性的快速高效的方法[31],但由于培养板中营养成分和培养时间的局限性,使得该技术只能表征快速生长或富营养微生物的活性,因此还需要结合其他研究方法和手段才能全面解析土壤微生物群落功能和结构多样性[32]。
4 结论
(1)磷高效转基因水稻OsPT4与其受体亲本‘日本晴’相比,对碳源的代谢活性均随培养时间的延长而增长,但在各个生育时期的增长趋势有所不同;对碳源的利用呈现规律一致,均以糖类及羧酸类为主要利用碳源;OsPT4与其受体亲本‘日本晴’对碳源的代谢利用存在差异。
(2)土壤微生物群落的多样性指数显示在部分生育时期出现显著差异,这种差异主要因施肥条件和生育时期的不同而变化。
[1] Clive James. 2015年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2016,36(4):1-11.
[2] 焦悦,梁晋刚,翟勇. 转基因作物安全评价研究进展[J]. 作物杂志,2016(5):1-7.
[3] 杨永华. 转基因作物对土壤微生物群落的影响及主要研究策略[J]. 农业生物技术学报,2011,19(1):1-8.
[4] 张艳军,谢明,彭德良. 转基因作物对土壤微生物的影响[J]. 应用生态学报,2013,24(9):2685-2690.
[5] Pankhurst C E,Keller K O,Gupta V V S R. Biodiversity of soil microbial communities in agricultural systems[J]. Biodiversity and Conservation,1996,5(2):197-209.
[6] Copley J.Ecology goes underground[J].Nature2000,406(6795):452-454.
[7] Harris J A.Measurements of the soil microbial community for estimating the success of restoration[J].EuropeanJournal of Soil Science2003,54(4):801-808.
[8] 李光宇,吴次芳. 土壤微生物研究在农田质量评价中的应用[J]. 土壤学报,2018,55(3):543-557.
[9] Bender S F,Wagg C,van der Heijden M G A. An underground revolution:Biodiversity and soil ecological engineering for agricultural sustain ability[J]. Trends in Ecology and Evolution,2016,31(6):440-452.
[10] 燕丽萍,刘翠兰,李丽,等. 转基因苜蓿对土壤微生物的影响[J]. 草业学报,2012,21(5):63-68.
[11] Zhang F S,Cui Z L,Wang J Q,et al. Current status of soil and plant nutrient management in China and improvement strategies[J]. Chinese Bulletin of Botany,2007,24(6):687-694.
[12] Rengel Z,Damon P M. Crops and genotypes differ in efficiency of potassium uptake and use[J]. Physiologia Plantarum,2008,133(4):624-636.
[13] Roger A,Libohova Z,Rossier N,et al. Spatial variability of soil phosphorus in the Fribourg canton,Switzerland[J]. Geoderma,2014,217/218:26-36.
[14] Hu B,Zhu C G,Li F,et al.plays a pivotal role in the regulation of multiple phosphate starvation responses in rice[J]. Plant Physiology,2011,156(3):1101-1115.
[15] 金凌波,周峰,姚涓,等. 磷高效转基因大豆对根际微生物群落的影响[J]. 生态学报,2012,32(7):2082-2090.
[16] 臧怀敏,李刚,修伟明,等. 磷高效转基因水稻OsPT4种植对土壤细菌群落多样性的影响[J]. 农业环境科学学报,2016,35(3):500-506.
[17] 刘华,常晓蕾,蒋玮,等. 转基因棉花中选择性标记基因Ⅱ对土壤微生物的影响[J]. 上海农业学报,2017,33(2):7-12.
[18] Saxena D,Flores S,Stotzky G. Bt toxin is released in root exudates from 12 transgenic corn hybrids representing three transformation events[J]. Soil Biology and Biochemisrty,2002,34:133-137.
[19] Baumgarte S,Tenne C C. Field studies on the environmental fate of theBt-toxin produced by transgenic maize(MON810)and its effect on bacterial communities in the maize rhizosphere[J]. Molecular Ecology,2005,14:2539-2551.
[20] Griffiths B S,Caul S,Thompson J,et al. Soil microbial and faunal community responses tomaize and insecticide in two soils[J]. Journal of Environmental Quality,2006,5:734-741.
[21] Liu B,Zeng Q,Yan F M. Effects of transgenic plants on soil microorganisms[J]. Plant and Soil,2005,27:1-13.
[22] 陈晓雯,林胜,尤民生,等. 转基因水稻对土壤微生物群落结构及功能的影响[J]. 生物安全学报,2011,20(2):151-159.
[23] Siciliano S D,Germida J J. Taxonomic diversity of bacteria associated with the roots of field-grown transgeniccv. Quest,compared to the non-transgeniccv. Excel andcv. Parkland[J]. FEMS Microbiology Ecology,1999,29(3):263-272.
[24] 王洪兴,陈欣,唐建军,等. 转基因水稻秸秆降解对土壤微生物可培养类群的影响[J]. 生态学报,2004,24(1):89-94.
[25] 芮玉奎,朱本忠,罗方波. 转基因抗虫棉()伤流中Bt毒蛋白的运输[J]. 植物学通报,2005,22(3):320-324.
[26] 王丽娟,李刚,赵建宁,等. 转基因大豆对根际土壤微生物群落功能多样性的影响[J]. 农业环境科学学报,2013,32(2):290-298.
[27] 张瑞,张贵龙,陈冬青,等. 不同施肥对农田土壤微生物功能多样性的影响[J]. 中国农学通报,2013,29(2):133-139.
[28] 张恩平,田悦悦,李猛,等. 长期不同施肥对番茄根际土壤微生物功能多样性的影响[J]. 生态学报,2018,38(14):1-9.
[29] 郝晓晖,胡荣桂,吴金水,等. 长期施肥对稻田土壤有机氮、微生物生物量及功能多样性的影响[J]. 应用生态学报,2010,21(6):1477-1484.
[30] 时鹏,高强,王淑平,等. 玉米连作及其施肥对土壤微生物群落功能多样性的影响[J]. 生态学报,2010,30(22):6173-6182.
[31] 郑华,陈法霖,欧阳志云,等. 不同森林土壤微生物群落对Biolog-GN板碳源的利用[J]. 环境科学,2007,28(5):1126-1130.
[32] 鲁顺保,张艳杰,陈成榕,等. 基于BIOLOG指纹解析三种不同森林类型土壤细菌群落功能差异[J]. 土壤学报,2013,50(3):618-623.
Effects of continuous planting of phosphorus-efficient transgenic rice on soil microbial functional diversity
CHEN Jing-yi1,2, LIU Rui-hua1,2, WANG Li-li2, LI Jing2,3, LI Gang2, YANG Dian-lin2, ZHAO Jian-ning2,Corresponding Author
(1. College of Agronomy and Resource Enviroment, Tianjin Agricultural University, Tianjin 300384, China; 2. Key Laboratory of Original Agro-Environment Quality of Ministry of Agriculture and Rural Affairs,Tianjin 300191, China; 3. College of Resources and Environment, Northeast Agricultural University, Harbin 150030, China)
In order to evaluate the effects of phosphorus-efficient transgenic rice cultivation on soil microbial functional diversity, the plot experiment was conducted with phosphorus-efficient transgenic rice as a target, and with both phosphorus and non-phosphorus treatments , to analyze and compare the effects of phosphorus-efficient transgenic rice and non transgenic rice on soil microbial functional diversity at different growth stages based on the Biolog eco-plate method. The results showed that the average absorbance valueof soil microflora in OsPT4 and Nipponbare had the same change trend, which all increased with the prolongation of culture time, but the maximum value and rate of change ofin different growth stages were different. The results of soil microbial diversity index analysis showed that the phosphorus-efficient transgenic OsPT4 and Nipponbare Shannon's richness index and Simpson dominance index showed higher in P application than no P application during the whole growth period; Shannon index of OsPT4 with high P transgenic rice in the tillering and jointing stages, the differences were significant, and the heading and flowering stages were not significantly different from the maturation stage. The Simpson index showed no significant difference in the first three growth stages, but showed a significant difference in the mature stage. McIntosh's index of phosphorus efficient transgenic rice OsPT4 and Nipponbare was the highest in the tillering period, and the value was much higher than the other three growth periods; the McIntosh index of the phosphorus-efficient transgenic OsPT4 rice had no significant difference in the whole growth period. The use of different types of carbon sources to display phosphorus-efficient transgenic rice OsPT4 and Nipponbare are mainly by sugars, carboxylic acids, and amino acids. The principal component analysis showed that Nipponbare was clustered and the phosphorus-efficient transgenic rice OsPT4 was distributed, indicating that there was a difference in the metabolic use of the soil microbial community carbon sources. In summary, compared with the non-transgenic rice, the phosphorus-efficient rice OsPT4 will affect the soil microbial community richness index, dominance index, and the distribution of carbon source principal components due to different phosphorus application conditions and different growth periods.
rice; phosphorus-efficient; transgenic; soil microbial; Biolog eco-plate method
S511;S154.3
A
1008-5394(2019)02-0001-07
10.19640/j.cnki.jtau.2019.02.001
2018-08-24
国家科技重大专项(2016ZX08012005-005)
陈静怡(1990-),女,硕士在读,研究方向为转基因作物环境安全评价研究。E-mail:chenjy3923@163.com。
赵建宁(1981-),男,副研究员,博士,研究方向为转基因作物环境安全评价。E-mail:zhaojn2008@163.com。
责任编辑:宗淑萍
