北京和非北京基因型结核分枝杆菌生长曲线及mazEF系统的研究
2019-07-16
据世界卫生组织全球结核病报告显示2017年全球有1 040万人患结核病,中国肺结核发病数为835 198例,死亡人数为2 823人[1]。伴随着HIV感染的流行、耐药菌株的出现及流动人口的增加,全球结核病形势急剧恶化。全球约20亿人曾受到结核分枝杆菌的感染[2]。结核分枝杆菌(Mycobacteriumtuberculosis, MTB)的流行存在地区差异,据WHO调查报告,印度、中国、印度尼西亚、菲律宾和巴基斯坦等5个国家的结核病新发病例占56%[3],在中国,北方北京基因型菌株所占的比例高于南方,新疆是中国结核病发病较高的地区之一,新疆的主要流行MTB是北京基因型菌株[4-5]。MTB引起的结核病(Tuberculosis, TB)是全球最常见的慢性传染性疾病之一,MTB在传播和进化过程中形成了7个感染人类的谱系,其中北京基因型菌株是全球广泛传播的谱系之一[6]。北京基因型菌株比其他MTB基因型菌株毒性强、突变率高,有耐药倾向,易传播,易复发[7],在动物中表现出高致病性和高死亡率[8]。TAS广泛存在于非严格胞内寄生的细菌中[9]。MTB染色体上存在大量的毒素-抗毒素分子,研究显示毒素抗毒素分子与大肠杆菌潜伏感染、持续感染、休眠耐药、生物膜的形成和对抗环境压力密切相关[10]。mazEF系统是分布最广泛的II型TAS,mazF是毒素,化学性质是核糖核酸内切酶,切割mRNA具有序列特异性,推测MTB的mazF像大肠杆菌的一样,参与细菌的持留、程序性死亡以及对抗生素药物的耐受[11]。mazE是抗毒素,化学性质不稳定,mazE通过与mazF形成复合物抑制mazF的核糖核酸内切酶活性,从而保护胞内mRNA,使蛋白得以正常合成,使mazF失去对细胞生长的抑制和程序性死亡的作用[12]。
本文旨在研究新疆北京及非北京基因型菌株的生长曲线、mazEF3,6,9系统表达的差异性,探索mazEF系统是否与北京基因型菌株流行相关,为进一步研究结核病的传播、致病机制及其防治措施提供参考依据。
1 材料与方法
1.1菌株及鉴定 MTB临床分离株为本课题组成员前期从新疆开放性肺结核患者的痰液中分离培养所得,已完成菌株鉴定及北京基因型和非北京基因型鉴定,采集地点、菌株数、培养、鉴定的方法详见参考文献[13],菌株保存在石河子大学教育部重点实验室细菌室。北京、非北京基因型MTB的mazEF3、mazEF6、mazEF9基因的缺失和过表达菌株前期已完成构建及鉴定[14],由本实验室保存。所有菌株的培养和鉴定均遵循中国防痨协会结核病诊断细菌学检验规程[15]。
1.2不同培养条件下北京、非北京基因型菌株的生长曲线测绘 将菌株接种在含有甘油和吐温80的7H9肉汤(BD Biosciences, San Jose, CA, USA)中,对置于37 ℃恒温摇床培养箱中的北京、非北京基因型菌株以及二者的mazEF3、mazEF6、mazEF9基因的缺失突变和过表达菌株在无菌培养的第2、4、6、8、10 d,用细菌浊度仪检测细菌的光密度(OD600)值,并以细菌的OD值为纵坐标,以培养时间为横坐标,绘制各实验菌株在标准、低氧、营养饥饿培养条件下的生长曲线。细菌的OD值即细菌的光密度值,主要由细菌的菌数多少决定其OD值的高低,OD值越高,表明菌数越多,菌数多表明其生长繁殖快。在上述3种条件下培养,北京、非北京基因型菌株,起始的OD值(菌数)是一致的。标准条件的培养液为配制的7H9液体,试管用通气的塞子硅胶塞塞住;低氧条件的培养液也为配制好的7H9液体,但是用不通气的橡胶塞;营养饥饿条件用PBS代替7H9培养液,先把菌液用PBS洗3遍,每次洗完离心,离心后重悬。
1.3北京和非北京基因型MTBmazEF系统mRNA水平的检测 取对数生长期的MTB菌落,使用RNeasy Plus Universal mini kit RNA(德国QIAGEN公司)提取试剂盒提取总RNA。紫外分光光度法用于测定RNA浓度和纯度,使用TianScript cDNA(Tiangen)合成试剂盒进行第一链cDNA合成。将得到的cDNA用紫外分光光度计检测RNA浓度及纯度后,置cDNA溶液于-80 ℃冰箱贮存。通过GeneBank查找mazE3 6 9、mazF3 6 9及mazEF3 6 9的基因序列,qRT-PCR特异性引物通过Primer 5.0软件设计,结果见表1。引物合成由上海生物工程有限公司完成。
qRT-PCR反应条件:50 ℃ 2 min激活SYBR酶活性,95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸1 min,共40个循环。溶解曲线参数:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 15 s。
对所有样本的每个基因均做3个复孔,取其平均值,获得各样本的Ct值。以sigA的拷贝数作为校正基数,△Ct=[Ct(sample)]-[Ct(sigA)],2-△ct即为该样本目的基因相对于内参的表达量。△△Ct=[△Ct(test)]-[△Ct(control)],2-△△ct为实验组相对于对照组目的基因的相对表达量。
表1mazEF基因的qRT-PCR引物序列
Tab.1 Sequences ofmazEFgene primers for qRT-PCR
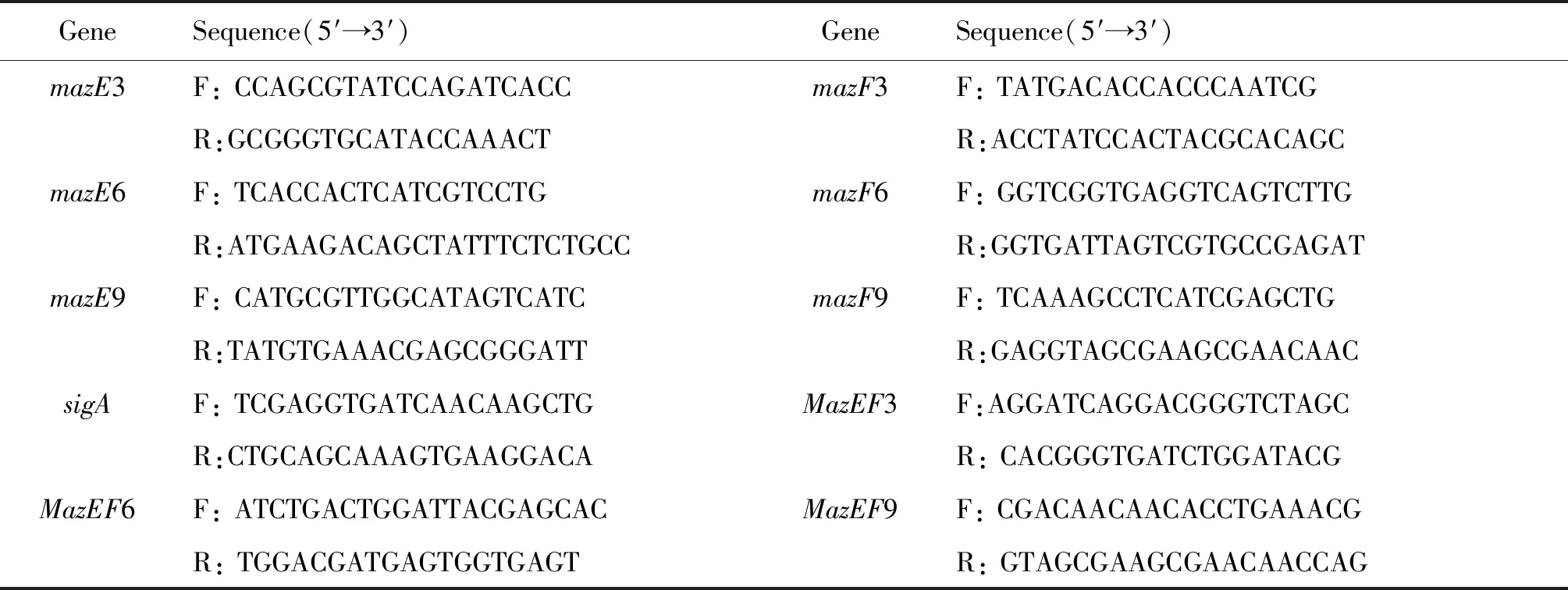
GeneSequence(5′→3′)GeneSequence(5′→3′)mazE3F: CCAGCGTATCCAGATCACCmazF3F: TATGACACCACCCAATCGR:GCGGGTGCATACCAAACTR:ACCTATCCACTACGCACAGCmazE6F: TCACCACTCATCGTCCTGmazF6F: GGTCGGTGAGGTCAGTCTTGR:ATGAAGACAGCTATTTCTCTGCCR:GGTGATTAGTCGTGCCGAGATmazE9F: CATGCGTTGGCATAGTCATCmazF9F: TCAAAGCCTCATCGAGCTGR:TATGTGAAACGAGCGGGATTR:GAGGTAGCGAAGCGAACAACsigAF: TCGAGGTGATCAACAAGCTGMazEF3F:AGGATCAGGACGGGTCTAGCR:CTGCAGCAAAGTGAAGGACAR: CACGGGTGATCTGGATACGMazEF6F: ATCTGACTGGATTACGAGCACMazEF9F: CGACAACAACACCTGAAACGR: TGGACGATGAGTGGTGAGTR: GTAGCGAAGCGAACAACCAG
1.4北京和非北京基因型菌株mazEF系统蛋白表达水平的检测 将保存在-80 ℃冰箱中的处于对数生长期的菌悬液,置于冰上融解15 min。向EP管中加入Native Lysis Buffer(已加入溶菌酶和核酸酶)2 mL,待菌悬液完全融解后,离心去除培养液,将MTB重悬浮于Native Lysis Buffer中。将EP管置于冰上孵育30 min,轻轻涡旋混匀细菌悬浮物2~3次。将溶菌产物置于4 ℃离心机中离心,取上清。用紫外分光光度计检测蛋白的纯度及含量。加入5×SDS-PAGE蛋白上样缓冲液,将蛋白样本置于100 ℃加热器上进行变性处理、分装,置于-80 ℃储存。使用Western blot技术检测其蛋白表达水平。MazF蛋白单克隆抗体的合成由北京博尔迈公司完成,其中MazF3和MazF6单抗不能合成,因其制备过程中过表达质粒导入工程菌时,导致工程菌大量死亡,不能获得足量蛋白(抗原)用于制备单抗,推测MazF3和MazF6蛋白的毒性远远高于MazF9蛋白。因此本实验只检测各实验菌株MazF9的表达水平。查阅文献抗毒素MazE蛋白不稳定、易降解,只有与毒素MazF结合后才稳定,又咨询了博尔迈公司技术部门的相关人员,认为制备MazE单克隆抗体的风险太大,所以最终放弃制备MazE单克隆抗体。运用Image Lab和Photoshop软件对所检测的目标图像进行分析,计算目的蛋白灰度值与其面积的乘积,以及内参蛋白灰度值与其面积的乘积,两者之比即为目的基因相对内参基因的蛋白表达量。
1.5统计分析 实验结果采用SPSS 20.0软件进行统计分析,采用t检验进行统计学差异分析。P<0.05为差异有统计学意义。
2 结 果
2.1不同培养条件下北京、非北京基因型菌株的培养结果 通过检测不同培养条件下北京和非北京基因型MTB在第2、4、6、8、10 d的细菌光密度OD值,绘制各菌株在不同培养环境中的生长曲线。结果显示,与非北京基因型菌株相比,北京基因型菌株在标准和低氧条件下培养的第4、6、8、10 d,营养饥饿条件下培养的第2、4、6、8 d,细菌的OD值均较高,且差异有统计学意义(P<0.05)(图1)。说明北京基因型菌株菌数均高于非北京基因型菌株的。观察北京基因型菌株和非北京基因型菌株的mazEF3、mazEF6、mazEF9基因的缺失和过表达菌株在标准、低氧和营养饥饿条件下培养绘制的生长曲线,总体趋势北京和非北京基因型MTB缺失突变株和过表达菌株的OD600小于其对应的亲本株,说明亲本株菌株菌数多、繁殖力强,见图2。
2.2北京和非北京基因型MTBmazEF系统mRNA水平的检测结果mazEF基因mRNA相对表达量:以细菌的cDNA为模板,用表1中mazEF3 6 9的引物,进行实时荧光定量PCR检测其mRNA表达水平。北京基因型菌株与非北京基因型菌株mRNA表达水平相比较,mazEF3 mRNA高表达9.55倍(t=1.780,P<0.05),虽然mazEF6 9高表达,但无统计学意义(tmazEF6=0.798,P>0.05)(图3a);mazE9低表达5.16倍(t=1.937,P<0.05),mazE3低表达和mazE6高表达,但无统计学意义(tmazE3=1.012,tmazE6=1.534,tmazEF9=0.762,P>0.05)(图3b);mazF3高表达4.86倍,mazF6高表达2.64倍,mazF9高表达5.37倍(tmazF3=2.815,tmazF6=3.000,tmazF9=3.633,均P<0.01)(图3c)。
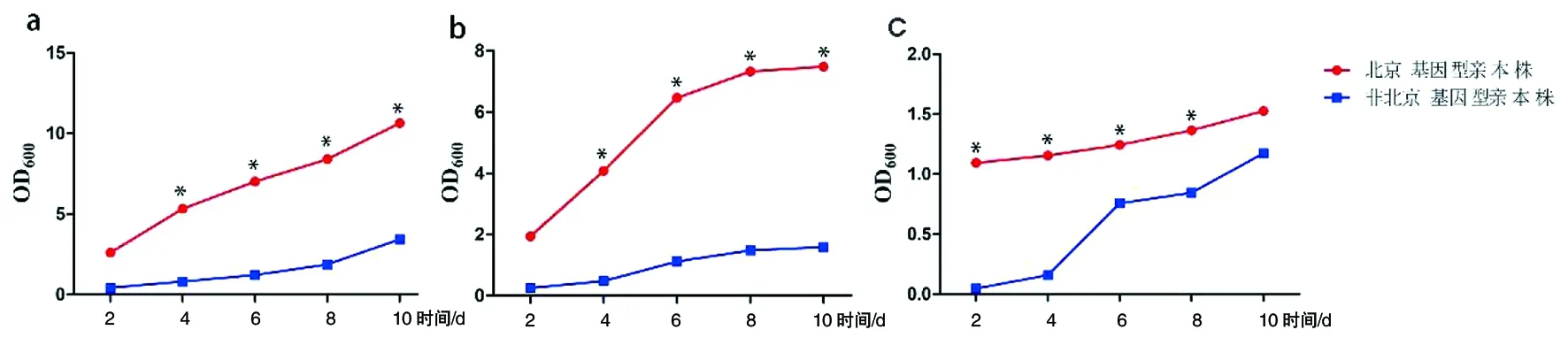
注:北京和非北京基因型菌株在标准条件(a)低氧条件(b)和营养饥饿条件(c)标准条件下:4 d的t=1.680;6 d的t=1.880;8 d的t=2.224;10 d的t=1.754;氧气缺乏条件下:4 d的t=0.383;6 d的t=1.741;8 d的t=1.779;10 d的t=1.224;营养饥饿条件下:2 d的t=2.116;4 d的t=2.537;6 d的t=1.102;8 d的t=0.667下的培养结果;*P<0.05图1 不同培养条件下北京和非北京基因型菌株的生长曲线Fig.1 Growth curves of Beijing and non-Beijing genotype strains under different culture conditions
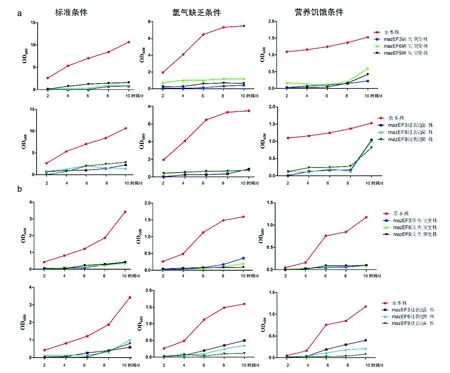
注:a. 北京基因型菌株及其缺失和过表达菌株在不同培养条件下的生长曲线;b. 非北京基因型菌株及其缺失和过表达菌株在不同培养条件下的生长曲线。图2 结核分枝杆菌及其mazEF3,6,9基因缺失和过表达菌株的生长曲线Fig.2 Growth curves of MTB strains as well as their mazEF 3,6,9 genes deletion and overexpression strains
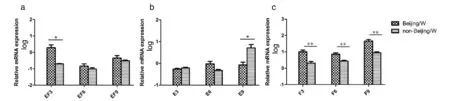
注: * P<0.05;** P<0.01; a. 北京和非北京基因型菌株mazEF系统基因mRNA的表达水平;b. 北京和非北京基因型菌株mazE基因mRNA的表达水平;c. 北京和非北京基因型菌株mazF基因mRNA的表达水平。图3 结核分枝杆菌mazEF系统在mRNA水平上的表达结果Fig.3 Expression results of mazEF systems in MTB strains at mRNA levels
2.3北京和非北京基因型MazF9蛋白水平的检测结果 提取MTB的蛋白,以GAPDH作为内参蛋白,使用Western Blot技术检测其蛋白表达水平。北京基因型与非北京基因型菌株相比,其MazF9蛋白高表达1.62倍,差异有统计学意义(t=9.009,P<0.01)(图4)。
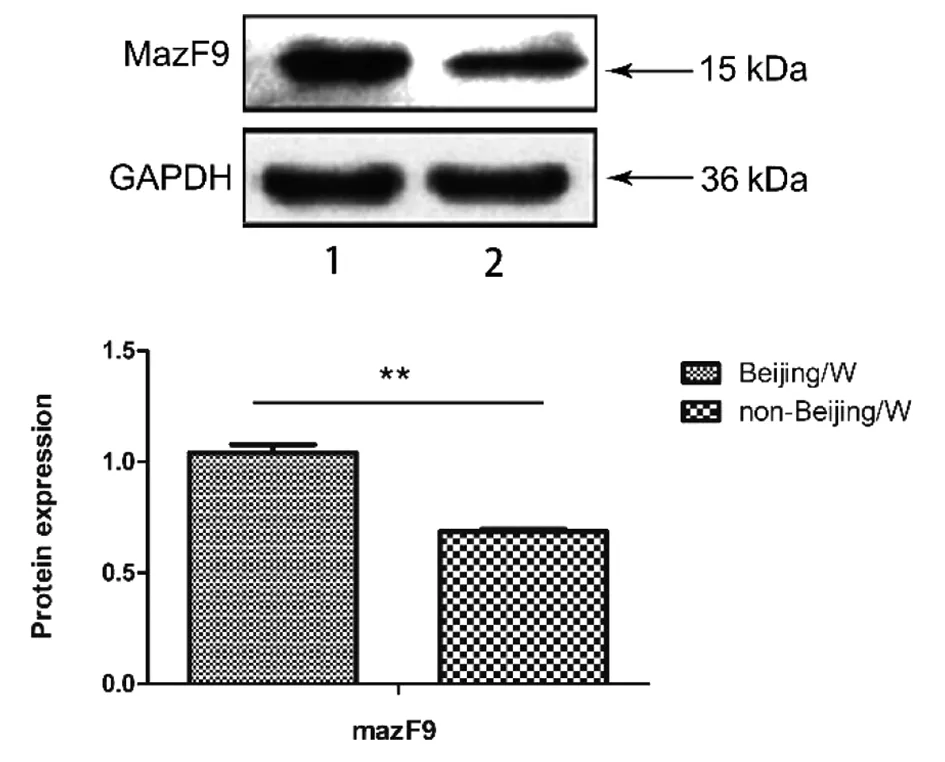
注:1是北京基因型菌株;2是非北京基因型菌株;** P<0.01。图4 mazF9蛋白在北京和非北京基因型菌株中的表达Fig.4 Expression levels of MazF9 protein in Beijing and non-Beijing genotype strains
3 讨 论
1995年,Van Soolingen[16]等人在中国北京及周边地区首次发现并报道MTB北京基因型菌株,将其命名北京型菌株。全球MTB临床分离株的13%是北京基因型菌株,并导致了全世界1/3的TB[17]。与非北京基因型菌株相比,北京基因型菌株具有一定的选择优势,传播速度更快,毒力更强,往往更加致命[18]。究竟什么原因赋予北京基因型菌株的这些特点还不完全清楚,被认为是相关特定分子的内在表达变化所决定。研究结果显示,北京和非北京基因型菌株其生长曲线总体趋势都是标准条件下的OD值高于低氧及营养饥饿条件,正常标准培养条件下,由于氧气、营养充足、充分,适合MTB生长繁殖,OD值高;低氧条件下OD值低,MTB生长轻度受限,这种不利条件也是促进MTB持留生存的因素之一;营养饥饿条件下OD值最低,说明MTB生长速度最慢,繁殖速度降低以利于存活,也许这与MTB入侵人体被巨噬细胞吞噬后不被清除变为休眠菌机制相一致。与非北京基因型菌株相比,北京基因型菌株在低氧、营养饥饿的条件下OD值均高,即在不利条件下,北京基因型菌株生长繁殖速度快于非北京基因型菌株,说明其对低氧、营养饥饿不利条件耐受性较好,在压力条件下生存能力强,这也许是北京基因型菌株易流行的原因之一。是MTB什么内在的因素造成了这种不同,作者初步探索了MTB菌株的毒素-抗毒素mazEF系统与其生长繁殖的相关性。
毒素-抗毒素(TAS)由毒素蛋白和同源的抗毒素组成,mazEFTAS能够促进程序性细胞死亡,抑制细菌生长,诱导持留菌的形成,造成潜伏感染及提高细菌对环境压力的耐受性。TAS的作用机制取决于病原菌在不同生活时期的生物学特性,当受到不良环境或刺激后,打破了毒素抗毒素之间的平衡,抵抗力强的毒素被激活,作用于胞内靶分子,引起抑菌或杀菌效应[19]。Sat等[20]对大肠杆菌进行mazEF基因敲除,通过比较其普通菌株和敲除株对不利环境如药物的反应,发现药物可以干扰或消耗不稳定的抗毒素,而使稳定的毒素MazF堆积,导致细菌的程序性死亡,因此推测mazEF可能是其程序性死亡进程中的关键因素。本研究通过敲除和过表达北京和非北京基因型菌株mazEF3、mazEF6和mazEF9基因后,观察各菌株在不同环境下的生长曲线,结果显示无论是北京还是非北京基因型菌株,其缺失突变株和过表达菌株的OD值均低于亲本株,提示mazEF3,6,9与MTB生长繁殖相关。缺失后,mazEF3,6,9不能发挥其应有的调节细菌生长繁殖作用,尤其是在不利的环境条件下,导致MTB菌数下降。过表达mazEF3、mazEF6和mazEF9基因,MTB菌数也降低,推测虽然抗毒素可以中和毒素,但是抗毒素不稳定,易降解,导致毒素增多、引起菌体死亡,或者是由于菌体内其他调节因素也参与了对其过表达调节作用的结果。究竟是何种原因导致的这种现象,需要进一步探讨。该结果也提示作者应进一步研究:在上述培养条件下,分别检测mazE3、mazE6、mazE9、mazF3、mazF6和mazF9对北京和非北京基因型菌株生长繁殖的影响。在mazEF系统mRNA表达水平上,北京基因型与非北京基因型菌株相比,mazEF3高表达;mazF3、mazF6、mazF9均高表达;mazE9低表达,差异均具有统计学意义(P<0.05)。有研究表明,分枝杆菌中Rv1103c-1102c(mazEF3)、Rv1991a-1991c(mazEF6)和Rv2801a-2801c(mazEF9)属于经典的TAS,其中mazEF6、mazEF9在营养匮乏环境中启动子增强最显著[21]。本研究结果显示北京基因型比非北京基因型菌株的mazEF3基因转录水平高,两者同为临床致病菌,或许mazEF3高表达赋予了北京基因型菌株抗压力强的特点,在入侵宿主时可以抵抗机体的不利环境而生存,这也许是造成其易流行、持留生存及出现耐药菌性的原因之一。当MTB处于不利环境时或入侵宿主遭遇免疫系统攻击时,接受细胞外死亡因子的刺激,细菌的TAS被激活,其中毒素性质稳定,而抗毒素性质不稳定易被蛋白水解酶水解,造成毒素累积,而北京基因型菌株毒素基因均高表达,可产生更多的毒素,可以选择性的使一些细菌死亡,从而为剩余的细菌保留能量和营养物质,此为利他性死亡,以保证群体稳态和适应不利环境[22]。作为新疆主要流行株北京基因型菌株mazE9低表达,推测为是内在特定分子表达调节的结果,尤其是mazE9低表达和mazF9高表达的协同作用,能使更多的毒素累积进行利他性程序性死亡,从而提高自身对不良环境的耐受性,也许这也是成为流行株的原因之一。
Nariya[23]等人证实大量诱导表达MazF可使细胞处于停滞状态,随后大剂量诱导表达MazE可中和MazF的毒性,使细胞恢复活性。这一停滞状体与结核分枝杆菌的休眠状态很相似。当游离的MazF在细胞内时间或累计量超过某一界点时,就会导致细胞的死亡。我们推测毒素蛋白累积量不同可以使细胞表现出不同的状态,当少量累计时提高细胞对不利生存环境的耐受,当环境进一步恶化,毒素持续累积,促使细胞进入休眠状态,当毒素作用时间或者累积量达到某一值时细胞死亡。实验中使用Western Blot技术检测蛋白质水平的表达时,结果显示,北京基因型菌株相对于非北京基因型菌株,MazF9蛋白高表达,与mazF9基因mRNA表达趋势一致。在转录和翻译水平上,mazF9的高表达也许是北京基因型菌株成为流行株、广泛传播的原因之一。
综上所述,作者初步探索了北京及非北京基因型结核分枝杆菌的生长曲线、mazEF3,6,9系统表达有无差异以及mazEF系统是否与北京基因型菌株流行相关。研究结果表明,北京与非北京基因型结核分枝杆菌的生长曲线、mazEF3,6,9系统表达存在差异,mazEF系统与北京基因型菌株流行相关。MTB的染色体上存在着大量的TAS系统,mazEF3,6,9系统只是其中之一,mazEF3,6,9系统在MTB中究竟如何发挥作用以及与其他TAS系统、调节因素的互作用需要进一步研究。
