结核分枝杆菌KatG-ACT271CCT(Thr271Pro)突变与异烟肼耐药关系的研究
2019-07-16杨寿慧1刘惟优吴龙火3袁小亮
杨寿慧1,刘惟优,吴龙火3,袁小亮
结核病(Tuberculosis,TB)长期以来威胁着人类的健康,世界卫生组估计2015年全世界约有1 040万新发结核病例,且约有48万新发耐多药结核(multidrug-resistant,MDR)病例,我国新发肺结核人数仅次于印度和印度尼西亚而位居全球第3位[1]。异烟肼(isoniazid,INH)是结核病治疗的首选化学药物。然而,随着INH广泛用于临床,其耐药情况不容忽视,据2010年全国第5次结核病流行病学抽样调查报告[2],我国结核病患者对INH的耐药率最高(28.6%)。这一严峻的形势迫使人们寻求更加快速、准确的INH耐药结核检测方法,以便更有效的控制结核病。
目前认为,katG基因(编码过氧化氢-过氧化物酶)是最重要的INH耐药基因,其突变存在于50%~70%的耐INH结核菌株中[3]。故katG基因突变检测已成为早期判断耐INH结核菌的重要手段。而katGAGC315ACC(Ser315Thr)突变是katG基因最常见的突变类型[4]。课题组前期研究发现来自江西地区的一临床分离结核菌株对INH表现高度耐药,经测序发现此菌株在katG基因含有唯一突变点ACT271CCT(GenBank登录号:JN049496),但该突变点与INH耐药关系尚无相关研究报道[5]。本研究采用katG蛋白酶活性检测及分子对接方法分析该突变点与INH耐药的关系,以期通过检测发现该位点基因突变与结核菌株表型耐药关系。
1 材料与方法
1.1菌株和质粒 结核分枝杆菌katG(ACT271CCT)、katG野生型、katG(AGC315ACC)基因片段由上海生工生物工程合成,BL21(DE3)pLySs赣南医学院基础医学院科研中心保存。质粒pET-22b(+)购自武汉淼灵生物科技有限公司。
1.2主要试剂 酵母粉、胰蛋白胨购自英国OXOID公司,HisTrap FF-crude购自GE公司,氨苄青霉素、Anti-His antibody、辣根过氧化物酶标记山羊抗鼠IgG、过氧化氢酶(catalase, CAT)检测试剂盒及过氧化物酶试剂盒(peroxidase, POD)购自索莱宝科技有限公司。PageRulerTMPrestained Protein ladder购自Thermo Fisher公司。
1.3 结核分枝杆菌katG表达及提纯
1.3.1原核表达载体的构建 katG野生型、katG(ACT271CCT)、katG(AGC315ACC)基因片段和载体pET-22b(+)分别用EcoRⅠ和HindⅢ进行双酶切。酶切产物经DNA连接酶与载体pET-22b(+)连接。
1.3.2katG重组蛋白诱导表达条件摸索 将各重组质粒及pET-22b(+)转化入BL21(DE3)pLySs感受态,接种于含100 μg/mL氨苄青霉素的SOB平板,经37 ℃过夜培养。无菌条件下挑取转化阳性单克隆菌接种于SOB培养液中,待A600值约为0.6 时,按1∶100转接至新的SOB培养液中。取野生型培养重组质粒菌液培养3~5 h后,摸索不同IPTG浓度、温度、时间、培养液浓度下蛋白诱导表达最佳条件。
1.3.3katG重组蛋白原核表达及Western blot鉴定 按蛋白诱导表达最佳条件,分别诱导katG野生型、katG(ACT271CCT)、katG(AGC315ACC)重组质粒菌,次日蛋白表达充分后,分别取等量菌液离心,用电泳液重悬菌体,行SDS-PAGE电泳及Western blot鉴定。Western blot一抗为Anti-His antibody,二抗为辣根过氧化物酶标记山羊抗鼠IgG,采用辣根过氧化物酶法(HRP)显色。
1.3.4katG重组蛋白分离、纯化 分别重新从SOB平板上挑取各自单克隆菌,接种于10 mL SOB培养液中,过夜培养后,转接至新的500 mL SOB培养液中,过夜诱导蛋白表达。收集菌体,用20 mL 20 mmol/L PBS+10 mmol/L咪唑平衡缓冲液重悬。菌液加入溶菌酶(工作浓度0.2~0.4 mg/mL),超声破碎仪破菌,10 000 r/min 4 ℃ 20~30 min分离上清和沉淀,分别取上清和沉淀进行SDS-PAGE电泳,分析超声破碎后katG重组蛋白分布情况。
将HisTrap FF-crude柱用20 mmol/LBS冲洗酒精后,用20 mmol/L PBS+10 mmol/L咪唑平衡缓冲液平衡5个柱长体积,将超破后上清以1 mL/min通过柱子,过柱2遍,使目的蛋白与柱子充分结合,收集流出液,分别用含20、40、100、250 mmol/L咪唑缓冲液依次洗脱His标签纯化树脂,收集各组洗脱液进行SDS-PAGE电泳,分析katG重组蛋白纯化情况。将重组蛋白液加入透析袋中,置于透析液中4 ℃过夜透析。
1.3.5katG重组蛋白定量及活性测定 用BCA蛋白定量法检测katG重组纯化蛋白浓度。按过氧化氢酶试剂盒说明书比例混合好工作液,在1 000 μL过氧化氢酶反应体系中加入100 μL重组蛋白,紫外分光光度计240 nm测定初使吸光值A1和1 min后的吸光值A2。ΔA=A1-A2,计算katG重组蛋白过氧化氢酶活性(U/mg prot)=678×ΔA÷蛋白浓度。按过氧化物酶试剂盒说明书比例混合好工作液,在1 000 μL过氧化物酶反应体系中加入100 μL重组蛋白,分光光度剂470 nm检测加入重组蛋白30 s 时的吸光值 A1和 90s 时吸光值 A2, ΔA=A2-A1,计算katG重组蛋白过氧化物酶活性(U/mg prot)=7 133×ΔA÷蛋白浓度。
1.4分子对接 野生型结核分枝杆菌katG蛋白的晶体结构从蛋白晶体结构数据库 (http://www.rcsb.org)获得(PDB ID:1SJ2),使用Autodock Tools对受体蛋白质结构进行处理,保留其氧化反应中心含铁的卟啉环,删除底物小分子,加极性氢,加原子电荷。其他突变体均在野生型的基础上通过YASARA软件进行突变然后使用最陡下降法优化1 000次选择自由能最小的构象建立katG蛋白三维模型。
异烟肼的三维结构从PubChem compound数据库(ID:3767)获取,将上述的小分子结构使用分子力场方法优化,并加上Gaisteiger电荷,作为对接配体存为pdbqt文件。然后对小分子和受体进行分子对接,所有对接均使用Autodock 4.2软件包完成,利用拉马克遗传算法(Lamarckian Genetic Algorithm)确定katG 蛋白和异烟肼最佳结合构象,对接结果保留10个能量最低的构象并进行簇(cluster)分析。参考氧化活性中心卟啉环的位置,对接的 BOX位于卟啉上方的空腔内,中心坐标为45.47,-3.905, 28.640,大小为 40埃×40埃×40埃,其余采用软件的默认值。
2 结 果
2.1 katG蛋白表达、纯化及酶活性检测
2.1.1katG蛋白表达条件摸索 结核分枝杆菌katG野生型重组基因转化至BL21(DE3)pLySs,摸索不同温度、不同浓度IPTG、不同浓度培养基,IPTG诱导katG蛋白表达最佳条件。可以看出IPTG 0.5 mmol/L、20 ℃、12 h在2×SOB培养基条件下诱导出目的蛋白浓度最佳(图1、2)。
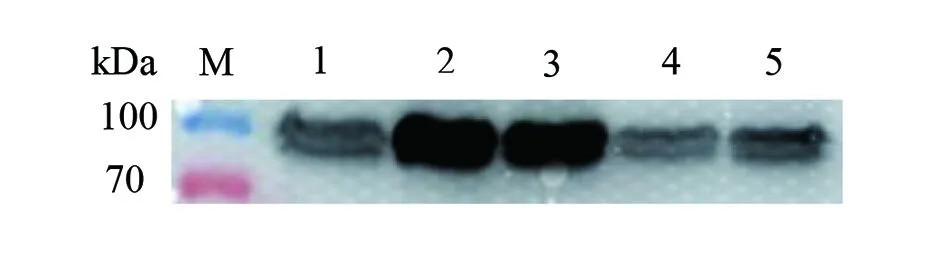
M:蛋白分子质量标准;1:未加IPTG、28 ℃、12 h;2:IPTG 0.5 mmol/L、20 ℃、12 h;3:IPTG 0.5 mmol/L、25 ℃、12 h;4:IPTG 0.5 mmol/L、28 ℃、12 h;5:IPTG 1 mmol/L、28 ℃、12 h。图1 IPTG浓度、时间、温度的摸索Fig.1 Exploration of IPTG concentration,induction time and temperature
M:蛋白分子质量标准;1:未转质粒大肠杆菌;2:转质粒菌体诱导于1×SOB培养基;3:转质粒菌体诱导于1.5×SOB培养基;4:转质粒菌体诱导于2×SOB培养基。图2 培养基浓度的摸索Fig.2 Exploration of medium concentration
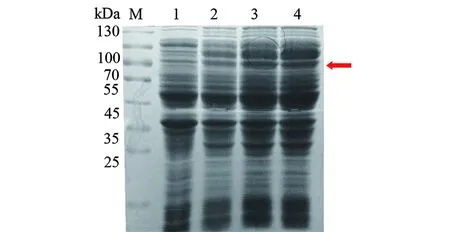
2.1.2katG重组蛋白原核表达及Western blot鉴定 结核分枝杆菌katG野生型、katG(ACT271CCT)、katG(AGC315ACC)重组基因转化至BL21(DE3)pLySs,IPTG诱导重组基因蛋白表达,重组蛋白分子量约为85 kd,SDS-PAGE检测诱导前后蛋白表达情况(图3)。Western blot显示含有6×His标签的重组蛋白能被Anti-His antibody识别(图4)。
2.1.3超声破碎重组蛋白大肠杆菌 重组基因菌体超声破碎后katG蛋白分布情况可见katG蛋白分布于上清中(图5)。
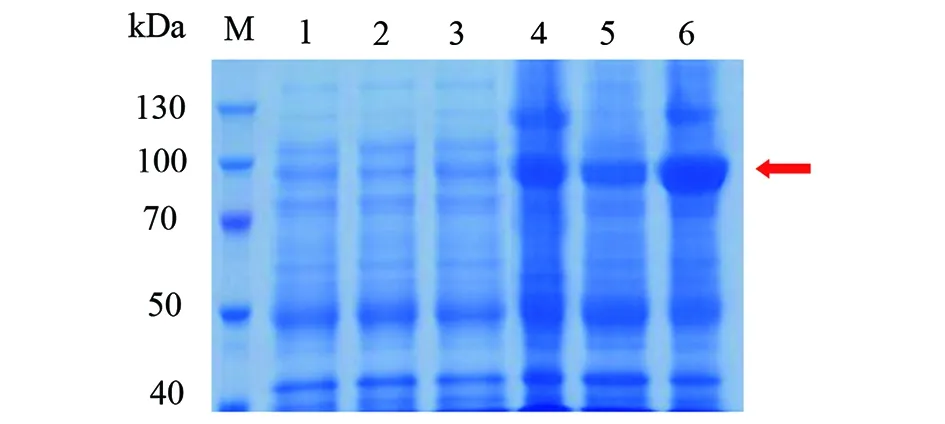
2.1.4katG重组蛋白的纯化 重组菌超声破碎上清液过HisTrap FF-crude柱,不同浓度咪唑洗脱缓冲液洗脱后检测,其中100 mmol/L咪唑洗脱缓冲液得到纯化katG重组蛋白(图6)。
2.1.5katG重组蛋白酶活性测定 测得katG(ACT271CCT)、katG野生型、katG(AGC315ACC)重组蛋白过氧化氢酶和过氧化物酶活性,见表1和图7。
M:蛋白分子质量标准;1:katG蛋白野生型未诱导;2:katG蛋白271突变未诱导;3:katG蛋白315突变未诱导;4:katG蛋白野生型诱导后;5:katG蛋白271突变诱导后;6:katG蛋白315突变诱导后。图3 重组表达宿主菌诱导前后重组蛋白katG的表达Fig.3 Recombinant protein katG expression before and after induction
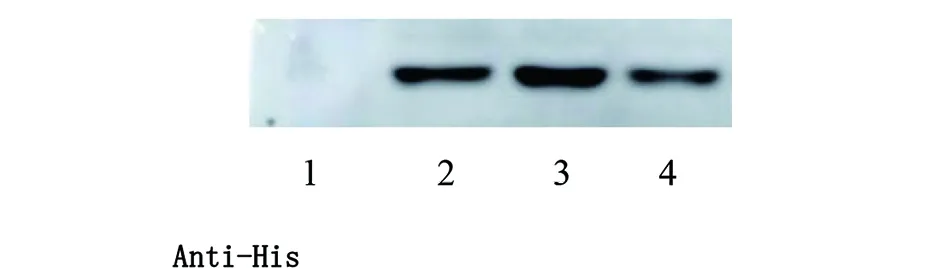
1:空载体;2:katG野生型蛋白;3:katG271突变型;4:katG315突变型。图4 katG重组蛋白Western blot鉴定Fig.4 Identification of recombinant protein katG by Western blot
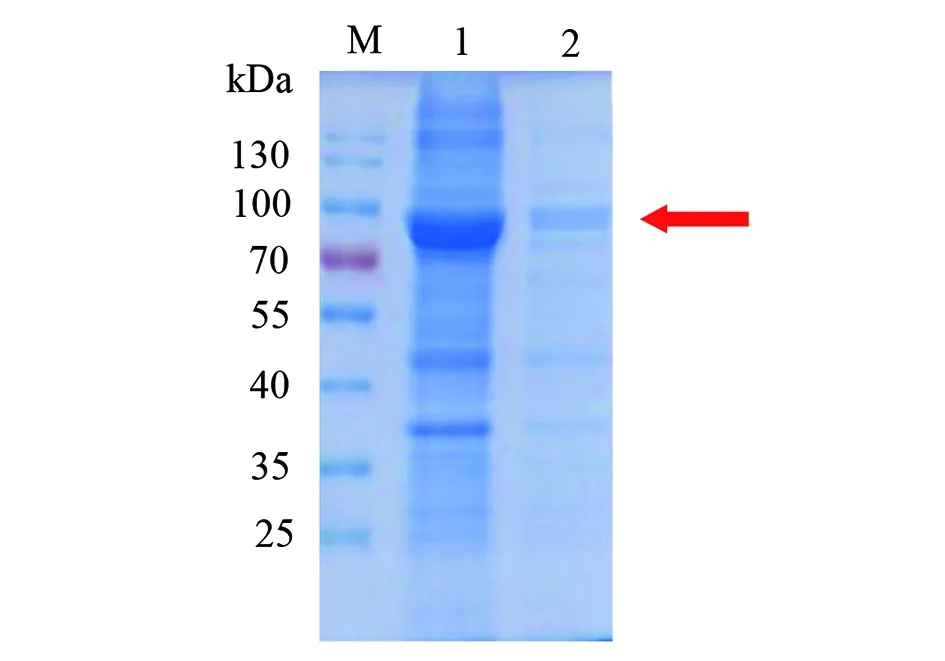
M: 蛋白分子质量标准;1:超声破碎后上清;2:超声破碎后沉淀。图5 菌体超声破碎后katG蛋白分布Fig.5 Distribution of katG protein after ultrasoniction
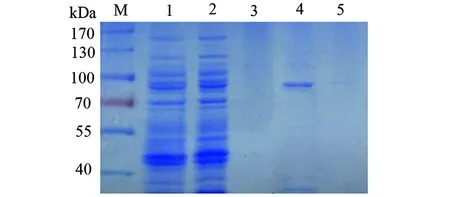
图6 镍亲和层析纯化的野生型katG蛋白SDS-PAGE电泳图Fig.6 SDS-PAGE profile of wild-type katG purified by affinity chromatography
表1 katG重组蛋白的过氧化氢酶和过氧化物酶活性
Tab.1 Catalase and peroxidase activities of recombinant protein katGs

katG重组蛋白类型 过氧化氢酶比活(U /mg)过氧化物酶比活(U /mg)野生型361.577.6katG271突变型158.8(↓56%)28.7(↓63%)katG315突变型92.6(↓74%)19.7(↓75%)
注:1U过氧化氢酶为25 ℃、pH=7.0条件下,1 min内催化1 μmoL H2O2反应所需的酶量;1U过氧化物酶为25 ℃、pH7.0条件下,1 min内催化1 μmol邻联大茴香胺反应所需的酶量。
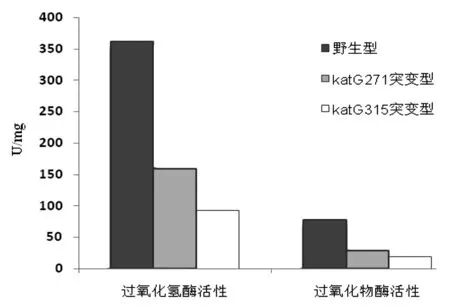
图7 纯化的katG蛋白过氧化氢酶和过氧化物酶活性比较Fig.7 Comparison of catalase and peroxidase activities of the purified protein katGs
2.2 分子对接
2.2.1异烟肼与katG蛋白活性空腔对接 图8、9可以看出氧化反应的活性区域是蛋白质内部一个以卟啉为平面的狭长疏水区域,内部向外有一个狭小的通道口,约为10埃×10埃大小,仅允许体积较小的分子进入。图中可以看出,异烟肼进入活性区域后,亲水酰胺基团与ASP137残基形成氢键,阻碍其它小分子进入。异烟肼的六元环为疏水基团,与卟啉环平行,两者之间有疏水作用。分子对接发现,异烟肼均能进入野生型及其他突变体蛋白质的活性空腔,结合的位置相似。
2.2.2异烟肼与野生型katG蛋白对接 对接结果分析得,异烟肼与野生型katG蛋白结合的能量为-6.60 kcal/mol,可见反应是自发进行的。图8可以看到,异烟肼与katG蛋白结合的位置位于氧化反应的活性中心,即卟啉环上方,酰胺氧分别与HIS108和TRP107氨基酸残基分别形成2.3、2.2埃的氢键,结合在卟啉环上方。酰胺的氧位于Fe原子斜上方,距离为2.8埃。

图8 katG野生型与异烟肼结合示意图Fig.8 Schematic diagram of the binding of katG wild type with isoniazid
簇分析发现,对接能量最低的10个构象都同属唯一的簇,能量一致。可以看出,卟啉环上方的活性空腔既疏水又比较狭小,异烟肼含有亲水的酰胺基团,无法进入口袋深部,只能结合在开口处,在其进入氧化活性空腔内后,占据了关键位置,阻碍其它分子的进入。
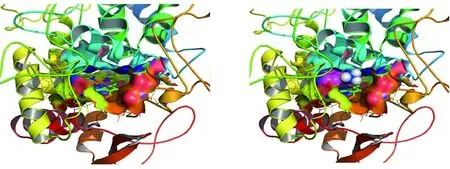
图9 蛋白质氧化活性空腔示意图Fig.9 Schematic diagram of the reactive cavity of protein oxidation
2.2.3异烟肼与Thr271Pro突变体katG蛋白对接 Thr271Pro突变体katG蛋白与异烟肼分子对接的结合自由能为-6.46 kcal/mol,较野生型升高,提示Thr271Pro突变体KatG蛋白与异烟肼结合的亲和性降低。从图10可以看出,酰胺的氧与Fe原子距离拉开到3.1埃,酰胺上的氢与ASP137上的氧形成了1.9埃氢键,而野生型蛋白与异烟肼没有形成类似的氢键。此外,通过图11发现ASP137残基的羧基发生了一定角度的旋转。

图10 Thr271Pro突变体katG蛋白与异烟肼作用示意图Fig.10 Schematic diagram of the interaction of katG(Thr271Pro) mutant with isoniazid

(红色为katG野生型蛋白,绿色是katG Thr271Pro点突变蛋白)图11 Thr271点突变蛋白与野生型蛋白结构叠加对比图Fig.11 Comparison of structural superposition of Thr271Pro mutant protein and Wild-Type katG protein
3 讨 论
1992年,Zhang等[6]研究证实katG基因缺陷的耐INH菌株获得野生型katG基因后,恢复对INH的敏感性,因此认为katG基因在结核分枝杆菌INH耐药机制中起着关键作用。进一步研究发现,不仅仅是katG基因的完全缺失,katG基因的点突变、碱基的插入与缺失都可能影响其编码的过氧化氢-过氧化物酶活性,从而无法将INH转化成杀菌活性形式的异烟酸,导致结核菌对INH耐药[7]。但katG蛋白如何活化异烟肼及katG蛋白突变后导致异烟肼耐药确切机制并不清楚。若能从基因型突变来判断表型耐药,将大大缩短药敏培养所需时间,及时为临床用药提供参考。为此,研究人员在不同程度耐INH菌株中检测出katG基因不同的突变位点,其中部分突变点被证实导致katG酶活性下降,认为可作为结核菌耐INH的重要标志[8-10]。然而,并非所有的基因位点突变都涉及结核分枝杆菌耐药,有些为细菌进化自然多态性变化,有些却为代偿性突变。研究发现R463L位点的突变是常见的基因多态性,常常与katG基因其他突变位点一同发生,并且多见于异烟肼敏感菌株而不是异烟肼耐药菌株[11]。
本实验katG(Thr271Pro)突变结核菌株来自江西省异烟肼高水平耐药株分离培养,MIC为1 mg/L,且katG(Thr271Pro)突变为katG基因唯一突变位点。而katG(AGC315ACC)突变为我国最为常见的基因突变形式[4]。本实验构建katG野生型、katG(Thr271Pro)突变、katG(AGC315ACC)基因片段,重组至质粒pET-22b(+)。选择该质粒原因是其具有氨苄青霉素抗性且能在katG蛋白C端加上6个His的融合标签,转化至大肠杆菌BL21(DE3)pLySs后,可在含氨苄青霉素培养基中挑选转化阳性菌落进行下一步培养。对培养菌蛋白诱导并超声破碎细菌后,最终可通过镍亲和层析方法纯化出带有6个His融合标签的katG蛋白。酶活性测得:相比野生型(过氧化氢酶活性361.5 U/mg和过氧化物酶活性77.6 U/mg),katG271突变型过氧化氢酶和过氧化物酶活性分别下降56%和63%(158.8 U/mg和28.7 U/mg),katG315突变型过氧化氢酶和过氧化物酶活性分别下降74%和75%(96.2 U/mg和19.7 U/mg)。可以看出katG271突变型较野生型酶活性大幅度下降,但尚未达到katG315突变型下降程度。由此推断该异烟肼耐药菌株katG基因上唯一突变位点katG(Thr271Pro)突变引起了异烟肼耐药。
通过分子模拟对接研究,能揭示耐药靶点在结构层次上与药物的相互作用,阐明药物耐药性的机理[12]。为探讨katG(Thr271Pro)突变是如何导致异烟肼耐药,进一步通过分子模拟对接技术发现katG突变酰胺的氧与Fe原子距离拉开到3.1埃,酰胺上的氢与ASP137上的氧形成了1.9埃氢键。野生型的蛋白与异烟肼结合没有类似氢键,ASP137残基的羧基发生了一定角度的旋转。而且,Thr271Pro突变体KatG蛋白与异烟肼分子结合的亲和性较野生型降低。从而可以推断,271氨基酸残基突变后,导致氧化反应活性空腔发生了一定的变形。
Brossier F等[13]在极高水平异烟肼耐药菌株(>10 mg/L)中检测到katG H270R突变,测得过氧化物酶-过氧化氢酶活性几乎完全丧失,分子对接发现katG野生型270位置上组氨酸基团位于口袋近端,与亚铁血红素铁离子形成配位键。270的突变形成空间阻碍,与亚铁血红素失去配位键连接,使亚铁血红素不能结合上katG蛋白。而本实验研究对象271突变氧化反应活性空腔发生了一定的变形,并未完全与血红素失去联系,但酶活性表现非常低。吴海松等[14]在结核病异烟肼治疗超过6个月患者体内检测出270、271双位点突变菌株,密码子为(ACT-GTT),此体内研究表明该区域位点突变后,结核分枝杆菌仍在服用异烟肼患者中生长,进一步提示该位点与异烟肼耐药极为相关。
研究结果提示:katG271位点及邻近氨基酸残基均为功能氨基酸,可能是维持katG蛋白活性的重要组分。其突变影响katG酶活性部分缺失及氧化反应活性空腔发生变形,与异烟肼耐药关系相关。因此认为katG(Thr271Pro)可作为INH耐药菌株检测的参考标志,为临床INH耐药基因的筛查、开发基因芯片等提供重要理论依据。
