miR-132通过降低HMGA2的表达抑制骨肉瘤细胞迁移、侵袭及上皮间质转化
2019-07-12蒋臻章水均徐跻峰赵小波鲍涛
蒋臻,章水均,徐跻峰,赵小波,鲍涛
(1.淳安县第一人民医院 骨科,浙江 杭州 311700;2.浙江省人民医院 骨科,浙江 杭州 310014)
骨肉瘤是最常见的恶性骨肿瘤之一,好发于青年患者[1]。目前,化疗及放疗依然是骨肉瘤的主要治疗手段[2]。尽管研究人员在骨肉瘤治疗领域进行大量探索并取得一定进展,骨肉瘤患者的总体预后依然较差,尤其是已经发生远处转移或复发的患者。微小RNA(microRNA,miRNA)是细胞内长度约20个核苷酸的非编码RNA,通过与靶基因mRNA的3’-端非编码区结合,在转录后水平抑制靶基因的表达[3]。 近年来,miRNA在骨肉瘤发生发展中的作用逐渐被重视。研究表明:多种miRNA在骨肉瘤中存在异常表 达,并且对骨肉瘤细胞的生长、转移及耐药性等生物学功能具有重要调控作用[4]。miR-132被发现在肝癌、肺癌及胃癌等多种恶性肿瘤中存在低表达,能够抑制肿瘤细胞的增殖,诱导细胞凋亡,发挥抑癌作用[5-7]。骨肉瘤相关研究表明:miR-132在骨肉瘤组织中低表达,并且与骨肉瘤患者的不良预后具有相关性[8]。miR-132能够通过靶向调控cyclin E1及SXO4基因的表达,发挥对骨肉瘤细胞增殖及转移的调控作用[9-10]。然而,miR-132调控骨肉瘤细胞的侵袭转移是否存在其他分子机制,目前仍不明确。本研究通过Transwell、实时荧光定量PCR(quantitative Real-time PCR,qRT-PCR)以及Western blot实验探明miR-132对骨肉瘤细胞迁移、侵袭能力以及上皮间质转化的影响,并利用生物信息学数据库寻找miR-132的下游作用靶点,进一步利用qRT-PCR、Western blot及荧光素酶报告基因实验证实在骨肉瘤细胞中miR-132对下游靶基因表达的调控作用。
1 材料和方法
1.1 材料 骨肉瘤细胞系(HOS及U2OS细胞)及人成骨细胞系hFOB1.19购自美国典型培养物保藏中心(American Type Culture Collection,ATCC)。DMEM培养基及胎牛血清购自美国Gibico公司;引物购自上海生工生物工程技术服务有限公司;miR-132模拟物(miR-132 mimic)和空白对照miRNA(miRNA control,miR-Control)、miR-132抑制物(miR-132 inhibitor)和阴性对照miRNA(miRNA negative control,miR-NC)、野生型HMGA2 3’-UTR质粒和突变型HMGA2 3’-UTR质粒购自上海市吉凯生物科技有限公司;转染试剂Lipofectamine 2 000、qRT-PCR试剂盒购自美国Invitrogen公司;Transwell小室及24孔细胞培养板购自美国Corning公司;兔抗E-cadherin抗体、鼠抗Vimentin抗体、鼠抗HMGA2抗体、鼠抗GAPDH抗体以及HRP标记的抗鼠/兔二抗购自美国Abcam公司。
1.2 方法
1.2.1 细胞培养及转染:本实验所用骨肉瘤细胞(HOS及U2OS细胞)及人成骨细胞hFOB1.19均利用含有10% FBS的DMEM培养基进行培养,并放置于37 ℃ 且含有5% CO2的细胞培养箱中培养,每日更换新鲜培养基,并观察细胞生长状况,取处于对数生长期细胞进行后续实验。在进行细胞转染时,首先将细胞接种于6孔板,当细胞融合度达50%~70%时,按照Lippofectamine 2 000试剂盒说明书将miR-132 mimic、miR-Control、miR-132 inhibitor及miR-NC分别进行稀释(5 mmol/L),加到6孔板细胞培养基中,培养24 h后,更换为含10% FBS的新鲜DMEM培养基,进一步培养48 h后,利用qRT-PCR检测转染效果,确认转染成功后将细胞用于后续实验。
1.2.2 qRT-PCR:采用传统TRIzol法提取本研究所用细胞的RNA,进一步利用反转录试剂盒将RNA反转录成cDNA。利用qRT-PCR试剂盒检测细胞内miR-132及E-cadherin、Vimentin和HMGA2 mNRA的表达;U6为miR-132的内参,GAPDH为E-cadherin、Vimentin及HMGA2的内参;miR-132正向引物为5’-TAACAGTCTA CAGCCATGGTCG-3’,反向引物为5’-CTTCTTGCTGGTCTTG CCATTCC-3’;U6正向引物为5’-GCTTCGGCAGCACATATA CTAAAAT-3’,反向引物为5’-CGCTTCACGAATTTGCGTGTC AT-3’;HMGA2正向引物为5’-TCCCTCTAAAGCAGCTCAA AA-3’,反向引物为5’-ACTTGTTGTGGCCATTTCCT-3’;E-cadherin正向引物为5’-TCCATTTCTTGGTCTACGCC-3’,反向引物为5’-CACCTTCAGCCAACCTGTTT-3’;Vimentin正向引物为5’-AGCTGCTAACTACCAGGACACTATTG-3’,反向引物为5’-CGAAGGTGACGAGCCATCTC-3’;GAPDH正向引物为5’-TTTGGTCGTATTGGGCGCCTGGTCA-3’,反向引物为5’-TTGTGCTCTTGCTGGGGCTGGTGGT-3’。
1.2.3 Transwell实验:迁移能力检测:将U2OS细胞分为miR-Control组和miR-132 mimic组,将HOS细胞分为miR-NC组和miR-132 inhibitor组。利用DMEM培养基重悬上述细胞(2×106/mL),向Transwell小室中加入200 μL上述细胞悬液;向24孔板实验孔加入600 μL含有10% FBS的DMEM培养基后,将盛有细胞悬液的Transwell小室置于含有培养基的培养孔;将上述Transwell孔板置于37 ℃恒温细胞培养箱中培养24 h;取出Transwell小室,PBS清洗后,利用棉签擦去小室薄膜上层细胞后,结晶紫染色薄膜下层细胞后,置于显微镜下计数拍照。侵袭能力检测:在向Transwell小室接种细胞悬液前,在每个小室膜上滴加80 μL利用DMEM稀释的基质胶(稀释比例为1:6),置于37 ℃恒温细胞培养箱中静置2 h,待基质胶固化后再接种细胞,其余步骤同细胞迁移实验。
1.2.4 Western blot检测细胞内蛋白的表达:利用BCA试剂盒测定经过RIPA裂解液提取的细胞内蛋白浓度,在SDS-PAGE胶的上样孔中每孔加入等量蛋白样品(20 μg),置入电泳槽中进行电泳分离后,进一步利用湿转系统,100 V转膜2 h;室温封闭30 min后,分别加入HMGA2抗体(1:1 000)、E-cadherin(1:1 000)、Vimentin(1:1 000)和GAPDH抗体(1:2 000),并于4 ℃冰箱孵育过夜;室温条件下,利用TBST缓冲液漂洗10 min×3次后,加入山羊抗兔或鼠IgG二抗(1:5 000),室温孵育1 h;利用TBST缓冲液漂洗5 min×3次后,将膜置于暗室中,并滴加ECL发光液显影。
1.2.5 荧光素酶报告基因实验:对U2OS细胞进行如下分组:miR-Control与野生型HMGA2 3’-UTR质粒共转染组,miR-132 mimic与野生型HMGA2 3’-UTR质粒共转染组,miR-Control与突变型HMGA2 3’-UTR质粒共转染组,miR-132 mimic与突变型HMGA2 3’-UTR质粒共转染组;对HOS细胞进行如下分组:miRNC与野生型HMGA2 3’-UTR质粒共转染组,miR-132 in-hibitor与野生型HMGA2 3’-UTR质粒共转染组,miR-NC与突变型HMGA2 3’-UTR质粒共转染组,miR-132 inhibitor与突变型HMGA2 3’-UTR质粒共转染组。利用Lippofectamine 2 000完成共转染后48 h,按双荧光素酶活性检测试剂盒说明书操作,收集细胞,检测细胞内荧光素酶活性。
1.3 统计学处理方法 利用GraphPad Prism软件进行数据分析。计量资料用±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 miR-132在骨肉瘤细胞系中低表达 U2OS、HOS及hFOB1.19细胞中的miR-132相对表达水平分别为0.32±0.05、0.51±0.06和1.05±0.07。相较于人成骨细胞hFOB1.19,骨肉瘤细胞中miR-132的表达水平显著降低(P<0.05);在2种骨肉瘤细胞系中,miR-132在HOS中的表达水平较高,而在U2OS细胞中的表达水平较低。
2.2 miR-132 mimic降低U2OS细胞迁移及侵袭能力 与miR-Control组(1.00±0.05)相比,转染miR-132 mimic(6.78±0.52)可显著上调U2OS细胞中的miR-132表达水平(P<0.01);Transwell实验结果显示:过表达miR-132后,U2OS细胞的迁移及侵袭能力显著降低(P<0.05),见图1。
2.3 miR-132 mimic抑制U2OS细胞的上皮间质转化 qRT-PCR检测结果显示:在U2OS细胞内转染miR-132 mimic后,细胞内E-cadherin mRNA表达水平增高,而Vimentin mRNA表达水平降低(P<0.05);Western blot结果表明:转染miR-132 mimic后,U2OS细胞内E-cadherin蛋白表达增高,Vimentin蛋白表达降低(P<0.05),见图2。
2.4 转染miR-132 inhibitor促进HOS细胞迁移及侵袭 与miR-NC组相比,miR-132 inhibitor显著降低HOS细胞中的miR-132的表达水平(P<0.01);Transwell实验结果显示:转染miR-132 inhibitor后,HOS细胞的迁移及侵袭能力显著增强(P<0.05),见图3。
2.5 转染miR-132 inhibitor促进HOS细胞的上皮间质转化 qRT-PCR检测结果显示:在HOS细胞内转染miR-132 inhibitor后,细胞内E-cadherin的mRNA表达水平降低,而Vimentin mRNA的表达水平增高 (P<0.05);Western blot结果表明:转染miR-132 inhibitor后,HOS细胞内E-cadherin蛋白表达降低,Vimentin蛋白表达增高(P<0.01),见图4。

图1 miR-132 mimic抑制U2OS细胞迁移及侵袭

图2 转染miR-132 mimic抑制U2OS细胞的上皮间质转化
2.6 HMGA2为miR-132下游靶基因 通过对TargetScan网站进行数据挖掘及检索发现:HMGA2是miR-132的潜在下游靶点之一,miR-132与HMGA2 mRNA的3’-UTR间存在互补配对序列(见图5)。荧光素酶报告基因实验显示:过表达miR-132后,转染野生型HMGA2 3’-UTR的U2OS细胞内的荧光素酶活性显著降低(P<0.05),而转染突变型HMGA2 3’-UTR的U2OS细胞内的荧光素酶活性未见明显改变,见图6A。在HOS细胞中的实验显示:敲低miR-132后,野生型HMGA2 3’-UTR组细胞荧光素酶活性显著增加(P< 0.05),而突变型HMGA2 3’-UTR组细胞荧光素酶活性未见明显改变,见图6B。
2.7 miR-132可调控骨肉瘤细胞内HMGA2的表达 qRT-PCR检测结果显示,相较于对照组细胞,过表达miR-132的U2OS细胞内HMGA2 mRNA表达水平显著降低(P<0.05);Western blot表明:过表达miR-132后,细胞内HMGA2蛋白表达水平显著降低(P<0.05),敲低miR-132后,HOS细胞内HMGA2 mRNA及蛋白水平显著增加(P<0.05),见图7。
3 讨论

图3 转染miR-132 inhibitor可促进HOS细胞迁移及侵袭
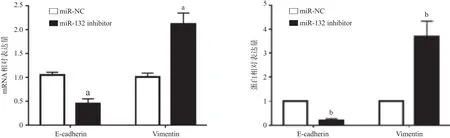
图4 转染miR-132 inhibitor促进HOS细胞的上皮间质转化

图5 miR-132与HMGA2 3’-UTR的基因序列
近年来,骨肉瘤相关研究表明:miRNAs是调控骨肉瘤发生发展的重要因子。诸多miRNAs在骨肉瘤组织中存在异常表达,对骨肉瘤细胞增殖、凋亡、迁移及侵袭等生物学行为具有重要调控作用[11]。既往研究表明:miR-132在肺癌、结直肠癌、乳腺癌、肝癌、卵巢癌及胰腺癌等多种恶性肿瘤中存在异常表达,发挥抑癌或促癌作用[5,7,12-15]。骨肉瘤中的研究表明:miR-132在骨肉瘤组织中存在低表达[8]。miR-132可通过抑制骨肉瘤细胞中cyclin E1的表达,抑制细胞增殖[9]。此外,miR-132还被发现能够抑制SOX4的表达,进而抑制骨肉瘤的生长及转移[10]。然而,是否存在其他分子机制介导miR-132对骨肉瘤细胞迁移和侵袭的调控作用,目前仍不明确。因此,本研究利用Transwell实验及miR-132过表达或敲低技术,探明miR-132对骨肉瘤细胞迁移及侵袭能力的影响。研究结果显示:过表达miR-132能够降低骨肉瘤细胞迁移及侵袭能力,而敲低miR-132则能增强骨肉瘤细胞的转移能力;进一步的分子机制表明:miR-132通过靶向抑制HMGA2的表达,发挥对骨肉瘤细胞迁移及侵袭的抑制作用。
肿瘤细胞的迁移及侵袭是复杂的病理生理学过程,其分子机制复杂。肿瘤细胞的上皮间质转化是指肿瘤细胞丧失上皮细胞表型,逐渐获得间质细胞表型,从而表现出更强的迁移及侵袭能力[16]。肿瘤细胞的上皮间质转化已被认为是肿瘤细胞迁移及侵袭的重要分子机制。因此,本研究进一步探究miR-132对骨肉瘤细胞上皮间质转化的影响。过表达miR-132后,骨肉瘤细胞的上皮细胞标志物E-cadherin 表达增加,而间质细胞标志物Vimentin表达降低,表明上皮间质转化受到抑制;敲低miR-132后,骨肉瘤细胞中E-cadherin表达降低,而Vimentin表达增加,表明细胞上皮间质转化过程被促进。这些研究数据提示:miR-132可能通过抑制细胞上皮间质转化的发生抑制细胞迁移及侵袭。

图6 miR-132调控野生型HMGA2 3’-UTR的荧光素酶活性

图7 miR-132调控骨肉瘤细胞内HMGA2的表达
在探明miR-132对骨肉瘤细胞迁移、侵袭及上皮间质转化的调控作用后,本研究进一步挖掘其发挥上述生物学功能的分子机制。对Targetscan网站数据挖掘显示:本研究miR-132与HMGA2 mRNA的3’-UTR存在互补配对序列,表明miR-132可能可与HMGA2 mRNA结合而抑制其表达。荧光素酶实验结果提示:改变miR-132的表达水平能够调控野生型HMGA2 3’-UTR的荧光素酶活性,而对互补配对序列发生突变的突变型HMGA2 3’-UTR的荧光素酶活性没有影响。进一步的qRT-PCR和Western blot实验表明:过表达miR-132后,细胞内HMGA2的表达水平降低;而敲低miR-132后,细胞内HMGA2的表达水平增加。这些结果显示:miR-132可通过互补配对序列与HMGA2 3’-UTR结合,抑制其在骨肉瘤细胞中的表达。既往研究表明:HMGA2是调控骨肉瘤细胞侵袭迁移的重要蛋白[17]。因此,本研究结果提示:miR-132可能通过抑制HMGA2的表达发挥对骨肉瘤细胞迁移、侵袭及上皮间质转化的调控作用。
综上所述,miR-132在骨肉瘤细胞中低表达,能够抑制骨肉瘤细胞的迁移、侵袭及上皮间质转化;miR-132能够与HMGA2的3’-UTR结合,抑制骨肉瘤细胞内HMGA2的表达。因此,miR-132可能通过抑制HMGA2的表达发挥对骨肉瘤细胞迁移、侵袭及上皮间质转化的抑制作用。
