不同方法检测利福平耐药结核病及MTBrpoB基因突变的对比分析
2019-07-12林勇明黄晓伟林淑芳魏淑贞林建赵永
林勇明 黄晓伟 林淑芳 魏淑贞 林建 赵永
耐多药结核病(multidrug-resistant tuberculosis, MDR-TB)是当前结核病控制工作的重点与难点,有效防控MDR-TB是整个结核病控制工作进程的关键控制点。研究表明,大多数对利福平耐药的MTB菌株同时也对异烟肼耐药[1],MTB对利福平的耐药情况一定程度上可以反映该地区的MDR-TB疫情。基因突变是产生耐药MTB的根本原因,RNA聚合酶β亚基(rpoB基因)突变可引起96%以上的MTB临床分离株对利福平耐药[2],MTB对利福平耐药的决定区(rifampin resistance-determining region,RRDR)主要位于507~533区[3]。目前,MTB耐药性检测的“金标准”仍然是表型药物敏感性试验(简称“药敏试验”),核酸反向线性探针杂交技术(属于GenoType MTBDRplus方法,简称“MTBDRplus”)和利福平耐药实时荧光定量核酸扩增检测技术(GeneXpert MTB/RIF,简称“Xpert技术”)。但在临床实际中,3种方法检测结果对部分菌株是否存在利福平耐药性会出现不同,为了解此类菌株的基因突变情况,笔者对其进行了3种方法的耐药性检测,并进行了ropB基因测序,并将测序结果与检测结果进行对比分析与评价。
资料和方法
一、研究对象
搜集2017年福建省泉州市所辖10个县(市、区)结核病定点医院登记的511例确诊肺结核患者,同时经比例法、MTBDRplus与Xpert技术等3种方法检测对利福平的耐药情况,并对3种方法检测结果不相同但至少1种结果为对利福平耐药的66株 MTB行ropB基因测序,并对55株获得基因测序结果的菌株进行ropB基因突变情况分析。H37Rv标准株由国家结核病参比实验室提供。
二、研究方法
1.主要仪器和试剂:主要仪器有隔水式恒温培养箱,GeneXpert MTB/RIF检测系统(购自美国Cepheid公司),水浴锅(购自中国上海精宏公司),PCR扩增仪(购自美国ABI公司),微生物核酸杂交仪(TwinCubator,购自Hain 生命科学股份有限公司,德国);主要试剂有罗氏药敏试验培养基(购自中国珠海贝索生物技术有限公司)、GeneXpert MTB/RIF试剂盒和GenoType MTBDRplusV2试剂盒(均购自美国赛沛公司)。
2.患者入选标准:(1)根据《WS 288—2017 肺结核诊断》[4],痰标本分枝杆菌分离培养阳性并经初步菌种鉴别为结核分枝杆菌复合群的患者确诊为肺结核。(2)对利福平耐药:根据《结核病实验室检验规程》[5],固体比例法中,耐利福平菌落大于1%则判断为利福平耐药;Xpert检测结果在检测系统可直接报告是否对利福平耐药;MTBDRplus检测根据试剂盒说明书进行操作,如果rpoB基因区至少有1个野生型探针WT缺失或突变型探针Mut染色阳性,则表示试验菌株对利福平耐药[6]。
3. 痰涂片、痰培养及Xpert检测:本研究按照《结核病实验室检验规程》[5]的要求对收集的痰标本进行萋-尼染色显微镜检查;痰涂片阳性患者由县级结核病定点医院实验室负责进行痰培养,有条件的实验室同时按照《结核病实验室检验规程》[5]对痰涂片阳性标本进行Xpert检测。
4.药敏试验:由市疾病预防控制中心定期收集辖区内各县级结核病定点医院实验室痰涂片阳性的痰标本及痰培养管,对所有1279株培阳标本采用对硝基苯甲酸(PNB)、噻吩-2-羧酸肼(TCH)[6]进行初步菌种鉴别,鉴别结果包括MTB 1169株,非结核分枝杆菌(NTM)110株。对鉴定为MTB的临床分离株应用固体比例法进行一线抗结核药物的药敏试验,同时采用随机数字表法抽取711株MTB临床分离株按照《结核病实验室检验规程》进行MTBDRplus 检测,最终有511株同时进行了Xpert检测、传统药敏试验和MTBDRplus检测。
5.细菌DNA制备:取常规L-J培养基培养2~3周、生长良好的MTB一菌环菌落溶于400 μl三羟甲基氨基甲烷-乙二胺四乙酸(TE)缓冲液(pH 8.0)中,在旋涡振荡器上振荡至菌落呈块状固体,并将其均匀溶于TE缓冲液中,在95 ℃水浴15 min后,离心半径4 cm,3000 r/min,离心5 min,取上清。
6.聚合酶链式反应(polymerase chain reaction,PCR):从http://www.ncbi.nlm.nih.gov的GenBank 获得H37Rv的rpoB基因序列。采用Primer Premier 5.0软件设计引物:上游引物F为5′-GAG CCC CCG ACC AAA GA-3′,下游引物R为5′-ATG TTG GGC CCC TCA GG-3′,片段长629 bp[含密码子507~533的利福平耐药决定区(rifampin resistance determining region,RRDR)]。反应体系共50 μl,包括2×Taq PCR Master Mix 25 μl、上下游引物各1 μl(10 μmol/L),模板10 μl,去离子水13 μl。PCR扩增条件:94 ℃变性8 min;94 ℃ 30 s,30个循环;58 ℃ 30 s;72 ℃ 30 s;再72 ℃延伸5 min。
7. DNA测序和分析:PCR产物经1.5%琼脂糖凝胶电泳验证为扩增的单一目的条带后,产物送上海生物工程公司利用基因测序技术,分别对试验菌株的rpoB基因进行序列分析。通过BLAST软件(http://www.ncbi.nlm.nih.gov/BLAST) 将试验菌株的rpoB基因测序结果与H37Rv的相应基因序列进行比对分析,获得各菌株耐药基因突变位点及突变特征。
三、统计学处理
采用Excel 2007录入结果数据,SPSS 11.0软件进行数据的统计学分析,计数资料的比较采用卡方检验或Fisher确切概率法(当理论频数<5时),以P<0.05为差异有统计学意义。
结 果
一、MTBDRplus与Xpert检测利福平耐药情况
511株检测菌株中,比例法、MTBDRplus、Xpert技术检测到利福平的耐药率分别为38.16%(195/511)、40.51%(207/511)、45.99%(235/511),MTBDRplus技术与比例法检测的利福平耐药率差异无统计学意义(χ2=0.590,P=0.442);而Xpert技术检测的利福平耐药率明显高于比例法(χ2=6.424,P=0.011)。
以比例法检测结果为标准,Xpert检测利福平耐药的敏感度(93.85%)与MTBDRplus(95.39%)间的差异无统计学意义(χ2=0.453,P=0.501);而MTBDRplus的特异度(93.35%)和一致率(94.13%)均明显高于Xpert技术[分别为83.54%和87.48%](χ2=14.88、13.54,P值均=0.000)。详见表1。
二、ropB基因突变情况
检测的511株菌株中,3种方法检测结果不完全相同的菌株有66株,其中55株获得rpoB基因序列,7株冻存的菌株未能成功传代致DNA提取失败,4株未能获得测序结果。
1. 测序菌株的ropB基因突变情况:获得rpoB基因序列的55株菌株中,47株(85.46%)ropB基因在371~566位点间的17个位置发生了36种类型的突变,其中372、373、374、376、377、378、379、382、516和526等10个氨基酸位点均分别发生了2种或2种以上类型的突变,尤以377位明显[42株(76.36%)发生了6种类型的突变],其次为511位[7株(12.73%)发生了1种类型的突变]。其中13株(23.64%)发生碱基缺失或插入(均在377位);7株(12.73%)发生点突变,有5株(71.43%)发生在RRDR区外;27株(49.09%)发生联合突变,有11株(40.74%)发生在RRDR区外。另外,40株(72.73%)菌株内还发现50个无意义突变(即不影响编码蛋白的表达,结构或功能无明显变化)。详见表2。
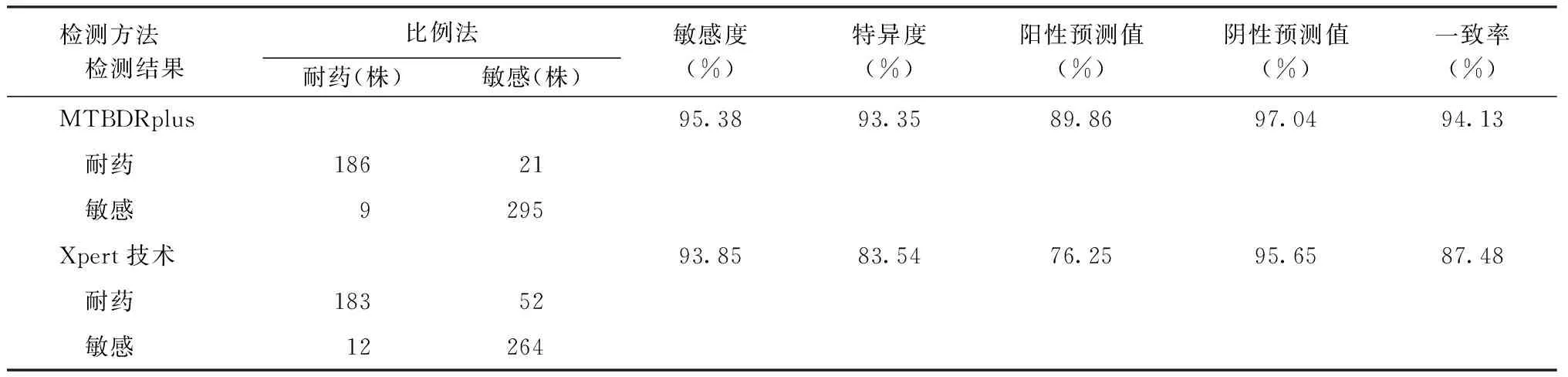
表1 以比例法为标准,不同方法检测MTB临床分离株利福平耐药性的检测效能
注敏感度=真耐药株数/(真耐药株数+假敏感株数)×100%,阳性预测值=真耐药株数/(真耐药株数+假耐药株数)×100%,特异度=真敏感株数/(假耐药株数+真敏感株数)×100%,阴性预测值=真敏感株数/(假敏感株数+真敏感株数)×100%,一致性=(真耐药株数+真敏感株数)/总株数×100%
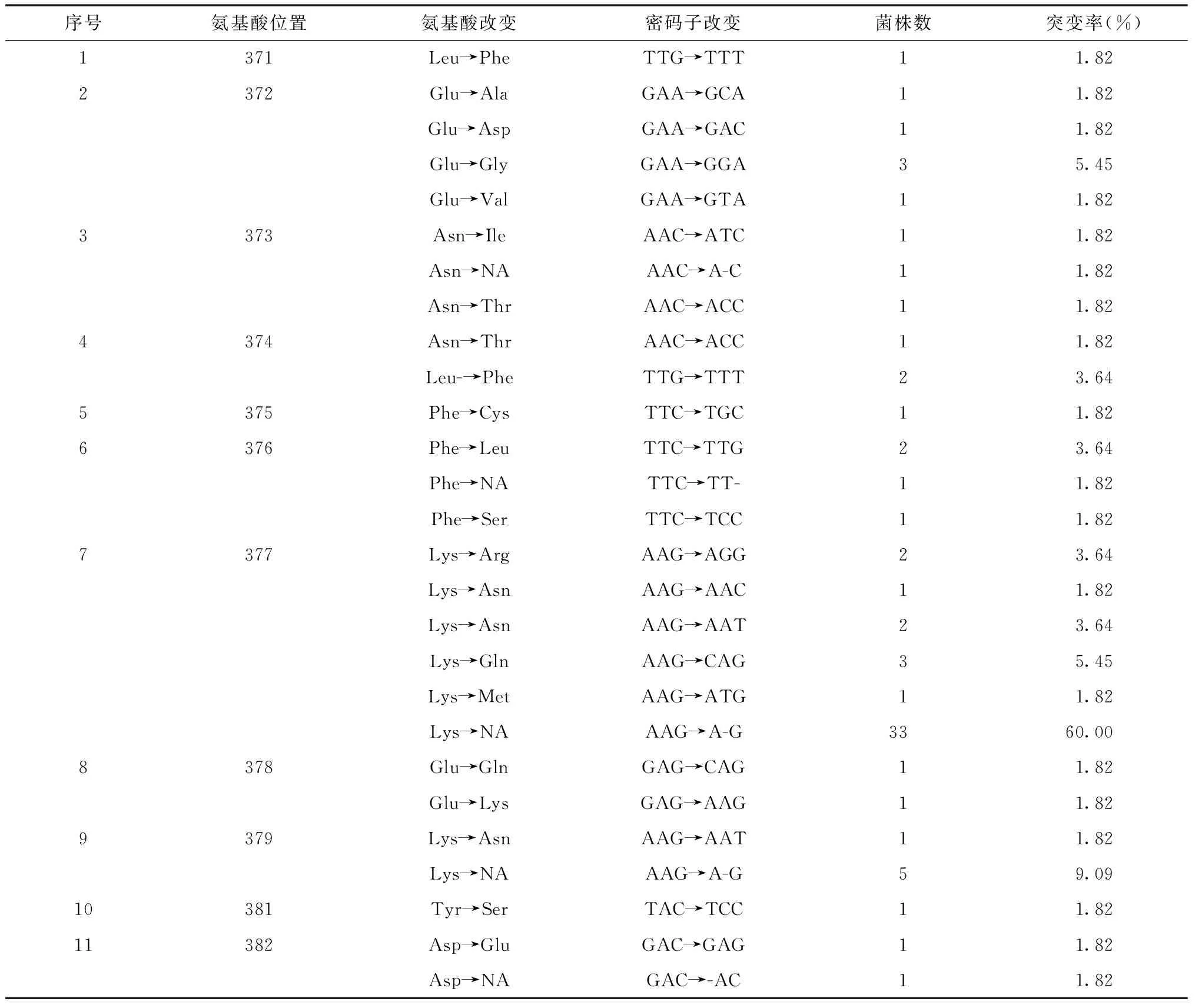
表2 55株获得基因序列的MTB菌株rpoB基因突变分布情况
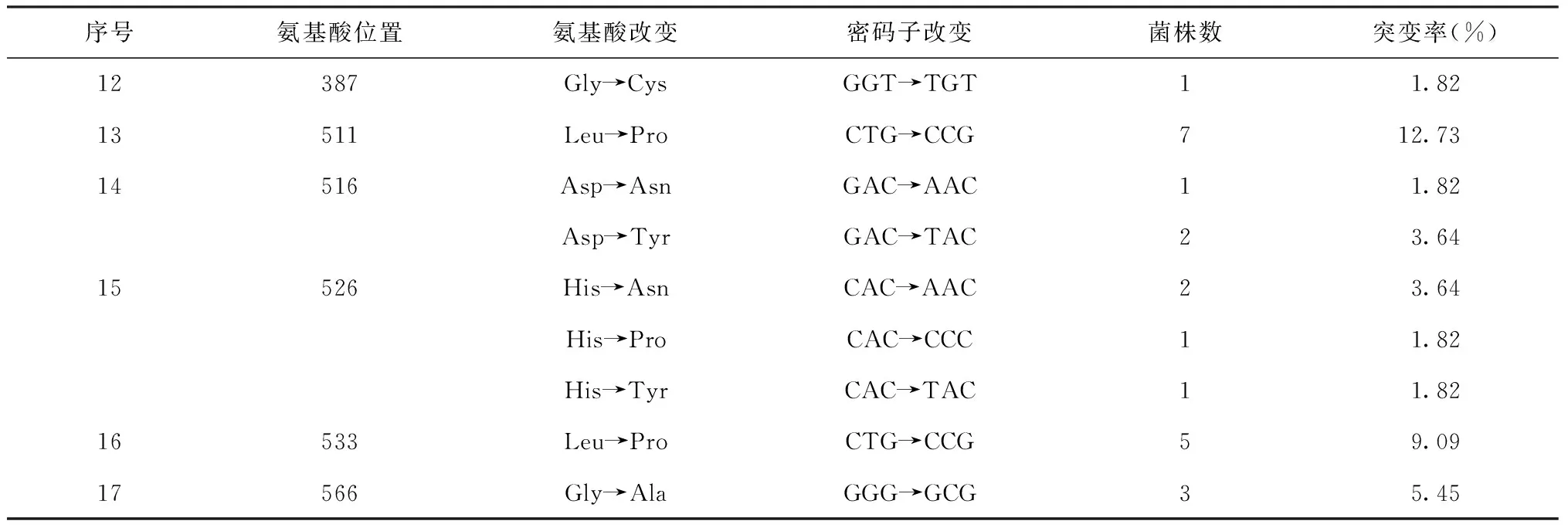
续表2
注“-”代表 “缺失
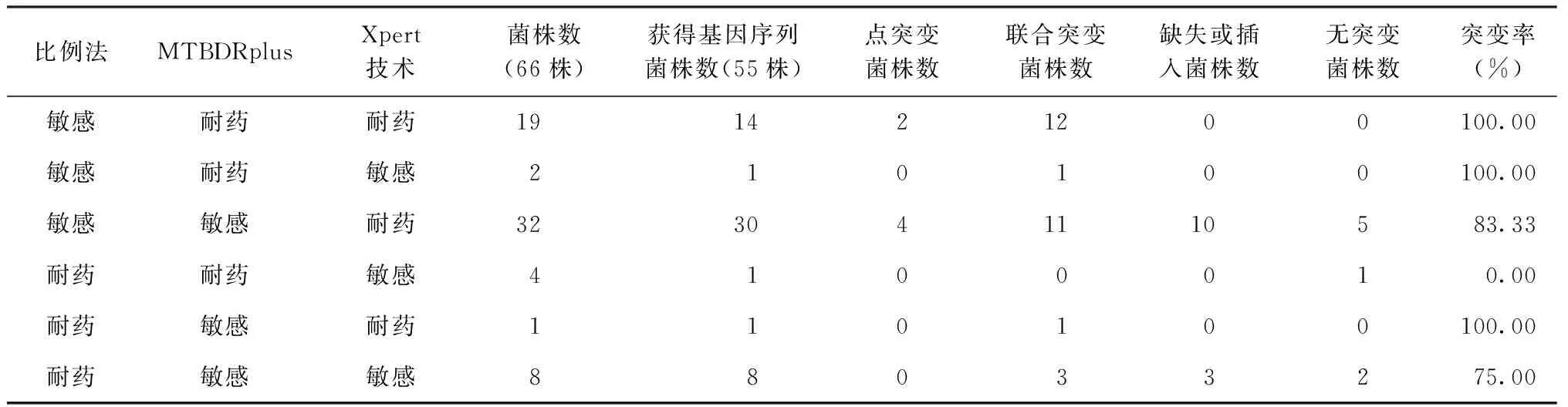
表3 3种方法检测利福平耐药结果异同的MTB临床分离株rpoB基因突变情况
注突变率=(点突变菌株数+联合突变菌株数+缺失或插入菌株数)/获得基因序列菌株数×100%
2. 利福平耐药结果异同菌株的ropB基因突变情况:55株获得rpoB基因序列中,45株为比例法检测利福平敏感而分子药敏试验(1种或2种方法)检测为耐药,其中40株(88.89%,40/45)rpoB基因发生有意义突变,包括15株(37.50%,15/40)发生在RRDR区(2株为RRDR区点突变,13株为联合RRDR区位点突变);8株为比例法检测利福平耐药而MTBDRplus与Xpert检测均敏感,其中6株rpoB基因发生有意义突变(即影响编码蛋白的表达,结构或功能有明显变化;包括2株为联合RRDR区位点的突变)。比例法与分子药敏试验检测利福平耐药结果不一致的两类菌株之间突变率差异无统计学意义(Fisher确切概率法,P=0.121)。详见表3。
3. MTBDRplus与Xpert检测结果异同菌株的ropB基因突变情况:测序的55株菌株中,MTBDRplus与Xpert检测利福平耐药结果相同的菌株有22株,两者均耐药的14株菌株均发生ropB基因突变,其中10株(71.43%,10/14)在RRDR区位点发生突变;而两者均敏感的8株菌株中,有6株菌株ropB基因发生突变,其中只有1株在RRDR区位点发生突变。MTBDRplus与Xpert检测利福平耐药结果不同的菌株有33株,其中31株为MTBDRplus检测敏感而Xpert检测为耐药,有26株(83.87%)在ropB基因的371~566位点间的13个位置发生了25种类型的突变,但只有1株(3.85%,1/26)在RRDR区位点发生突变;2株为MTBDRplus检测耐药而Xpert检测为敏感,其中1株在ropB基因的373、377和516的位置发生了3种类型的联合突变。
讨 论
控制耐多药结核病,除了有效的治疗管理外,通过快速诊断耐药结核病患者,做到早期发现、早期合理治疗,对预防MDR-TB的发生和传播至关重要。目前我国耐药结核病的诊断仍然主要依靠传统的涂片、培养和药敏试验。抗酸杆菌痰涂片镜检方法操作简便、快速、经济、特异度强,因此在基层实验室应用最为广泛,但敏感度较低;固体培养以改良罗氏培养基为主,敏感度较涂片镜检高,价格较低廉,但阳性培养结果一般需要1个月左右才能报告,阴性结果则需要等待2个月方可报告;采用固体比例法药敏试验和液体药敏试验分别需要1个月和2 周左右才能报告药敏试验结果,故传统的药敏试验远远不能满足临床诊治的需要;而目前只有分子检测能够快速发现耐药MTB,因此建立快速且可靠的药敏试验方法是目前结核病基础研究领域的重点。
基于以上原因,WHO[7]于2015年推荐使用线性探针检测(line probe assay,LPA)和Xpert两种技术。本研究显示,MTBDRplus和Xpert技术用于MTB临床分离株检测对利福平耐药的敏感度分别达到95.39%和93.85%,和国内其他学者报道相似[6,8],提示分子药敏试验检测利福平耐药性具有较高的敏感度,其及时发现和快速诊断MDR-TB方面的作用已得到广大结核病防治人员的接受与认可[7-8]。然而由于不同检测方法间敏感度与特异度的差异,会出现不同方法检测同一菌株时对利福平是否耐药的结果不相同,使临床诊断造成困惑。
表型药敏试验检测利福平为敏感而分子药敏试验检测为耐药(至少1种或2种方法检测均耐药)的菌株,经基因测序复核,88.89%的菌株在ropB基因发生有意义的突变,突变位点广泛,以联合突变为主,近2/3的突变发生在RRDR区外,而表型药敏试验检测对利福平耐药、分子药敏试验检测对利福平敏感的8株菌株中有75.00%的菌株有rpoB基因发生有意义突变,但也有2株菌株未发生突变,与国内其他研究差别较大[10-14]。对于二者检测产生不同结果的可能原因如下:(1)可能临床患者中存在异质性耐药菌株[15];(2)推测ropB基因RRDR区外还存在影响MTB对利福平耐药的其他未知机制[16];(3)非ropB基因突变引起耐药,等等。
研究结果还显示,MTBDRplus技术的特异度和一致率均高于Xpert 技术,若未进行基因复核,仅以表型药敏试验为“金标准”,Xpert技术检测结果可能会出现更多的“假阳性”结果。通过对66株菌株ropB基因测序发现,MTBDRplus与Xpert技术检测利福平均耐药的14株菌株ropB基因的突变位点10株(71.43%)发生在RRDR区内;而两者结果均敏感的8株菌株和不一致的33株菌株,分别有5株和25株发生的ropB基因突变位点都在RRDR区外,提示临床实践中,经分子药敏试验检测耐药而表型药敏试验检测为敏感的菌株,不能轻易判断分子检测结果为“假阳性”。
本研究仅对3种方法检测结果不相同且至少1种结果为利福平耐药的66株菌株进行了ropB基因测序,仅55株获得了基因测序结果,不能以基因测序为标准判断不同方法检测MTB临床分离株对利福平耐药的效能,仅揭示部分菌株存在的基因突变,无法进一步深入分析其耐药与突变的机制。
综上所述,MTB对利福平是否耐药的结果判断时应遵循《结核分枝杆菌耐药性检测专家共识》[15]原则,只要任何一种方法检测为利福平耐药,首先应考虑该株MTB对利福平耐药;应尽快采用其他检测方法进行验证,同时结合异烟肼耐药性的筛查,以便及早发现、诊断MDR-TB患者。
