2016—2018年北京市昌平区MTB分离株对氧氟沙星耐药情况分析
2019-07-12王燕飞吴进凤孙倩韩露马树波张治国
王燕飞 吴进凤 孙倩 韩露 马树波 张治国
结核病仍然是全球面临的重大公共卫生问题。据世界卫生组织[1]估算,2017年全球新发结核病患者1000万例,因结核病死亡160万例;我国是结核病高负担国家之一,每年新发结核病患者88.9万例,位居世界第二位。2010年全国结核病流行病学抽样调查显示,我国菌阳结核病的患病率约为66/10万,比2000年降低约50%[2]。虽然结核病控制取得了显著的成绩,但是耐药结核病的传播成为我国结核病控制面临的重大挑战[3]。氟喹诺酮类药物是最重要的二线抗结核药物,因其具有强大的杀菌活性,因此在治疗耐药结核病,特别是在短程治疗方案中发挥着重要作用[4]。对氟喹诺酮类药物的耐药性与二线抗结核药物治疗结核病的成败密切相关[5]。本研究纳入北京市昌平区2016—2018年全部分离的结核分枝杆菌培养阳性菌株,分析其对氧氟沙星的耐药性及其分子流行病学特征。
材料和方法
一、菌株
本实验所选取的701株结核分枝杆菌菌株为昌平区结核病防治所收集,取自于全区就诊及管理的菌阳结核病患者。所有菌株经表型药物敏感性试验(简称“药敏试验”;比例法),以及采用对硝基苯甲酸(PNB)和噻吩-2-羧酸肼(TCH)检测进行菌种鉴定,其中耐多药结核分枝杆菌51株,非耐多药结核分枝杆菌650株。标准菌株H37Rv由国家结核病参比实验室提供。
二、试剂来源
本研究使用的改良罗氏培养基及含药罗氏培养基均购置于珠海贝索生物技术有限公司; 2×Taq预混液购自于北京康为世纪生物科技有限公司;所有引物均由北京擎科生物技术有限公司合成。
三、药敏试验
药敏试验采用WHO推荐的比例法进行[6]。培养基中药物浓度分别为:利福平(RFP或R,40 μg/ml), 异烟肼(INH或H, 0.2 μg/ml),乙胺丁醇(EMB或E, 2 μg/ml), 链霉素(Sm或S, 4 μg/ml),氧氟沙星(Ofx, 2 μg/ml)。每批药敏试验选取H37Rv菌株作为对照。
四、基因组DNA提取
采用简单水煮法提取结核分枝杆菌基因组DNA[7]。从改良罗氏培养基斜面刮取一接种环结核分枝杆菌菌落,将菌落转移至带有1 ml 生理盐水的无菌离心管中, 85 ℃ 30 min 灭活, 12 000×g离心5 min,弃上清;菌体沉淀用500 μl 三羟甲基氨基甲烷(Tris)-乙二胺四乙酸(EDTA)缓冲液(TE缓冲液)(pH值为8.0)充分悬浮, 100 ℃金属浴30 min, 冷却至室温后,12 000×g离心5 min,取上清即为粗提基因组DNA。
五、gyrA基因扩增和测序
合成先前文献报道的引物对[7],上游引物:5′-TCGACTATGCGATGAGCGTG-3′,下游引物:5′-GGTAGCACCGTCGGCTCTTG-3′,扩增氟喹诺酮耐药相关基因gyrA基因片段415 bp。扩增体系包括:2×Taq预混液25 μl,上游引物 0.2 μmol,下游引物 0.2 μmol, 粗提基因组DNA 5 μl,并用去离子水补平到总体积50 μl。基因扩增条件如下:预变性94 ℃ 5 min; 7 min,循环94 ℃ 1 min, 60 ℃ 1 min, 72 ℃ 1 min, 72 ℃ 延伸10 min。基因扩增产物电泳检测后送北京擎科生物技术有限公司测序。测序结果以标准敏感菌株H37Rv基因序列作为标准,采用BioEdit软件进行比对。
六、定义
耐多药结核分枝杆菌定义为至少同时对利福平和异烟肼耐药的结核分枝杆菌菌株。初治患者定义为从未因结核病应用过抗结核药物治疗的患者,正进行标准化疗方案规律用药而未满疗程的患者(登记分类以治疗开始时为准),不规则化疗未满1个月的患者;复治患者定义为因结核病不合理或不规律用抗结核药物治疗≥1个月的患者,初治失败和复发患者的定义参考文献[8]。
七、统计学处理
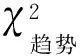
结 果
一、2016—2018年对氧氟沙星的耐药情况及耐药率比较
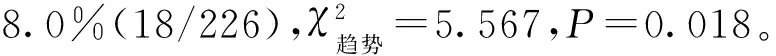
表1 MTB临床分离株对氧氟沙星耐药情况 [株(构成比,%)]
进一步分析显示,MDR-MTB和非MDR-MTB对氧氟沙星的耐药率分别为37.2%(19/51)和3.4%(22/650),MDR-MTB耐药率明显高于非MDR-MTB(P<0.01)。此外,复治患者耐药率为10.0%(3/30),与初治患者5.7%(38/671)的耐药率比较,差异无统计学意义(表2)。
二、氧氟沙星耐药菌株的gyrA突变特征
对全部41株比例法药敏试验确定对氧氟沙星耐药菌株的gyrA基因序列进行分析,总计有31株(75.6%)检测到gyrA基因突变。其中最常见的突变位点在94位密码子(36.6%),上述突变导致94位的天冬酰胺突变为甘氨酸(14.6%)、丙氨酸(9.7%)、天冬氨酸(7.3%)、酪氨酸(2.5%)或者组氨酸(2.5%)。除94位密码子突变外,90位点氨基酸是第2种常见的突变类型,占全部耐药菌株的34.1%,且突变类型均为丙氨酸突变为缬氨酸。此外,还有2株(5.0%)对氧氟沙星耐药菌株突变位点为91位丝氨酸突变为脯氨酸。见表3。
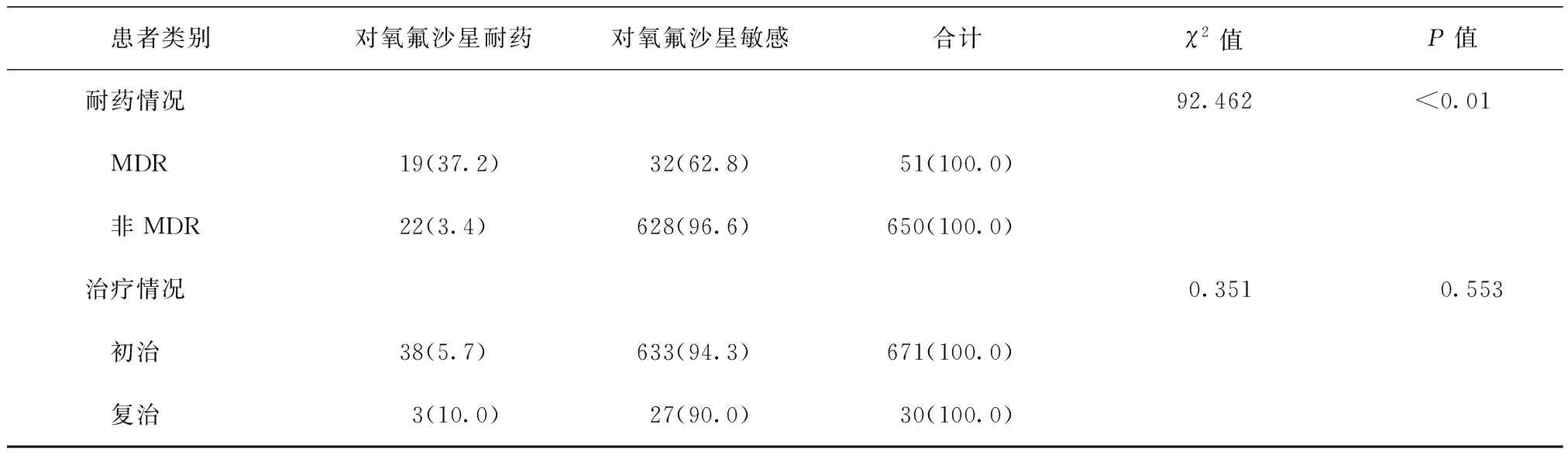
表2 不同类别患者MTB分离株对氧氟沙星的耐药率比较 [株(构成比,%)]
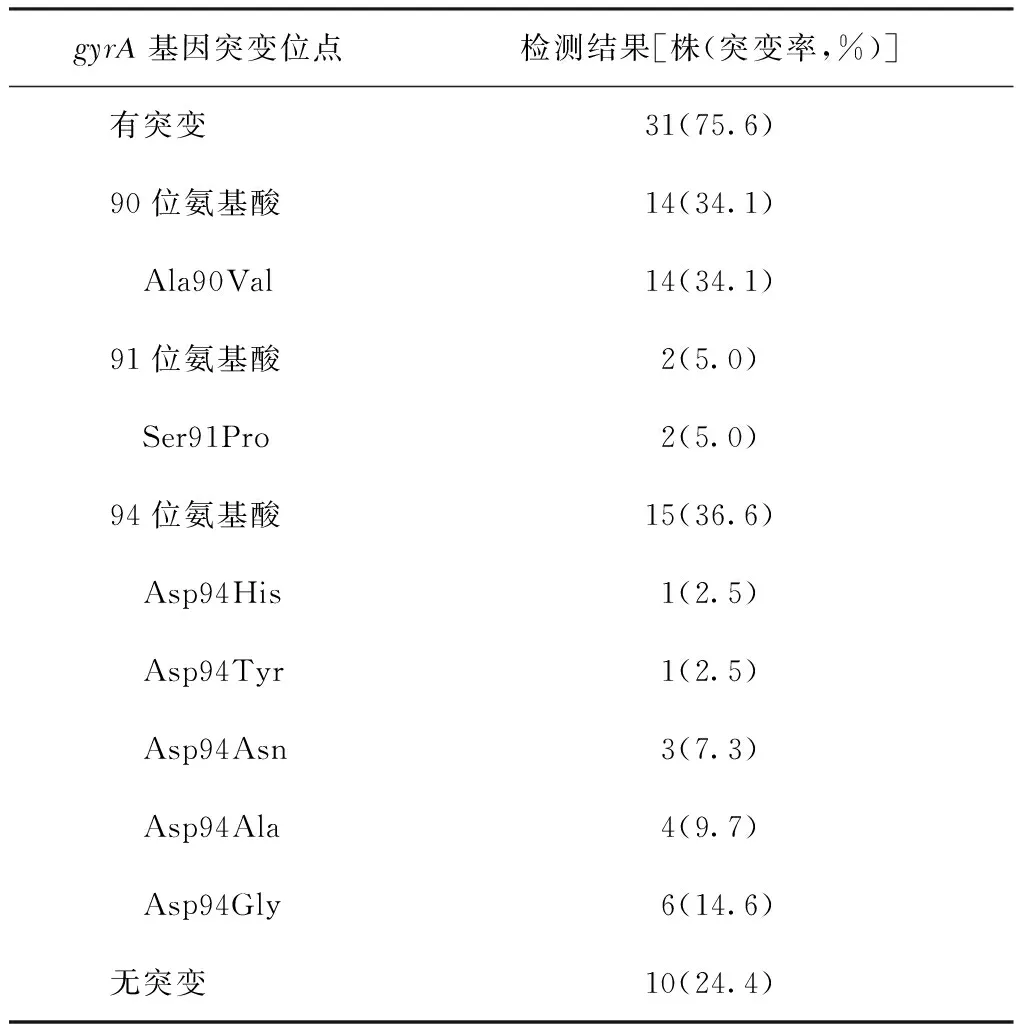
表3 41株对氧氟沙星耐药MTB的gyrA基因突变特征
注Ala:丙氨酸;Ser:丝氨酸;Asp:天冬氨酸;Val:缬氨酸;Pro:脯氨酸;His:组氨酸;Tyr:苏氨酸;Asn:天门冬酰胺;Gly:甘氨酸
讨 论
本研究基于北京市昌平区收集的MTB临床分离株,开展了氧氟沙星耐药率动态趋势变化研究及耐药菌株的分子流行病学研究;结果表明昌平区在过去的3年内所有培养阳性MTB菌株对氧氟沙星的耐药率有显著增加的趋势。近期一项基于全国结核病流行病学调查收集的MTB菌株的研究表明,我国2010年对氟喹诺酮类药物的耐药率明显高于2000年[9],与本研究结果类似。
对氟喹诺酮类药物耐药率的增加主要归因于两方面因素:(1)我国存在抗生素的滥用现象,特别是氟喹诺酮类药物,由于其广谱的抗菌活性及低水平的不良反应率,被广泛用于呼吸道感染的治疗。部分结核病疑似患者在不规律使用氟喹诺酮类药物后极易产生耐药,因此导致了氟喹诺酮耐药率的明显上升[10]。(2)我国抗生素不仅广泛用于治疗各种感染性疾病,同时在畜牧业等领域大规模使用。据一项环境学监测数据表明,我国主要河流中,抗生素检出浓度远高于正常水平[11],提示我国环境中抗生素超标,特别是大环内酯类、青霉素,以及氟喹诺酮类药物,环境中抗生素的浓度上升对于结核病患者耐药率的提升可能存在一定作用。因此,本研究提示对氟喹诺酮类药物的强化管理和合理使用对于结核病、特别是耐药结核病的防治具有重要意义。
此外,本研究中发现MDR-MTB中有超过1/3对氟喹诺酮类药物耐药。近期WHO[12]修订了MDR-TB的治疗指南,其中氟喹诺酮类药物作为3种核心药物之一要求加入MDR-TB治疗方案中。鉴于氟喹诺酮在MDR-TB治疗成败中的核心作用,本地区对氟喹诺酮类药物高耐药率提示有必要在使用前开展药敏试验检测,特别是分子药敏检测,以指导MDR-TB的治疗,提高其治愈率,并减少其在人际间的传播。
gyrA是对氟喹诺酮类药物耐药的主要相关基因,且氟喹诺酮类药物耐药性突变主要发生在该基因的88、90、91、94位点。本研究结果表明,昌平区75.6%对氧氟沙星耐药的MTB是由于gyrA基因突变引起,这与先前来自上海(76%)的研究结果一致[13],但低于俄罗斯(83%)[14]、高于纽约(67%)[15]和突尼斯(50%)[10];导致gyrA基因突变频率地区差异的主要原因可能是各地区流行的MTB分子流行病学特点不同。此外,笔者还发现约25%对氟喹诺酮类药物耐药的菌株未见gyrA基因突变;一方面,DNA拓扑异构酶B亚基(gyrB)基因也是氟喹诺酮类药物的潜在靶标,先前研究表明约有2%~10%对氟喹诺酮类药物耐药的MTB与gyrB基因相关;另一方面,药物外排泵和细胞壁通透性可能在氟喹诺酮类药物耐药性上发挥了一定作用。然而,上述两种机制在本研究中均未涉及,后期当聚焦于部分未发生gyrA突变菌株对氧氟沙星耐药的机制进行研究。
