我院制剂室建设的做法和经验
2019-07-11陈大如王立敏孙燕燕张晨皓陈宇洲
李 昂,陈大如,王立敏,孙燕燕,张晨皓,陈宇洲
[1.天津市儿童医院,天津 300134; 2.津润(天津)药业有限公司,天津 300402; 3.天津中医药大学,天津 300193]
近年来,随着国家医改政策的不断推进,公立医疗机构取消药品加成,医疗机构盈亏平衡能力降低。医院制剂因其疗效确切、定价灵活等优势越来越受到各级医疗单位的重视[1]。本院制剂室建成于本世纪初,与现行的法律法规对医疗机构制剂的要求存在一定的差距[2]。本文对本院新制剂室的建设情况进行分析,讨论制剂室建设和改造应注意的关键点,旨在为医疗机构制剂的发展提供一定的参考建议。
1 原有制剂室的现状和问题
本院现有制剂品种43个,剂型14个,包括中西药内服及外用制剂。原制剂室于2006年建设,生产面积约1 800 m2(洁净区面积1 500 m2,一般区面积300 m2),库房面积300 m2,药检室200 m2。存在厂区设计布局不合理、原辅料与成品混用库房、设施老旧、软件管理欠缺等情况,难以达到现行法律、法规要求,严重制约了本院制剂的发展。
2 新制剂室的建设情况
2018年6月—2019年3月,本院与津润(天津)药业有限公司强强合作,共同为本院建设新制剂室。新制剂室坐落在天津新技术产业园区北辰科技工业园津润(天津)药业有限公司厂院内。厂区外东侧为外环线绿化隔离带,西侧为博科林药品包装技术有限公司、南侧为地天泰工业园、北侧是天津职业大学等,周围无污染源,属于适合生产药品的区域。
制剂车间及仓储区域均位于联合厂房内,配套公用设施位于联合厂房及北侧区域,药检室位于办公楼3楼。厂区内生产、行政、生活和辅助区总体布局合理,没有互相妨碍之处。人流从南侧大门进入厂区,物流从东侧大门进入厂区,有效地防止了对药品生产的污染。
新制剂室建筑面积3 944 m2,生产面积2 536 m2(其中洁净区面积2 026 m2,一般区面积510 m2),库房面积980 m2,药检室428 m2。新制剂室的建设参照2010版《药品生产质量管理规范》(2010版GMP)标准建设,达到天津市《医疗机构制剂许可证》验收标准,现将建设过程及体会报道如下。
2.1硬件建设 参照《药品生产质量管理规范》(2010版)、《医疗机构制剂管理规范》(2001版)、《天津市医疗机构制剂室监督检查规范(试行)》(2016版)、《医药洁净工业厂房设计规范》(GB50457-2008)、《中药药品厂工程技术规范》(GB51029-2014)对制剂室进行设计及建设。
2.1.1车间设计布局 在整体车间设计上,主要考虑现有剂型、产能要求及预计未来5~10年的医院制剂发展要求,经过与天津市医药设计院多次协商,确定了最终的设计方案。
医疗机构制剂具有品种繁多、产量相对小、中药与西药制剂、口服与外用制剂共存的特点。传统医院制剂室的建设一般按中、西药分为“中药车间”及“西药车间”。按照《天津市医疗机构制剂室监督检查规范(试行)》中第二十八条规定:“制剂室应按制剂工序合理布局,人、物流分开,一般区和洁净区分开;内服制剂与外用制剂分开;无菌制剂与其他制剂分开;中药制剂与西药制剂分开;配制、分装与贴签包装分开”。以上要求旨在最大限度地降低制剂配制过程中污染、交叉污染以及混淆、差错等风险。
结合儿童制剂的特点,并与相关专业人员对车间布局设计图进行风险分析,认为口服、外用制剂之间产生的污染、交叉污染以及混淆、差错等风险要大于中药制剂与西药制剂之间的风险。所以最终确定制剂车间分为“内服制剂车间”及“外用制剂车间”,并在各车间内使中药制剂与西药制剂区域相对分开。
车间布局除中药制剂与西药制剂相对独立外,同时生产区与辅助区、固体制剂与液体制剂也相对独立,最大限度地降低制剂配制过程中的质量风险。
2.1.2洁净生产区的建设 洁净生产区的建设结合本院制剂产品的实际生产情况,如产能要求、设备大小、人员数量进行建设。墙体彩钢板材质、地面采用PVC卷材。依据GB50016-2014《建筑设计防火规范》(2018年版),本院部分制剂品种生产过程中使用了“火灾危险性甲、乙类物质”,如乙醇、升华硫、苯酚等。结合使用此类物质的工序及单批次用量,最终对部分操作间进行了防爆设计,如下挖1.2 m的防爆实心墙体、轻质泄爆屋顶,安装可燃气体探测器,防静电接地的设计,灯具、开关以及设备的电动机及其控制按钮选用防爆型等。
2.1.3一般生产区(中药提取、粉碎车间)的建设 中药提取、浓缩采用了密闭系统进行操作,并在线清洁,有效防止污染和交叉污染,有良好的排风、水蒸气控制等设施。中药饮片粉碎设置了专用操作间,有独立的通风、除尘设施(设置有排风、除尘机组),满足了环保要求。人员、物料进出及生产操作均参照洁净区管理。
2.1.4库区的建设 新制剂室建设独立、分开的原辅料库、中药饮片库、包装材料库、危险品库及成品库房。所有库房均安装有温度调控设施,使之符合常温库及阴凉库的温湿度要求。为了防止原辅料、包装材料取样时造成污染及交叉污染,在库区设有专门的取样间。该取样间采用独立空调系统、D级净化,有专用人流、物流通道。
2.1.5药检室的建设 新建的药检室利用津润(天津)药业原有化验室改建而成,药检室面积为500 m2(含70.2 m2C级微生物检测室净化间),划分微生物实验室、培养室、理化室、留样室、标化室、精密仪器室、天平室、电热设备室、试剂储备室,对原辅料、内包装材料、中间产品、待包装产品、成品等按照《中国药典》2015年版、《天津市医疗机构制剂规范》2016年版、注册标准进行检测和稳定性考察,与目前新制剂室的配制规模相适应。
2.2质量管理体系的建立
2.2.1制剂室组织机构的建设 重新建立新制剂室的组织机构图(见图1),对制剂室的部分职责重新进行了划分,增加了质量管理组织中QA的职能,保障制剂配制全过程的监督和控制,提高制剂室整个质量管理水平和制剂产品的质量。
2.2.2制剂室文件的建立 按照《天津市医疗机构制剂室监督检查规范(试行)》(2016年版)的要求,制剂室应制定对制剂配制全过程实施有效管理的质量管理体系文件。本院制剂室文件分为管理文件、操作规程、技术标准和记录文件,所有文件的制定按照制剂配制全过程的实际管理情况和实际操作流程,确保质量管理体系能够有效运行。管理文件共起草了93个,包括文件管理、机构与人员管理、设备管理、厂房设施管理、物资管理、卫生管理、配制管理、质量保证管理和质量控制管理;操作规程起草了197个,包括岗位职责、环境监测、取样方法、检验方法、仪器操作、设备操作、清洁、维护等操作规程;技术标准起草了206个,包括制剂、中药材、物料质量标准和工艺规程。
2.2.3验证体系的建立与实施 根据《天津市医疗机构制剂室监督检查规范(试行)》(2016年版)的要求,新制剂室验收需要完成配制环境、工艺用水和主要设施设备的验证。本院新制剂室的验证参考《药品生产质量管理规范》(2010年版)中的要求,对使用的纯化水系统、洁净厂房和空调净化系统、药用压缩空气系统及生产用关键设备进行了验证。验证中分别从设计确认、安装确认、运行确认和性能确认四个方面对新制剂室配制环境、工艺用水等设计、安装、操作和性能进行了全面的确认,以确保本院制剂产品的配制环境符合国家法规要求,制剂产品使用的工艺用水、工艺用气满足相关规定。另外,制剂配制过程中使用到的设备也进行了安装、运行及性能的确认,以确保其符合工艺要求,从而为制剂产品的配制及质量提供了有力保证。
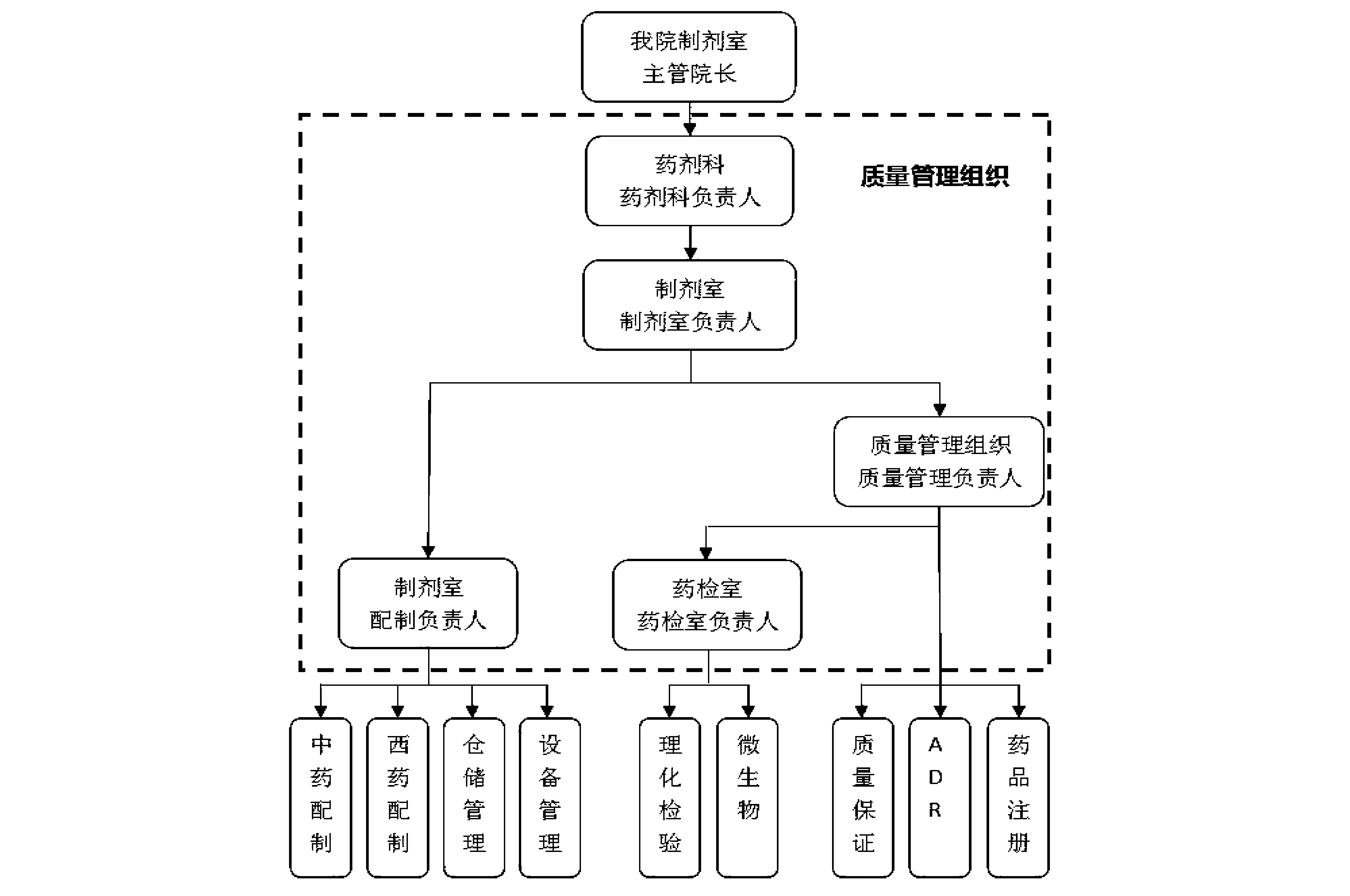
图1 制剂室组织机构图
2.2.4人员培训管理 在新制剂室建设过程中,按照《培训教育管理规程》中的要求,制定2019年度制剂室培训计划,组织员工进行《天津市医疗机构制剂室监督检查规范(试行)》(2016年版)、验证基础知识、新制剂室管理文件以及各岗位的岗位职责和岗位SOP等相关内容的培训。
制剂室的建设要具有前瞻性,从设备选型、生产区域的预留,均要考虑未来5~10年的发展趋势[3]。制剂室硬件改造的同时需要升级软件系统,如根据设备的更新,同时完成新的工艺规程和生产记录,主要设备设施的运行、维修记录等。欧美发达国家没有类似我国医疗机构制剂的药品形式,我国医院制剂室多为20世纪90年代大力发展医院制剂时建成[4]。而随着制药技术和设备的升级,对制剂室工作人员的要求也越来越高,加强新技术、知识、法规的继续教育,发现现有不足,并进行针对性的改进,实现医院制剂的可持续发展。
