HDGF、NET- 1、HDAC 1在肺癌患者肺癌组织中的表达及临床意义
2019-07-09王少青张玉萍许枫黄春雷代先慧青岛市城阳区人民医院呼吸内科山东青岛66000
王少青,张玉萍,许枫,黄春雷,代先慧#青岛市城阳区人民医院呼吸内科,山东 青岛66000
2青岛市肿瘤医院放疗科,山东 青岛2660000
肺癌作为威胁人类生命健康的常见恶性肿瘤之一,在男性和女性肿瘤中的发病率分别居第1位和第3位[1],肺癌的病死率在全球范围内肿瘤中居第1位,尤其在中国,肺癌的病死率呈逐年升高趋势。随着医学技术的不断发展,放化疗等治疗能够改善肺癌患者的生存情况,但是患者的5年生存率仍未超过20%[2]。肺癌的发生是由多种因素综合作用的,其中肿瘤细胞增殖在其中发挥重要作用[3]。近年来,随着分子生物学技术的不断发展,研究者倾向于从分子生物学机制中探索肺癌的发生及发展过程,从而改善肺癌患者的生活质量,提高患者的远期生存率[4-5]。相关研究表明,肝癌衍生生长因子(hepatoma-derived growth factor,HDGF)与肺癌的发生、发展密切相关[6];NET-1是四聚体超家族成员之一,主要参与细胞的黏附、增殖及分化等,与恶性肿瘤细胞的增殖密切相关[7];组蛋白去乙酰化酶1(histone deacetylases 1,HDAC1)是哺乳动物的第1个组蛋白去乙酰化酶,在组蛋白乙酰化水平的调控过程中发挥重要作用[8]。本文探讨了肺癌患者肺癌组织中HDGF、NET-1和HDAC1的表达水平及其与肺癌患者临床特征的关系,旨在为肺癌的治疗提供新的靶点。
1 资料与方法
1.1 一般资料
选取2015年3月至2016年12月青岛市城阳区人民医院收治的肺癌患者。纳入标准:①经组织病理学检查确诊,并经过计算机断层扫描(computed tomography,CT)及B超辅助诊断;②接受根治性手术治疗;③病历资料完整。排除标准:①合并心、肺、肾等重大脏器病变者;②精神、意识障碍者;③处于特殊时期,如妊娠期或哺乳期;④术前接受放化疗者;⑤术后生存时间小于3个月者。根据纳入和排除标准,本研究共选取肺癌患者126例。其中,男82例,女44例;年龄30~76岁,平均(59.62±3.27)岁;≥60岁68例,<60岁58例;有吸烟史59例,无吸烟史67例;病理分型:腺癌43例,鳞癌55例,小细胞癌28例;分化程度:高中分化51例,低分化75例;TNM分期:Ⅰ期45例,Ⅱ期29例,Ⅲ期28例,Ⅵ期24例;有远处转移62例,无远处转移64例;有血管浸润41例,无血管浸润85例。收集肺癌患者的肺癌组织标本和对应的癌旁正常组织(距肿瘤组织2 cm以上)标本各126例。
1.2 主要试剂与仪器
兔抗人HDGF多克隆抗体、兔抗人NET-1多克隆抗体及兔抗人HDAC1多克隆抗体均购自北京博奥森生物技术有限公司,链霉素抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)免疫组织化学染色试剂盒和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒均购自北京中杉金桥生物技术有限公司;DMI6000B型Leica全自动显微镜购自德国徕卡公司。
1.3 免疫组织化学染色
取肺癌组织标本和癌旁正常组织标本,置于4%的甲醛溶液中固定,常规脱水后使用石蜡进行包埋和切片,采用免疫组织化学SP法进行染色。首先,将石蜡标本切成4 μm的连续切片,并平铺在3-氨丙基-3-乙氧基甲硅烷处理过的载玻片上,于60℃烤箱中加热4 h,进行常规脱蜡,滴加30 ml 3%双氧水孵育10 min,从而消除内源性过氧化物酶的活性;使用蒸馏水漂洗样本,置于磷酸盐缓冲液(phosphate buffer saline,PBS)中,加热修复抗原;在标本中加入5%的正常山羊血清,在37℃下封闭10 min,然后滴加HDGF多克隆抗体(1∶12 500)、NET-1多克隆抗体(1∶20)和HDAC1多克隆抗体(1∶100),37℃条件下,在湿盒中孵育1 h,接着使用PBS漂洗;使用链霉素抗生物素蛋白-过氧化酶孵育10 min,PBS漂洗10 min。使用色源底物溶液孵育10 min,再用蒸馏水漂洗;使用DAB显色,再用苏木精复染,最后进行常规脱水、透明和封片。
1.4 观察指标及判定标准[2,7-8]
比较肺癌组织和癌旁组织中HDGF、NET-1和HDAC1的表达水平,并对HDGF、NET-1、HDAC1表达水平与肺癌患者临床特征的关系进行分析;分析肺癌组织中HDGF、NET-1、HDAC1表达与肺癌患者TNM分型、分化程度及远处转移情况的相关性,以及肺癌患者肺癌组织中HDGF、NET-1、HDAC1表达的相关性。
免疫组织化学染色结果判定:HDGF以细胞核呈棕黄色或黄色颗粒分布为阳性表达,NET-1以细胞质或细胞膜呈棕黄色或黄色颗粒分布为阳性表达,HDAC1以细胞核呈棕黄色或黄色颗粒分布为阳性表达。由两名经验丰富的病理科医师在高倍镜(×400)下随机选择每个切片中的10个不重复视野进行阅片。采用半定量计分法计算肿瘤细胞的染色强度和阳性细胞所占比例。染色强度:1分,淡黄色;2分,黄色;3分,棕黄色。阳性细胞所占比例:0分,≤5%;1分,6%~25%;2分,26%~50%;3分,51%~75%;4分,≥76%。以两项评分的乘积为评价标准:0分,为阴性(-);1~4分,为弱阳性(+);5~8分,为中等阳性(++);9~12分,为强阳性(+++)。本研究以(+)~(+++)作为阳性表达,(-)作为阴性表达。
1.5 统计学方法
采用SPSS 19.0统计软件对数据进行分析。计数资料以例数和率(%)表示,组间比较采用χ2检验;计量资料以均数±标准差(±s)表示;采用Spearman等级分析进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HDGF、NET- 1和HDAC 1阳性表达率的比较
肺癌组织中HDGF、NET-1和HDAC1的阳性表达率均明显高于癌旁正常组织,差异均有统计学意义(P<0.01)。(表1)
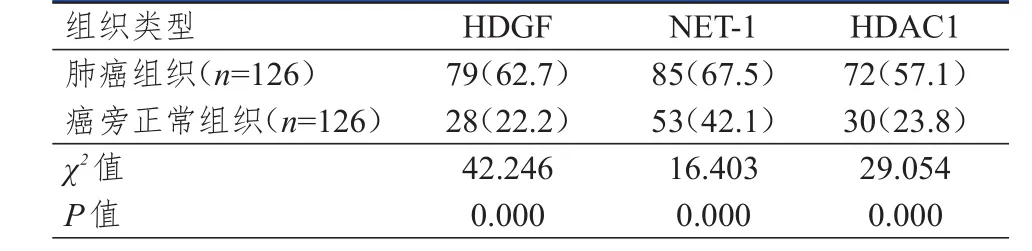
表1 不同组织中HDGF、NET- 1和HDAC 1阳性表达情况的比较[ n(%)]
2.2 肺癌组织中HDGF、NET- 1和HDAC 1的阳性表达情况与肺癌患者临床特征的关系
吸烟、分化程度为高中分化、TNM分期为Ⅲ~Ⅵ期、有远处转移肺癌患者肺癌组织中HDGF、NET-1、HDAC1的阳性表达率均明显高于未吸烟、分化程度为低分化、TNM分期为Ⅰ~Ⅱ期、无远处转移肺癌患者,差异均有统计学意义(χ2HDGF=8.740、17.117、7.660、19.967,PHDGF<0.01;χ2NET-1=12.286、16.846、14.681、14.975,PNET-1<0.01;χ2HDAC1=6.909、15.856、20.181、17.362,PHDAC1<0.01)。不同性别、年龄、病理分型、血管浸润情况肺癌患者肺癌组织中HDGF、NET-1和HDAC1的阳性表达率比较,差异均无统计学意义(P>0.05)。(表2)
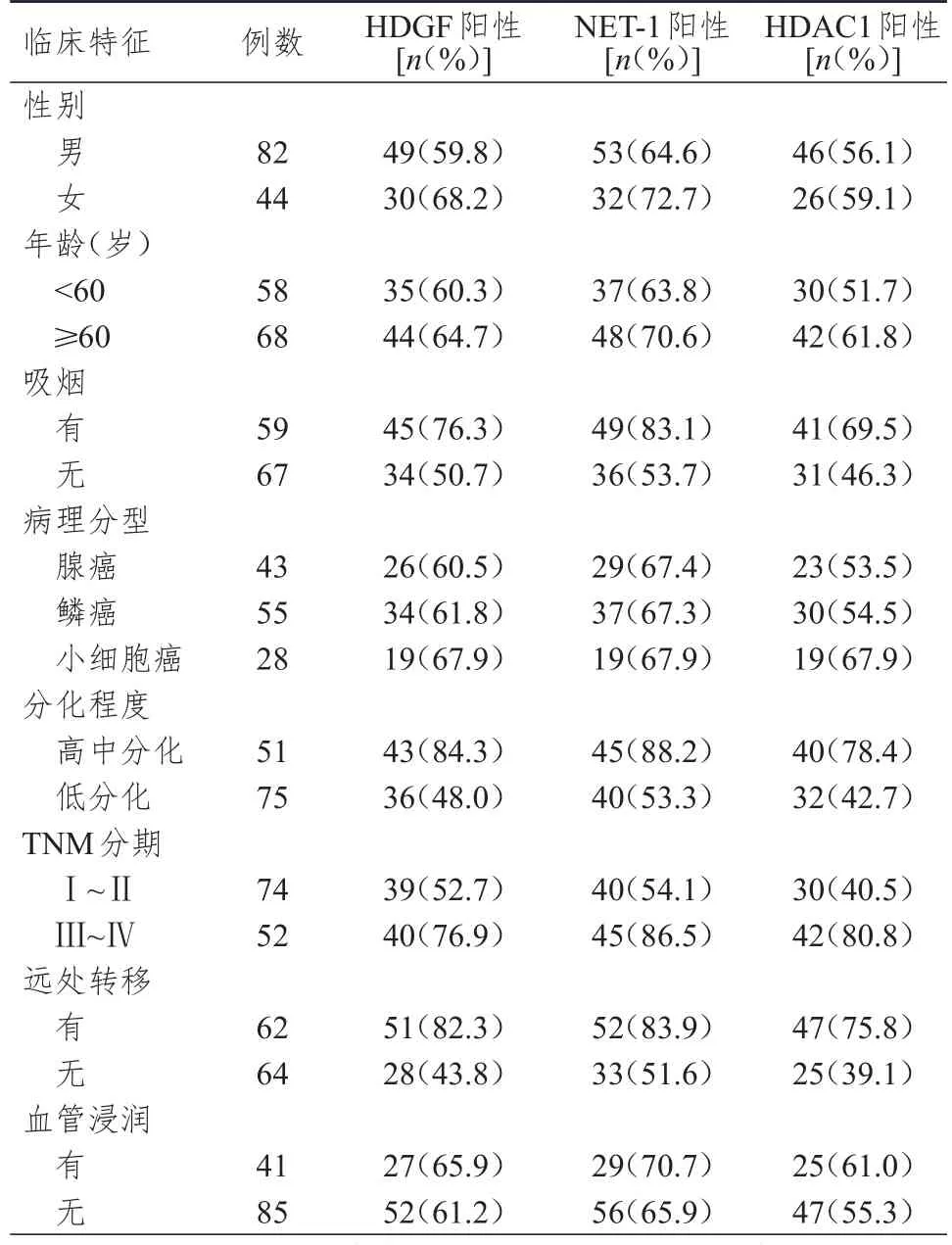
表2 不同临床特征肺癌患者肺癌组织中HDGF、NET- 1和HDAC 1的阳性表达情况
2.3 肺癌组织中HDGF、NET- 1和HDAC 1的阳性表达率与肺癌发展的相关性分析
Spearman等级分析结果显示:肺癌组织中HDGF的阳性表达率与肺癌患者的TNM分期、分化程度及远处转移情况均呈正相关(r=0.708、0.689、0.719,P<0.05);肺癌组织中NET-1的阳性表达率与肺癌患者的TNM分期、分化程度及远处转移情况均呈正相关(r=0.717、0.705、0.698,P<0.05);肺癌组织中HDAC1的阳性表达率与肺癌患者的TNM分期、分化程度及远处转移情况均呈正相关(r=0.702、0.721、0.729,P<0.05)。
2.4 肺癌组织中HDGF、NET- 1和HDAC 1阳性表达率的相关性分析
Spearman相关性分析结果显示:肺癌组织中HDGF的阳性表达率与NET-1和HDAC1的阳性表达率呈正相关(r=0.698、0.727,P<0.05);肺癌组织中NET-1的阳性表达率与HDAC1的阳性表达率呈正相关(r=0.709,P=0.033)。
3 讨论
癌基因和抑癌基因表达水平异常时,可能导致细胞增殖的转录基因异常表达,使细胞的分化和增殖过程发生异常,细胞间信号转导异常使得细胞增殖周期发生变化,甚至凋亡程序消失[9]。HDGF最初是由Nakamura在1994年从HuH7肺癌细胞系培养液中分离出来的肽类物质,HDGF在多种类型肿瘤中的表达水平异常升高,如肺癌、食管癌、胰腺癌等,并且与肿瘤的转移及预后密切相关[10]。HDGF由240个氨基酸残基组成,包括6个外显子和5个内含子,定位于1q21-q23,主要存在于细胞核内,通过PWWP结构域与DNA结合发挥功能转录因子的功能[2]。随着对HDGF的深入研究,发现其广泛存在于正常组织和肿瘤组织中,在细胞增殖、血管生成、胚胎发育及细胞凋亡过程中发挥重要作用,而且HDGF的表达具有时相性,主要在器官发育早期表达,细胞分化程度越高,其表达水平越高,HDGF既可以在细胞质中表达,又可以在细胞核中表达[11]。四聚体超家族含有4个疏水性跨膜结构域的蛋白,构成细胞外两个环状结构,氨基和羧基位于细胞质内,各分子间的序列高度保守,并且跨膜区域内包括大部分的同源序列,NET-1作为4个跨膜区域蛋白超家族成员之一,是一种肿瘤增殖相关蛋白,定位于1p34.1,mRNA全长为1297 bp,开放阅读框包括241个氨基酸,参与细胞信号的转导及细胞的黏附、增殖、分化过程,NET-1在恶性肿瘤的表达水平异常升高,如肝癌、肺癌、肾癌、胰腺癌等[12]。组蛋白的修饰过程包括乙酰化、磷酸化和甲基化,乙酰化是影响基因转录的重要机制,而组蛋白的乙酰化过程受HDAC的调节[8],组蛋白的乙酰化和去乙酰化对肿瘤的发生、发展具有重要作用,HDAC共有4种类型,主要通过修饰组蛋白调节基因或转录因子表达,HDAC1属于Ⅰ型HDAC,是第1个与哺乳动物相关的组蛋白去乙酰化酶,包括482个氨基酸[7,13]。
本研究对肺癌组织与癌旁正常组织中HDGF、NET-1和HDAC1的表达水平进行检测,结果发现,肺癌组织中HDGF、NET-1、HDAC1的阳性表达率均明显高于癌旁正常组织(P<0.01),提示HDGF、NET-1和HDAC1可能作为诊断肺癌的有效生物学指标。同时本研究还发现,不同吸烟史、分化程度、TNM分期及远处转移情况肺癌患者肺癌组织中HDGF、NET-1、HDAC1的阳性表达率比较,差异均有统计学意义(P<0.01),并且HDGF、NET-1、HDAC1的阳性表达率均与肺癌患者的TNM分期、分化程度及远处转移情况呈正相关(P<0.05),表明HDGF、NET-1和HDAC1与肺癌的发生、发展关系密切。HDGF能够通过加速胚胎细胞、内皮细胞、血管平滑肌细胞的增殖和生长速度,提高内皮细胞和血管平滑肌细胞的迁移速度,促进新血管生成[14]。NET-1与细胞黏附因子协同作用影响黏附依赖性下游信号,激活酪氨酸激酶的磷酸化,加速细胞的分裂,同时减缓细胞凋亡速度[15]。HDAC1与多种影响细胞分化、增殖的转录因子直接作用,敲除HDAC1的细胞增殖活性下降,凋亡过程减慢,是由于HDAC1影响分子复合物的结构完整性和功能性,最终影响肺癌细胞的增殖和凋亡过程[16]。另外HDAC1调控周期蛋白依赖性激酶的表达水平,同时使肿瘤细胞的增殖活动停止在G1期,阻滞肿瘤细胞的凋亡,干扰肺癌细胞中下调信号相关蛋白ErbB2的表达和细胞外信号调节激酶1的活性,并且降低端粒酶活性[17]。吸烟导致肺癌的发生,主要是因为吸烟过程中烟草产生大量的致癌或促癌物质,导致肺癌的发生及发展,从而提高相关蛋白的表达水平[5]。本研究对上述3种指标的相关性进行研究,结果发现肺癌组织中HDGF、NET-1和HDAC1的阳性表达率间均呈正相关(P<0.05),推测主要是由于上述3种指标通过影响肿瘤细胞的增殖和血管生成过程而相互影响。
综上所述,肺癌组织中HDGF、NET-1和HDAC1的阳性表达率异常升高,并且与肺癌的发展密切相关,同时应戒烟以预防或减缓肺癌进展,HDGF、NET-1和HDAC1 3种分子生物学指标的临床意义重大,值得临床推广应用。
