铁苋菜不同极性萃取物的抗氧化及抑菌活性研究
2019-07-09尹显楼詹济华
尹显楼 詹济华 谭 洋 裴 刚 李 玲
(1. 湖南中医药大学药学院,湖南 长沙 410208;2. 衡阳市中心医院药剂科,湖南 衡阳 421001)
铁苋菜别名海蚌含珠,为大戟科铁苋菜属草本植物,广布于中国南方各地区,其嫩叶可以食用,为当地民间野菜品种之一[1]。据报道,铁苋菜主要化学成分有萜类、酚酸、黄酮和生物碱类[2],具有清热解毒、止痢、止血之功效[3],其中萜类、甾醇类活性成分[4]主要集中于石油醚萃取物,酚酸、黄酮类活性成分[5-6]主要存在于氯仿和乙酸乙酯萃取物,极性较大的正丁萃取物具有较多糖苷类活性成分。目前对铁苋菜的研究[7-9]主要集中在其多糖和总黄酮的抗氧化以及总黄酮抑菌活性方面,对铁苋菜酚酸类活性成分系统分离研究比较缺乏。如王春景等[10]试验仅考察铁苋菜中甲醇、70%乙醇等极性较大溶剂提取物的抗氧化和抑菌效果,并未对其中具体的抗氧化和抑菌主要活性成分进行进一步系统分离。
本试验拟以铁苋菜为原料,采取乙醇回流提取、系统梯度萃取法得到石油醚相、氯仿相、乙酸乙酯相、正丁醇相和水相5个不同极性萃取物,测定铁苋菜各萃取物的总酚酸含量,分析铁苋菜不同极性萃取物清除DPPH自由基和NO自由基的能力与抑制β-胡萝卜素漂白能力及抑菌活性,为铁苋菜在食品天然抗氧化剂和抑菌剂方面的研究开发提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
铁苋菜:采于湖南临武县,无病虫害;
VC:美国Sigma公司;
1,1-二苯基-2-三硝基苯肼(DPPH)、β-胡萝卜素:上海梯希爱化成工业发展公司;
Gries试剂(0.1%α-萘胺和2%磷酸的水溶液、1%对氨基苯酸):天津市光复经济化工研究所;
亚油酸、吐温-80、硝普钠:国药集团化学制剂有限公司;
磷钼钨酸试液:厦门海标科技有限公司;
乙醇、石油醚、氯仿、乙酸乙酯、正丁醇:分析纯,恒兴化学试剂制造有限公司。
1.1.2 试验菌种
大肠杆菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonasaeruginosa)、幽门螺杆菌(Helicobacterpylori)、表皮葡萄球菌(Staphylococcusepidermidis)、枯草芽孢杆菌(Bacillussubtilis)、藤黄微球菌(Micrococcusluteus)、金黄色葡萄球菌(Staphylococcusaureus):湖南中医药大学医学基础微生物与免疫学教学中心提供。
1.1.3 主要仪器
电子分析天平:ES-320型,美国德安特公司;
真空干燥箱:DZF-6050AB型,北京中兴伟业仪器有限公司;
旋转蒸发仪:N-1300型,上海爱朗仪器有限公司;
超净工作台:SW-CJ-1F型,郑州宏朗仪器设备有限公司;
酶标仪:DNM-9602型,北京普朗新技术有限公司;
生化培养箱:SHH-150L型,重庆四达仪器有限公司;
紫外可见分光光度计:UV1800PC型,上海奥析科学仪器有限公司。
1.2 方法
1.2.1 铁苋菜不同极性萃取物的制备 称取干燥的铁苋菜地上部分10 kg,粉碎后过40目筛,用70%乙醇回流提取3次,每次2 h,过滤合并滤液,于60 ℃减压旋转蒸发溶剂,得到铁苋菜固体浸膏415.40 g,用水搅散摇匀,先用石油醚萃取除去色素、油脂等弱极性物质,再用氯仿、乙酸乙酯和正丁醇等溶剂按体积1∶2的比例来依次萃取,减压蒸发溶剂干燥,依次得到石油醚相73.00 g、氯仿相6.20 g、乙酸乙酯相9.20 g、正丁醇相57.25 g和水相148.60 g,各相浸膏置于4 ℃冰箱冷藏备用。按式(1)计算各不同萃取物浸膏的提取率,每个部位结果平行测定3次,取平均值。
(1)
式中:
T——各部位浸膏的提取率,%;
Wm——各部位浸膏的重量,g;
Wn——乙醇提取物的重量,为415.40 g。
1.2.2 总酚酸含量测定 采用Folin-Ciocalteu法[11-13]。
(1) 标准曲线的绘制:精密移取0,0.10,0.20,0.30,0.60,0.90,1.20,1.50 mL的没食子酸对照品溶液(0.1 mg/mL),分别置于25 mL容量瓶中,精密加入0.50 mL 磷钼钨酸试液,再精密加入14.00,13.90,13.80,13.70,13.40,13.10,12.80,12.50 mL蒸馏水,摇匀,再用27%碳酸钠溶液定容至刻度线,摇匀,避光放置60 min,以相应空白试剂做空白,在760 nm处测定吸光度值,绘制标准曲线(曲线方程:Y=0.128X+0.116 1,R2=0.997 1),如图1所示。结果表明在0.4~6.0 μg/mL的范围内具有良好的线性关系,该方程可用于铁苋菜中总酚酸含量的测定。总酚酸含量用每克萃取物中含有的没食子酸毫克数表示。
(2) 样品总酚酸含量的测定:将样品溶液稀释一定的倍数,按照1.2.2(1)显色,得到吸光度值,并代入标准曲线方程计算总酚酸含量。
1.2.3 供试液的制备 精密称取铁苋菜石油醚、氯仿、乙酸乙酯和正丁醇萃取物和VC各20 mg,先用70%乙醇溶液将各样品定容至2.0 mg/mL,再用二倍稀释法配成浓度为2.000 0,1.000 0,0.500 0,0.250 0,0.125 0,0.062 5 mg/mL的供试液,再用70%乙醇溶液配置成0.004%的DPPH储备液,避光保存备用。
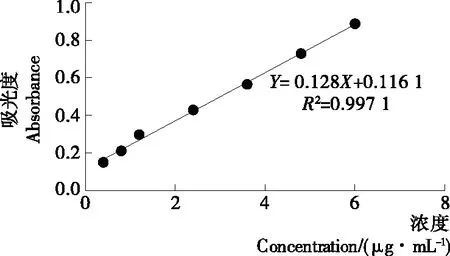
图1 铁苋菜总酚酸标准曲线图
1.2.4 清除DPPH自由基法 参考文献[14]修改如下:将50 μL供试液及250 μL DPPH储备液加入到同一微孔中,摇匀,室温避光反应30 min,用酶标仪于517 nm处测定吸光度C1,同时测定250 μL DPPH储备液与50 μL 70%乙醇溶液混合后的吸光度C0,以及50 μL供试液与250 μL 70%乙醇溶液混合后的吸光度C2,以VC溶液作阳性对照,按式(2)计算清除率。
(2)
式中:
I——DPPH自由基清除率,%;
C1——供试品组吸光度值;
C2——空白组吸光度值;
C0——对照组吸光度值。
1.2.5β-胡萝卜素漂白法 根据文献[15],精密称取4.0 mgβ-胡萝卜素、40.0 mg亚油酸和400.0 mg Tween-80,混合后用5.0 mL氯仿溶解,于50 ℃减压旋转蒸干氯仿,再添加200 mL蒸馏水超声即得乳液。分别取上述30 μL 供试液,对照组加入300 μL乳液,空白组中300 μL乳液不添加β-胡萝卜素,以VC作阳性对照,50 ℃水浴反应60 min后,用酶标仪测定样品在490 nm下0 min时和60 min时的吸光度值。按式(3)计算抑制率。
(3)
式中:
M——β-胡萝卜素抑制率,%;
A60(对)——60 min时对照组吸光度值;
A60(空)——60 min时空白组吸光度值;
A0(对)——0 min时对照组吸光度值;
A0(空)——0 min时空白组吸光度值。
1.2.6 清除NO自由基法 根据文献[15],分别取上述的80 μL硝普钠溶液,供试品组加入120 μL供试液,空白组以不加供试液作空白,29 ℃光照3 h,加Gries试剂50 μL,反应0.5 h,用酶标仪测定样品在490 nm下的吸光度值,以VC为阳性对照,每组试验重复3次,取平均值。按式(4)计算清除率。
(4)
式中:
N——NO自由基清除率,%;
A1——供试品组吸光度值;
A2——空白组吸光度值。
1.2.7 体外抑菌试验
(1) 菌株的活化和制备:将表皮葡萄球菌、铜绿假单胞菌、藤黄微球菌等7种菌株接种在10 mL营养肉汤中进行活化(布氏肉汤中接种幽门螺杆菌),于培养箱中37 ℃ 恒温培养24 h,幽门螺杆菌在微需氧条件下培养24 h[16]。菌落长出后,在超净工作台内挑取适量活化后的细菌接种于肉汤中,振荡混匀,幽门螺杆菌用布氏肉汤进行稀释,其他6种菌株则以营养肉汤稀释,调整细菌浓度为108CFU/mL,制备得到细菌悬液。
(2) 最小抑菌浓度(MIC)的测定:参考文献[17]修改如下:试验设空白组、样品组和阳性对照组,指示菌为幽门螺杆菌样品组,以阿莫西林和甲硝唑为阳性对照,其他6种菌株均以阿莫西林和头孢拉定为阳性对照药。空白组加入100 μL液体培养基。样品组每孔加入100 μL细菌悬液和适量的各萃取物浓度为100 mg/mL的供试液,阳性对照组加入浓度均为20 mg/mL阿莫西林、头孢拉定和甲硝唑,以2倍稀释法对各孔进行逐步稀释,每个浓度平行3个复孔,使得样品终浓度为10.000 0,5.000 0,2.500 0,1.250 0,0.625 0,0.312 5 mg/mL。阳性对照组终浓度为2.000 0,1.000 0,0.500 0,0.250 0,0.125 0,0.062 5 mg/mL。加样完成后,用酶标仪测定在450 nm下的光密度值(OD)。然后将微孔板放置在温度37 ℃、5% CO2培养箱中培养24 h。幽门螺杆菌的微孔板和蜡烛缸一同放入培养箱中培养48 h,之后用酶标仪测定在450 nm下的OD值,按式(5)计算供试药抑菌OD值。
(5)
式中:
C——供试药的抑菌率,%;
m2——培养后加药OD值;
m1——培养后空白OD值;
n2——培养前加药OD值;
n1——培养前空白OD值。
供试药抑菌OD值越大,表明该药物抑菌效果越小。以空白孔为对照,并结合倒置显微镜观察,以不发生混浊变化,且供试药OD值不高于空白孔的OD值的最高药物稀释倍数为该药物的MIC值。
2 结果与分析
2.1 醇提物及其不同极性萃取物得率、总酚酸含量
如表1所示,由于溶剂的极性不同对萃取物的得率、成分均有较大的影响,其中石油醚相、正丁醇相、水相的提取率较高(分别为17.57%,13.78%,35.77%)。总酚酸含量从小到大排序为石油醚相<氯仿相<水相<正丁醇相<乙醇提取物<乙酸乙酯相,其中乙酸乙酯萃取物的总酚酸含量高达232.36 mg/g。
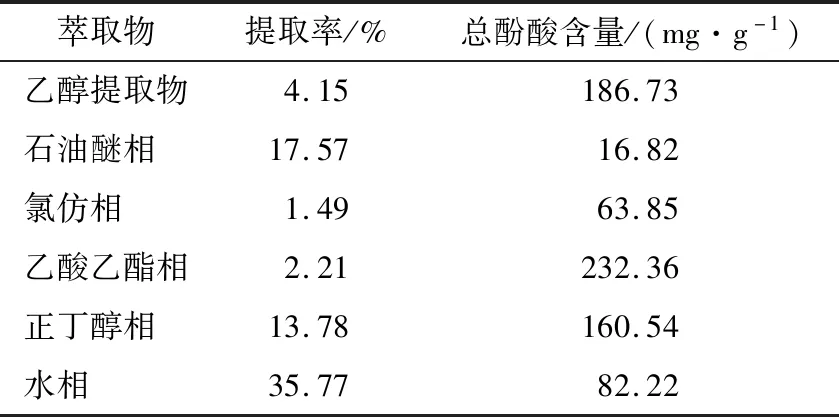
表1 不同极性萃取物的提取率和总酚酸含量
2.2 体外抗氧化试验
2.2.1 清除DPPH自由基能力 由图2可知,铁苋菜不同极性萃取物对DPPH自由基均具有较好的清除效果;在0.05~2.0 mg/mL时,各萃取物的清除率呈剂量依赖性。在浓度为2.0 mg/mL,其清除率为正丁醇部位(94.60%)>乙酸乙酯部位(87.92%)>氯仿部位(74.15%)>石油醚部位(48.47%),而阳性对照药VC的清除率为(95.08%),表明正丁醇萃取物的抗氧化效果最好,并且抗氧化能力与VC相当。
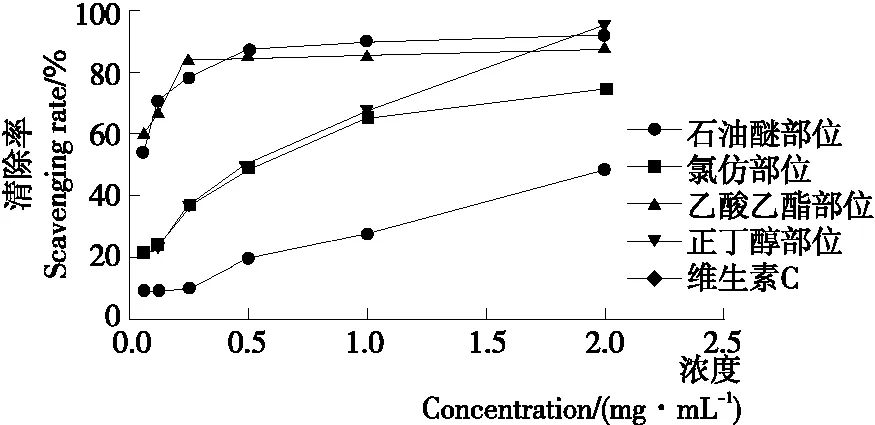
图2 铁苋菜不同极性萃取物和VC的DPPH
Figure 2 DPPH radical scavenging rate of of different polar extracts fromAcalyphaaustralisL. and VC
2.2.2 抑制β-胡萝卜素漂白反应 由图3可知,铁苋菜不同极性萃取物均具有较好的抑制β-胡萝卜素漂白的效果;在0.05~2.0 mg/mL时,随着浓度上升,铁苋菜各萃取物对β-胡萝卜素氧化逐渐増强。当浓度达到2.0 mg/mL时,对β-胡萝卜素氧化抑制率为正丁醇部位(83.15%)>氯仿部位(78.36%)>乙酸乙酯部位(68.94%)>石油醚部位(68.74%),均比阳性对照药VC(44.51%)的抑制率高,其中正丁醇部位抑制β-胡萝卜素漂白的效果最好。表明在一定的浓度范围内,铁苋菜各萃取物具有较好的抑制β-胡萝卜素漂白反应的效果。
2.2.3 清除NO自由基能力 据图4可知,在0.05~2.0 mg/mL 时,铁苋菜不同极性萃取物对NO自由基的清除率与浓度呈正相关;当浓度达到2.0 mg/mL时,不同极性萃取物对NO自由基清除率为乙酸乙酯部位(82.72%)>石油醚部位(82.49%)>正丁醇部位(81.49%)>氯仿部位(79.18%),均弱于阳性对照药VC(92.00%),各萃取物清除NO自由基能力相当。结果表明在一定的浓度范围内,铁苋菜各萃取物均具有较好的清除NO自由基能力。
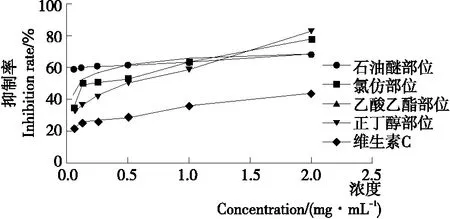
图3 铁苋菜不同极性萃取物和VC的β-胡萝卜素漂白抑制率
Figure 3 Inhibition ofβ-carotene oxidation by different polar extracts fromAcalyphaaustralisL. and VC
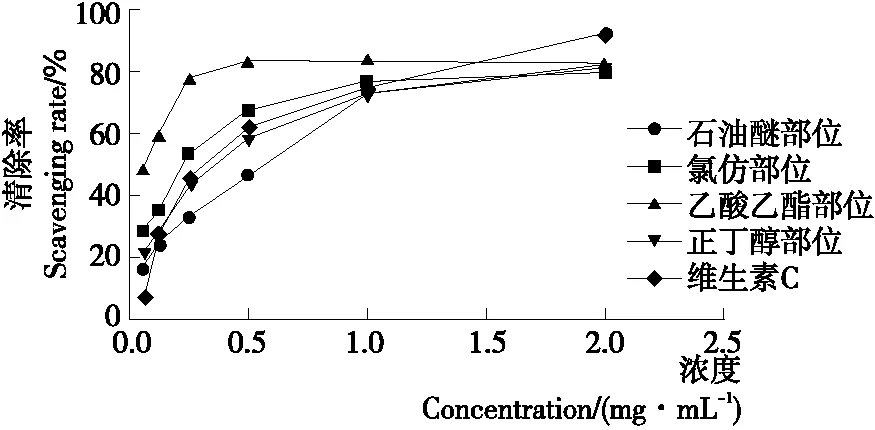
图4 铁苋菜不同极性萃取物和VC的NO自由基清除率
Figure 4 Nitric oxide radical scavenging rate of different polar extracts fromAcalyphaaustralisL. and VC
2.3 体外抑菌试验
由表2可知,铁苋菜各萃取部位对所选7种细菌均具有不同程度的抑制效果,并且对不同细菌的MIC值也不同,其中对革兰氏阳性菌抑菌效果比革兰氏阴性菌效果要好。石油醚部位、氯仿部位和正丁醇部位对枯草芽孢杆菌和藤黄微球菌抑菌效果较强。特别是石油醚部位对大肠杆菌、表皮葡萄球菌和金黄色葡萄球菌抑制作用最佳,MIC值分别为0.625 0,0.312 5,1.250 0 mg/mL,可以通过柱层析硅胶、凝胶等方法来进一步分离纯化石油醚萃取部位,筛选出明确有效的抑菌活性成分。
3 结论
经上述试验可知,铁苋菜乙醇提取物及各萃取物都含有总酚酸,各萃取物均具有较强的清除DPPH、NO自由基能力和抑制β-胡萝卜素漂白的能力。正丁醇萃取物和乙酸乙酯萃取物抗氧化效果较为显著,可能与其较高的总酚酸含量有关[18-19],表明各萃取物中总酚酸含量与抗氧化能力呈正相关。体外抑菌活性筛选显示,铁苋菜各萃取物均有较好的抑菌活性,尤其是石油醚部位对大肠杆菌、表皮葡萄球菌和金黄色葡萄球菌抑菌效果最为显著。经查阅文献[20]发现,铁苋菜石油醚萃取物含有大量的三萜类和甾体类化学成分,可能是其抑菌有效活性成分。本试验系统地研究了铁苋菜不同极性萃取物的抗氧化和抑菌活性,对铁苋菜主要活性成分进行进一步富集,并对各萃取物的抗氧化和抑菌活性系列数据进行了补充,为后续能够通过柱层析等方法靶向分离抗氧化和抑菌活性化合物做前期准备。下一步将对铁苋菜乙酸乙酯萃取物和石油醚萃取物做更深入的分离纯化,以得到明确的抗氧化和抑菌活性化合物。
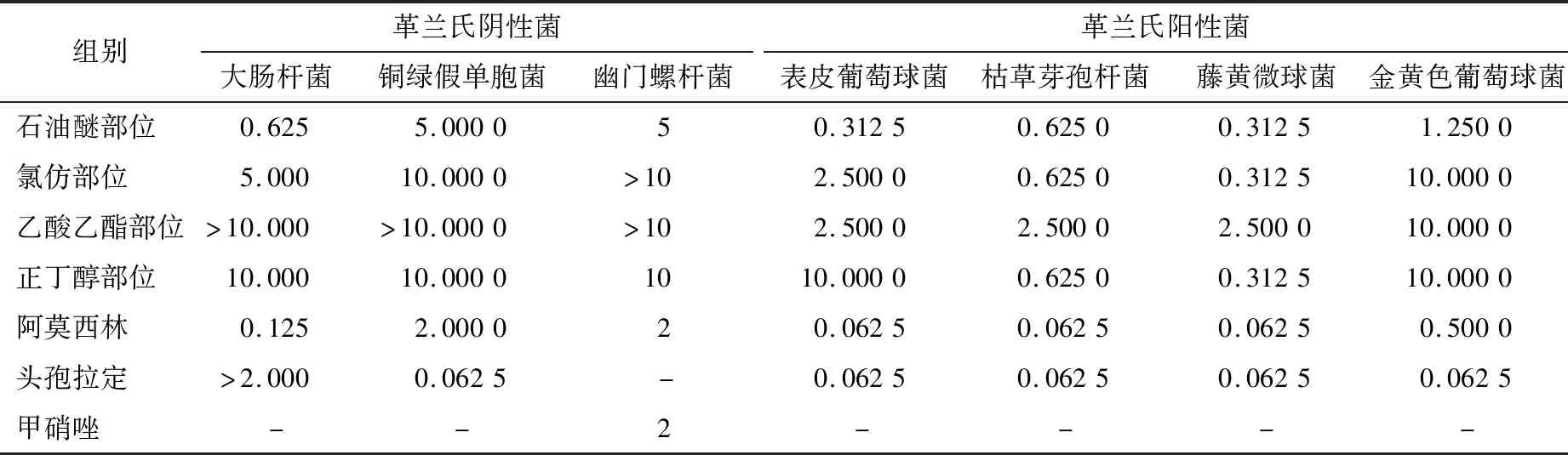
表2 铁苋菜不同极性萃取物MIC†
† “-”表示未进行试验。
