膳食结构对人体肠道微生物代谢的影响
2019-07-09姚乐辉
姚乐辉
(许昌学院体育学院,河南 许昌 461000)
肠道对人们的健康非常关键。随着分子生物技术的逐渐发展,发现了越来越多无法培养的微生物,肠道微生物的构成与功能一般会随宿主的基因、饮食以及环境等的改变而改变[1-2]。现阶段认为影响人体肠道微生物变化的原因有很多方面,尽管遗传因素能够决定个体肠道微生物的定殖,然而环境与生活方式,特别是膳食结构的变化成为影响人体肠道微生态的主要因素[3-4]。人体肠道微生物利用形成的酶消化营养物质,以及形成的代谢产物影响着人们的身体健康,而身体提供的营养物质、类型以及数量也会对肠道微生物代谢产生很大的影响[5-6]。
近年来由于中国人群膳食结构的变化出现部分慢性非传染性疾病[7]。尽管膳食仅为生活方式中的一种因素,但对人们的身体健康起到非常关键的作用。相关研究学者对不同膳食结构对肠道微生物代谢影响进行了研究,谢佳琦等[8]对膳食脂肪对肠道微生物的影响进行研究,分析了膳食中脂肪对微生物代谢的影响,但是未对人体血糖变化及具体微生物变化情况进行具体研究,研究的全面性不足。张烽等[9]对膳食营养与人体肠道微生物组之间关系进行研究,只考虑了营养成分对人体肠道微生物的数量的变化,但未对微生物代谢状况进行研究。本试验拟研究不同膳食结构对人体肠道微生物代谢影响,分析人体血糖、体重及相关微生物的变化情况,并分析具体原因。
1 材料与方法
1.1 试剂与仪器
琼脂糖凝胶:100 g,上海翊圣生物科技有限公司;
超微量分光光度计:NanoDrop 2000/2000C型,北京金业德祥科技有限公司;
ABIGeneAmp PCR仪:9700型,上海艾研生物科技有限公司;
AxyPrepDNA凝胶回收试剂盒:Axygen-AP-GX-50 型,上海玉博生物科技有限公司。
1.2 方法
1.2.1 试验分组
(1) 人员分组:选择120位志愿者参加试验,任意将其划分成高脂膳食结构组、高糖膳食结构组和高纤维膳食结构组3组,针对每种膳食结构受试者,随机将其划分成对照组和试验组,每组20人。所有受试者均自愿参加试验。
(2) 试验时间:7周。
(3) 试验食品:高脂膳食结构试验组将披萨、汉堡、牛奶巧克力、蛋糕、冰淇淋、油炸食品、糖果作为主要食物[8];高糖膳食结构试验组将米饭、马铃薯、南瓜、西瓜、膨化零食、蜂蜜制品等作为主要食物;高纤维膳食结构试验组将谷物及制品、麦片、豆类及制品、蔬菜、菌类、坚果、水果及肉类作为主要食物。
对照组在试验期间均衡饮食。
1.2.2 肠道微生物菌群变化及DNA提取 对两组受试者新鲜粪便进行采集,每次采集0.2 g左右,放在10 mL经杀菌处理后的EP管中,通过无菌生理盐水将粪便悬液10倍稀释到合理的稀释度,研究受试者粪便中乳酸杆菌、双歧杆菌等肠道微生物的变化。对肠道微生物进行培养,并采用平板菌落计数法对菌落进行计数[10],结果用每克粪便中细菌菌落数的对数值进行描述。
依据试剂盒说明书对人体粪便细菌基因组总DNA进行提取,同时完成对其的质控检测。通过1%琼脂糖凝胶电泳对DNA的完整性进行检测,通过NanoDrop对OD260/280与OD260/230进行检测,同时求出DNA纯度,OD260/280需处于1.8~2.0范围内,DNA浓度需超过50 ng/μL。将DNA样本在冰上融化,充分混匀同时进行离心处理[11]。
1.2.3 PCR扩增与产物纯化 采用的PCR扩增部分是细菌16S rDNA的V3~V4区,选用通用引物338F与806R,20 μL 反应体系[12]。PCR反应在9700型ABI GeneAmp PCR仪上完成,为了提高测序结果的精确度与可靠度,需保证所有样本PCR循环数相同,尽量选择低循环数增加合理浓度。所有样本做3个PCR重复后混合产物,通过2%琼脂糖凝胶电泳对条带尺寸及浓度是否合理进行检测。通过Axygen-AP-GX-50型的AxyPrepDNA凝胶回收试剂盒切胶回收目的PCR条带。
1.2.4 生物学指标测试
(1) 体重:通过体重秤进行测量。
(2) 血糖:通过血糖试纸检测。
(3) PCR产物:通过Illumina Miseq高通量测序平台完成高通量测序[13],采集高质量序列,对其生物学指标进行测试,主要包括操作单元聚类测试、肠道微生物多样性测试。
(4) 操作单元聚类测试:对非重复序列进行采集,通过QIIME研究系统完成对序列的生物信息学分析,和Silva数据库中已有的16S rDNA序列相比,将相似性高于97%的序列合并在一起,产生分类操作单元OUT。
(5) 微生物多样性测试:按照OUT聚类结果,完成alpha与beta多样性求解,通过Ace、Chao1、Simpson、Shannon等指数进行评估,其中Ace、Chao1用于实现微生物丰度评估,Simpson、Shannon用于描述多样性评估。
1.3 统计学处理
试验数据均通过SPSS 11.5统计软件完成分析,处理结果均以(平均值±标准差)的形式描述。
2 结果与分析
2.1 高脂膳食结构对人体及肠道微生物代谢的影响
2.1.1 高脂膳食结构对体重的影响 由图1可知,在试验过程中,两组受试者体重均有所升高,与对照组相比,高脂试验组受试者体重增加情况更加明显。第4周两组受试者间的体重已经存在显著性差异(P<0.05),到试验完成的第6周,存在差异的膳食结构对两组受试者的体重产生了很大的影响,二者间体重存在极显著性差异(P<0.01),说明高脂膳食结构能使人体体重增加。

*. 与对照组相比差异显著(P<0.05) **. 与对照组相比差异极显著(P<0.01)
图1 试验过程中受试者体重改变情况
Figure 1 Subject weight change during the trial
2.1.2 高脂试验后肠道微生物DGGE图谱情况 分析图2 可以看出,高脂试验组第4~6条带及第9条带信号在变弱,表明高脂膳食结构造成上述肠道细菌个数逐渐降低。第7与第8号条带在高脂对照组试验后变浅,然而在高脂试验组中变深,说明高脂膳食结构可促进相应微生物在肠道中的代谢。剩余条带只在高脂试验组中出现,说明高脂膳食结构可促进相应肠道微生物的代谢。
分析表1可知,完成试验后,试验组与对照组间肠道微生物DGGE图谱中条带个数、Shannon指数、均匀度和丰富度都明显比对照组更高,差异具有统计学意义(P<0.05),即试验组受试者肠道微生物多样性比对照组高。
2.2 高糖膳食结构对人体肠道微生物代谢的影响
2.2.1 对体重的影响 分析表2可知,在试验过程中,前4周,试验组与对照组体重无显著性差异(P>0.05),后3周,试验组受试者体重明显高于对照组,差异具有统计学意义(P<0.05)。第4周,试验组受试者体重明显高于对照组(P<0.05),到试验完成的第6周,二者间体重存在极显著性差异(P<0.01),说明高脂膳食结构能使人体体重增加。
2.2.2 对血糖的影响 分析表3可知,对照组在试验不同阶段,除了初始血糖与第2周外,其余阶段血糖值都比试验组低,其中第7周试验组血糖值显著高于对照组(P<0.05),说明高糖膳食结构能够令血糖值升高。在研究高糖膳食结构对人体肠道微生物代谢的影响的过程中,发现试验组受试者体重与血糖均较对照组显著增加,说明高糖膳食结构能够使人体血糖增加,同时存在引起肥胖的危险。
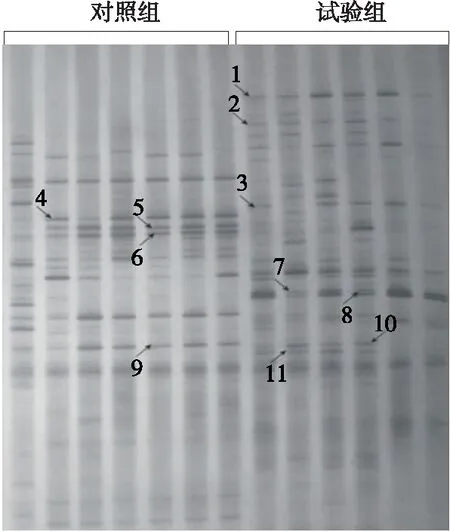
1~11号条带代表的肠道微生物依次是:缓慢葡萄球菌、小牛葡萄球菌、阴沟肠杆菌、费格森埃希菌、大肠杆菌、艾伯氏大肠杆菌、福氏志贺氏菌、杨氏柠檬酸杆菌、大肠杆菌、人口梭菌、扭动反刍球菌
图2 对照组与高脂试验组受试者肠道微生物DGGE图谱
Figure 2 Intestinal microbial DGGE map of control group and high fat test group
2.2.3 对肠道微生物多样性的影响 对粪便细菌基因进行PCR扩增,完成高通量测序,得到的对照组与试验组肠道微生物多样性统计结果见表4。

表1 高脂对照组与高脂试验组受试者肠道总微生物DGGE图谱多样性指数分析†
† *代表与对照组相比差异显著(P<0.05)。

表2 试验组和对照组试验后体重比较†
† *代表与对照组相比差异显著(P<0.05);**代表与对照组相比差异极显著(P<0.01)。

表3 试验组与对照组血糖比较结果†
† *代表与对照组相比差异显著(P<0.05)。

表4 对照组与试验组肠道微生物多样性比较†
† *代表与对照组相比差异显著(P<0.05)。
分析表4可以看出,对照组分类单元比试验组多且差异显著(P<0.05),说明对照组多样性高,测序深度覆盖范围指数均高于0.99,说明样本中序列基本全部被检测到。气旋能量指数与菌种丰富度指数是微生物丰度的体现,试验组气旋能量指数与菌种丰富度指数均明显低于试验组(P<0.05),说明试验组肠道微生物丰富性低于对照组。对照组辛普森多样性指数与香农—威纳指数比试验组高,表明对照组受试者肠道微生物多样性高于试验组。
分析图3可知,试验组与对照组样本肠道微生物均包含后壁菌门与拟杆菌门,并且包含变形菌门与脱铁杆菌门,但含量低。比较两组微生物组成可以看出,试验组样本厚壁菌门含量明显高于对照组,而拟杆菌门含量明显低于对照组。分析其原因,拟杆菌属于不产生孢子、存在胆汁抗性的厌氧革兰阴性杆菌,1 g健康人体粪便中拟杆菌规模可达到3.2×1010个,占整个肠道微生物总量的25%左右[14]。拟杆菌主要负责吸收及降解多糖,主要为人体自身很难利用的植物多糖,增强人体营养利用率。
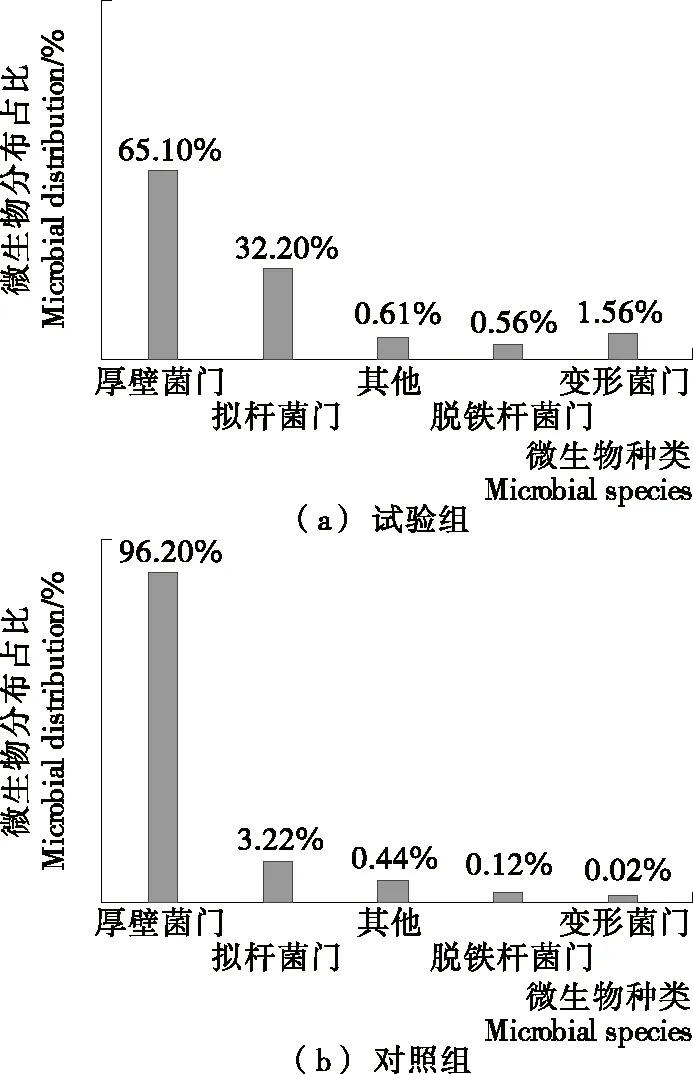
图3 试验组与对照组微生物分布情况
除此之外,拟杆菌还可提高肠黏膜血管产生率的功能。后壁菌门的伪荣球菌属为革兰阴性厌氧球菌,大部分存在于人体自然腔道中,糖类酵解能力差。变形菌门的脱氮硫杆菌为专性无机化能自养型微生物,利用卡尔文循环对二氧化碳进行固定,在氧化时得到能量,同时将硝酸盐当成电子受体产生氮气。
从人体粪便微生物群落丰度与结构的角度分析,对照组受试者与试验组受试者粪便菌群存在显著不同,对照组受试者粪便中微生物丰度及多样性高于试验组,说明高糖膳食结构不利于人体肠道微生物代谢。
2.3 高纤维膳食结构对人体肠道微生物代谢的影响
研究[15]表明,遗传、体力活动、环境和膳食均对人体肥胖产生很大的影响,高脂膳食结构为引起肥胖的关键原因,而肠道微生物代谢在肥胖发展中起决定性作用。肠道微生物结构和数量对人体健康有很大的影响,但因为肠道中大部分微生物当前仍无法在实验室中分离及培养,所以通过分子生态学方法对其进行研究非常关键。
2.3.1 高纤维膳食结构的DGGE图谱比较 肠道有许多种微生物,例如:拟杆菌、脱氮硫杆菌、伪荣球菌等。本试验以人体内普遍存在的条带A、B、C为例进行分析,由图4 可知,条带数量以及丰度不但在不同组间存在差异,而且在同组的同一阶段也存在差异。除此之外,试验组受试者肠道微生物改变幅度相对较低,A、B微生物数量在一定程度上升高,C微生物数量无显著改变。分析试验组和对照组的肠道微生物结构,出现了明显的改变,且丰富度、条带数量、多样性、均匀性均显著增加(P<0.05),说明高脂试验组受试者肠道微生物类型可能比对照组多,这是因为高脂试验组肠道内细菌过渡生长,出现很多有害微生物,说明高脂膳食结构会促进人体肠道有害微生物的代谢。

图4 试验组与对照组肠道微生物DGGE图谱
Figure 4 Intestinal microbial DGGE map of experimental group and control group
2.3.2 高纤维膳食结构对肠道微生物多样性比较 通过灰度分析软件对图4所示的DGGE图像进行分析,依据统计学理论获取丰富度、多样性和均匀性比较结果,用表5 进行描述。
表5对照组与试验组肠道微生物多样性比较
Table5Comparisonofintestinalmicrobialdiversitybetweencontrolgroupandexperimentalgroup

组别丰富度香农—威纳指数均匀性对照组25.1±0.462.41±0.150.802±0.11试验组24.6±0.702.26±0.420.811±0.09
分析表5可以看出,高纤维对照组与试验组丰富度、香农—威纳指数与均匀性无显著性差异。
对A、B、C 3条条带进行切胶与测序研究,同时和Silva数据库(https://www.arb-silva.de)相比,发现微生物A属于拟杆菌门,微生物B属于后壁菌门,微生物C属于变形菌门。随着高纤维膳食结构处理时间的增加,拟杆菌门以及后壁菌门数量在一定程度上有所升高,而变形菌门细菌数量无显著改变。对上述试验进行分析,经高纤维膳食结构处理后,人体肠道拟杆菌与后壁菌门微生物数量都出现了显著改变。本研究发现,受试者摄入高纤维膳食后,可促进肠道有益细菌的繁殖,减少糖血脂与胆固醇的含量,调整机体代谢。然而如果食用高纤维膳食量过少,或者不食用,则肠道有害微生物的种类与数量会有所增加,特别是大肠杆菌、链球菌等。本研究表明,食用一段时间高纤维结构膳食后,拟杆菌门与后壁菌门微生物含量有改变,说明高纤维饮食在很大程度上利用对上述靶细菌的调控发挥生理效应,有助于人体肠道微生物代谢。
3 结论
本试验以肠道中微生物后壁菌门、拟杆菌门为例,研究高脂膳食结构、高糖膳食结构和高纤维膳食结构对肠道微生物代谢的影响,从微生物结构的角度分析,高糖膳食结构会促进肠道有害微生物的代谢;高脂膳食结构会使人体体重增加,对人体肠道微生物代谢造成影响,引起肥胖及高血压、高血脂等疾病;而高纤维膳食结构可促进肠道有益细菌的繁殖,减少糖血脂与胆固醇的含量,调整机体代谢。
本研究仅分析不同膳食结构对人体肠道微生物代谢的影响,未明确分析膳食中的哪种成分对应哪些效果,今后将对此进行深入研究。
