表达牛乳铁蛋白肽的重组鸡源乳酸杆菌抗IBDV感染的研究
2019-07-08林庆宇师一鸣宋丽影李雪纯谭宏超于淑媛姜艳平乔薪瑗徐义刚李一经唐丽杰
林庆宇,师一鸣,宋丽影,李雪纯,谭宏超,于淑媛,姜艳平,2,崔 文,2,乔薪瑗,2,王 丽,2,周 晗,2,徐义刚,2,李一经,2,唐丽杰,2*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.黑龙江省动物疾病防控技术与制剂创制实验室,黑龙江哈尔滨150030)
乳铁蛋白(Lactoferrin,Lf)是广泛存在于动物常乳、初乳及其它外分泌液和嗜中性粒细胞中的铁结合蛋白。1939 年Sorensen 等首次从牛奶中分离出该蛋白[1]。研究显示,Lf 与多种生物学功能和保护作用相关,包括肠道中铁离子的吸收、抗氧化、抗肿瘤、抗炎症和抑菌作用等[2-5]。乳铁蛋白肽是Lf 经胰蛋白酶分解后产生的小肽,具有Lf 的全部生物学功能。牛乳铁蛋白肽LFcin 和LFampin 分别由牛Lf 的aa17~aa41 和aa268~aa284 构成,这两段肽在结构域和空间位置非常接近[6],两段肽均具有杀菌、抗病毒、抑制真菌及调节机体免疫等多种生物学功能。
传染性法氏囊病(Infectious bursal disease,IBD)是由IBD 病毒(IBDV)感染产生的雏鸡免疫抑制性疾病[7],防控该病的主要措施是雏鸡接种弱毒疫苗,但疫苗免疫对雏鸡的法氏囊也存在一定的损伤[8],探究以具有抗病毒功能的乳铁蛋白肽对IBDV 感染的作用具有重要意义。
本研究利用实验室构建的表达牛乳铁蛋白肽的重组鸡源乳酸杆菌pPG-XLFEC/M11,检测其在体外抑制IBDV 增殖的活性,并将重组菌饲喂雏鸡,检测其对雏鸡抵抗IBDV 感染的作用,为表达牛乳铁蛋白肽的重组鸡源乳酸杆菌在生产中的应用,及家禽绿色安全健康养殖提供理想的预防疾病途径。
1 材料与方法
1.1 主要实验材料 电转入重组表达质粒pPG-XL FEC 的鸡源乳酸杆菌(Lactobacillus saerimneri) M11菌株[9]pPG-XLFEC/M11、电转入空载体的乳酸杆菌pPG/M11 菌株、IBDV 弱毒 CEF94 株、强毒UK661株、鸡成纤维细胞DF-1 株和含IBDV CEF94 株VP3基因的阳性标准质粒pMD19-T-VP3,均由本实验室构建并保存;1 日龄SPF 雏鸡购自中国农业科学院哈尔滨兽医研究所。
牛乳铁蛋白肽标准品(LFcin)购自武汉星皓生物科技有限公司;鼠抗牛乳铁蛋白肽多克隆抗体由本实验室制备并保存;兔抗Myc 单克隆抗体(MAb)和HRP 标记山羊抗鼠及抗兔IgG(HRP-IgG)购自英潍捷基(上海)贸易公司;CCK-8 试剂盒购自生工生物工程(上海)股份有限公司;RTAce 购自东洋纺(上海)生物科技有限公司;dNTP、RRI 购自宝生物工程(大连)有限公司;FastStart Universal SYBR Green Master 购自 Roche 公司;Fast 2000 RNA 提取试剂盒购自迅捷生物有限公司;鸡IgG 和SIgA 检测试剂盒购自北京诚林生物科技有限公司。
1.2 重组菌pPG-XLFEC/M11 表达牛乳铁蛋白肽的检测 取2 mL 过夜培养的重组菌pPG-XLFEC/M11,离心后加入终浓度10 mg/mL 的溶菌酶,37 ℃1 h,超声破碎后取上清,以兔抗Myc 标签MAb 为一抗(1∶2 000),以山羊抗兔HRP-IgG (1∶5 000)为二抗,利用western blot 检测上清中牛乳铁蛋白肽的表达,同时以空载体乳酸杆菌pPG/M11 为阴性对照。
另以牛乳铁蛋白肽标准品包被ELISA 板,鼠抗牛乳铁蛋白肽多克隆抗体(1:400)为一抗,以山羊抗鼠HRP-IgG(1:5 000)为二抗,TMB 显色后,测定OD450nm数值,绘制牛乳铁蛋白肽浓度的标准曲线。同一浓度设置3 个重复。根据标准曲线,计算重组菌pPG-XLFEC/M11 上清中牛乳铁蛋白肽的含量。
1.3 重组牛乳铁蛋白肽的细胞毒性检测 将DF-1细胞用0.25%胰酶消化后按2.5×105个/mL 接种于96孔板中,每孔100 μL,长至汇合度为90%。取重组菌培养6 h 后的破菌后上清,按照TCA 浓缩的方法[10]将牛乳铁蛋白肽分别浓缩至2.728 mg/mL、1.364 mg/mL、0.682 mg/mL、0.341 mg/mL、0.1705 mg/mL 后,将pPG/M11 培养后的上清按照相同的方法浓缩至与重组菌表达乳铁蛋白肽为2.728 mg/mL 相同的倍数(50倍),分别加入DF-1 细胞中继续培养96 h,同时设置相同浓度的化学合成肽(LFcin)作为阳性对照,同一个浓度设置5 个平行孔,根据CCK-8 试剂盒说明书检测,分析重组菌表达的牛乳铁蛋白肽对DF-1细胞的毒性作用。
1.4 重组牛乳铁蛋白肽对IBDV 在DF-1 细胞内增殖的影响 将96 孔板中长满单层的DF-1 细胞弃去培养液,取 100 μL TCID50为 10-4.372的 IBDV CEF94株分别与100 μL 浓缩后浓度为2.728 mg/mL 的pPG-XLFEC/M11 破菌后上清,100 μL 2.728 mg/mL 的化学合成肽(Lfcin)以及 100 μL 相同浓缩倍数的pPG/M11 的破菌后上清,在37 ℃、5 %的CO2预先作用1 h,再接种感染DF-1 细胞,同时设正常细胞组和IBDV 组作为对照,每组3 个平行孔,观察细胞状态,当IBDV 对照组发生50 %细胞病变时进行CCK-8 检测,计算感染病毒后的细胞活性。
利用阳性标准质粒pMD19-T-VP3,参照文献方法[11],建立IBDV 标准曲线方程。取各组细胞孔的培养液 100 μL,8 000 r/min 离心 5 min,利用 RNA 提取试剂盒提取上清液RNA 后反转录成cDNA,以其为模板进行qPCR[12]分析各组中IBDV 核酸的拷贝数。
1.5 重组菌对雏鸡抵抗IBDV 感染作用的检测
1.5.1 IBDV 对雏鸡的绝对致死量测定 选取16 只39 日龄SPF 雏鸡,测定 IBDV 强毒株 UK661(EID50为10-4.5mL/ 只)对雏鸡的绝对致死量。按照不同的感染方式设为4 组,分别为:口服400 EID50;口服300 EID50并滴鼻 100 EID50;口服 200 EID50并滴鼻200 EID50;口服100 EID50并滴鼻300 EID50。设置 7 d的观察期,确定IBDV 对雏鸡绝对致死量的条件。
1.5.2 雏鸡饲喂重组菌pPG-XLFEC/M11 及IBDV 感染试验 选取体质量相近的1 日龄SPF 雏鸡45 只,随机分成 3 组,重组菌pPG-XLFEC/M11 组和空载体乳酸菌pPG/M11 组饲喂的活菌数均为2×109cfu/只(取1 mL 过夜培养的乳酸菌离心,用100 μL PBS重悬),对照组饲喂等体积的PBS。自雏鸡7 日龄开始饲喂,每次连续饲喂2 d,间隔10 d 饲喂一次,共3 次。在雏鸡39 日龄时按照1.5.1 的绝对致死剂量条件感染IBDV UK661 株,当对照组出现临床症状时,从各组中分别选取5 只雏鸡,心脏采血处死,剖检取出肝脏、肾脏和法氏囊组织,经4 %多聚甲醛固定,制备石蜡切片及HE 染色,观察雏鸡的组织病理学变化;取上述各组雏鸡采血后的血清及刮取其盲肠的黏液,按照鸡IgG 和SIgA 检测试剂盒操作说明书,测定鸡血清总IgG 与肠黏膜SIgA 抗体;采集3 组鸡的盲肠扁桃体,经液氮研磨后,利用试剂盒提取RNA 并反转录为cDNA,以β-actin为内参基因,以qRT-PCR 方法检测TLR2、IFN-γ、IL-6、IL-8 和 TNF-α 的 mRNA 转录水平[13]。将各组余下的10 只SPF 鸡,设置5 d 的观察期并计算其存活率。
2 结 果
2.1 重组牛乳铁蛋白肽表达的检测结果 重组菌pPG-XLFEC/M11 经溶菌酶作用后,经western blot检测,在约16 ku 处出现特异性反应条带(图1),与预期结果相符,表明牛乳铁蛋白肽在重组菌中获得表达。
ELISA 方法绘制的牛乳铁蛋白肽标准曲线为y=0.459e0.8644x,根据标准曲线计算本研究中重组乳酸杆菌表达的牛乳铁蛋白肽含量为54.56 μg/mL。
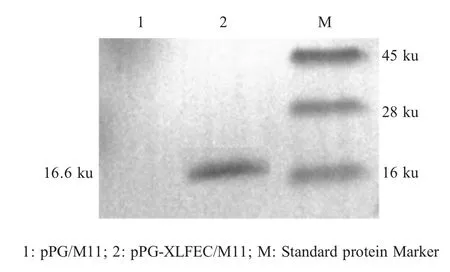
图1 重组牛乳铁蛋白肽表达的检测Fig.1 Identification of the recombinant bovine lactoferrin peptide expression
2.2 重组菌表达牛乳铁蛋白肽的细胞毒性检测 将重组菌表达的牛乳铁蛋白肽按照不同浓度与DF-1细胞共培养96 h 后,利用CCK-8 试剂盒检测细胞活性,结果显示,重组菌表达的牛乳铁蛋白肽含量达到2.728 mg/mL 时(TCA 浓缩上清50 倍),测定的OD450nm数值与2.728 mg/mL 的化学合成牛乳铁蛋白肽组、浓缩50 倍的空菌pPG/M11 上清组以及正常细胞对照组所测定的OD450nm数值相近(图2),表明各组间细胞活性相似,重组菌表达牛乳铁蛋白肽对DF-1 细胞几乎无毒性作用。
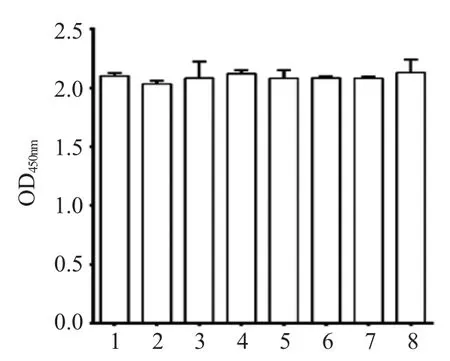
图2 重组牛乳铁蛋白肽对DF-1 细胞的毒性检测Fig.2 Cytotocity of recombinant bovine lactoferrin peptide to DF-1 cells
2.3 重组菌表达牛乳铁蛋白肽对IBDV 在DF-1 细胞内增殖的抑制作用 将浓缩的重组菌破菌后上清与IBDV CEF94 株预处理1 h 后,再作用于DF-1 细胞,培养至病毒对照组出现CPE,利用CCK-8 法检测细胞活性,结果显示,重组菌组与空载体乳酸杆菌pPG/M11 组相比差异显著(p<0.05),与病毒对照组相比差异极显著(p<0.01),重组菌组可以显著改善IBDV 感染引起的细胞活性降低,但其效果不如化学合成肽组明显(图3A)。分析各组中的病毒拷贝数,其中病毒对照组为105.02拷贝/μL,重组菌组为100.72拷贝 /μL,空载体乳酸菌为 102.18拷贝 /μL,化学合成肽(Lfcin)组为100.41拷贝/μL,重组菌组中IBDV的拷贝数明显减少,与空载体乳酸杆菌pPG/M11 组相比差异显著(p<0.05),与病毒对照组相比差异极显著(p<0.01) (图3B)。表明重组牛乳铁蛋白肽可以抑制IBDV 在DF-1 细胞内的增殖。
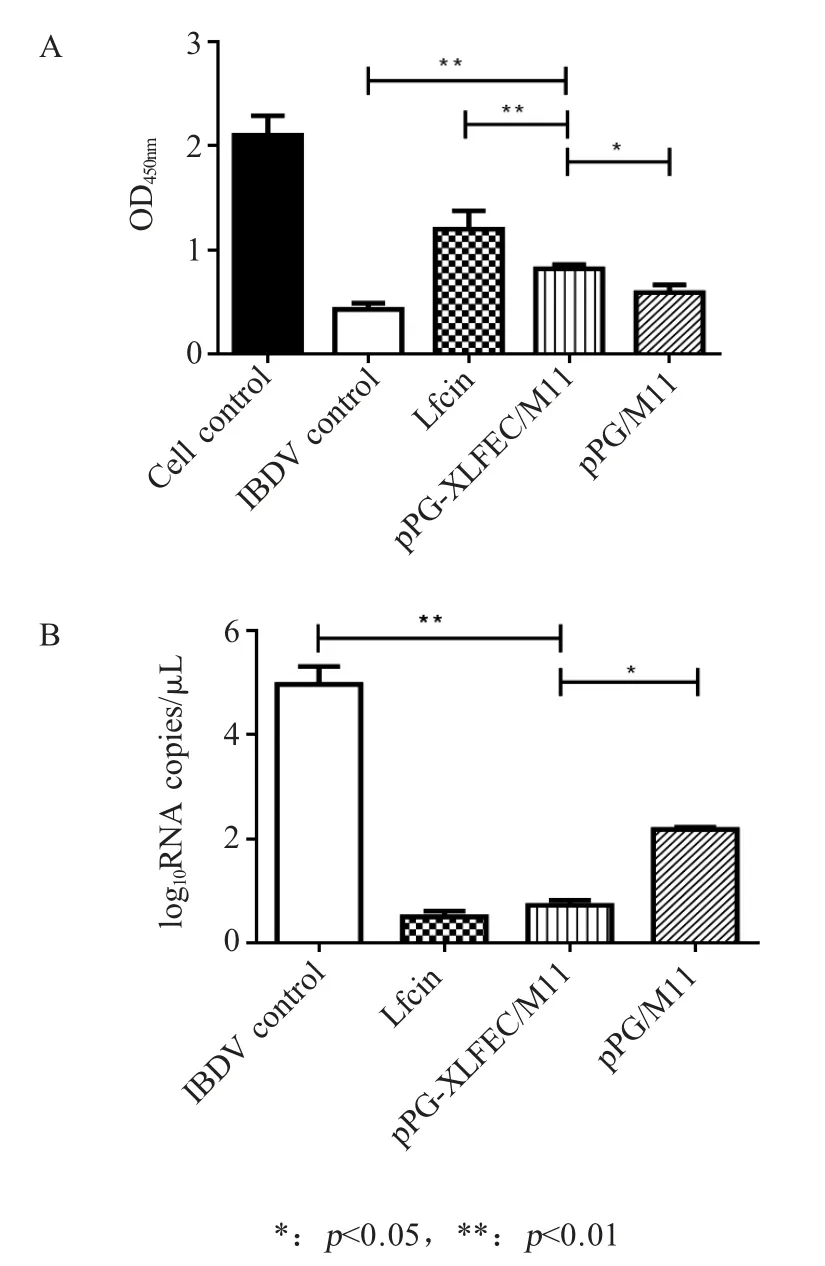
图3 重组牛乳铁蛋白肽对IBDV 的抑制作用Fig.3 The inhibitation effect of the recombinant bovine lactoferrin peptide on IBDV
2.4 重组菌对雏鸡抵抗IBDV 感染的检测作用
2.4.1 重组菌对雏鸡感染IBDV 后的组织病理学影响 将16 只健康的39 日龄SPF 雏鸡随机分为4组,按照不同的感染途径和感染剂量感染IBDV 强毒株UK661,最终确定该病毒株绝对致死量的感染途径和剂量为同时口服300 EID50及滴鼻100 EID50IBDV (图4)。
按照以上确定的感染途径和剂量接种感染IBDV 后,将各组雏鸡心脏采血后处死,采集相应脏器固定后,HE 染色观察雏鸡组织病理学变化情况。结果显示,各组雏鸡的肝脏、肾脏变化均不明显;病毒对照组的法氏囊滤泡萎缩,淋巴细胞大量坏死,结缔组织增生,巨噬细胞浸润;空载体乳酸杆菌pPG/M11 组表现为滤泡萎缩,淋巴细胞大量坏死减少,结缔组织增生,局部少量出血伴少量异嗜细胞和巨噬细胞浸润;而重组菌组的法氏囊滤泡只轻度萎缩,仅个别滤泡内可见异嗜细胞浸润(图5)。表明饲喂表达牛乳铁蛋白肽的重组乳酸杆菌的雏鸡可以在一定程度上抑制IBDV 强毒株感染对雏鸡法氏囊组织的损伤作用。
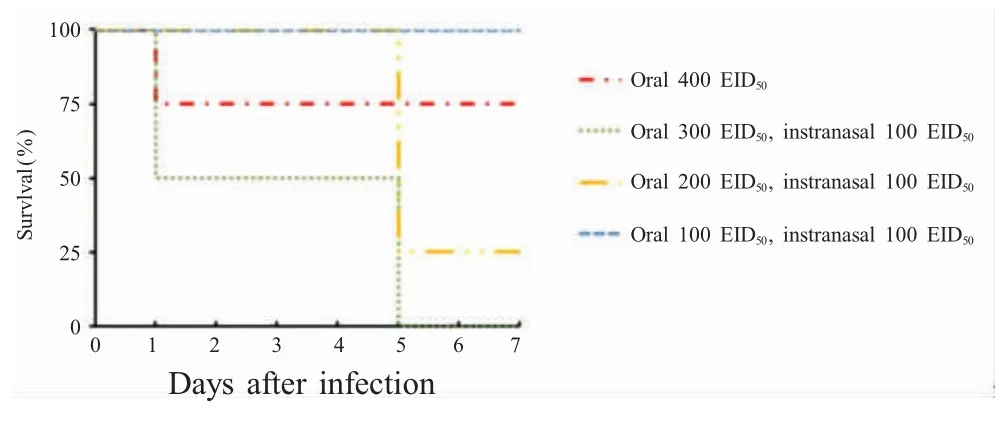
图4 39 日龄雏鸡感染IBDV 绝对致死量的条件Fig.4 Absolute lethal dose of 39 days aged chicken challenged by IBDV
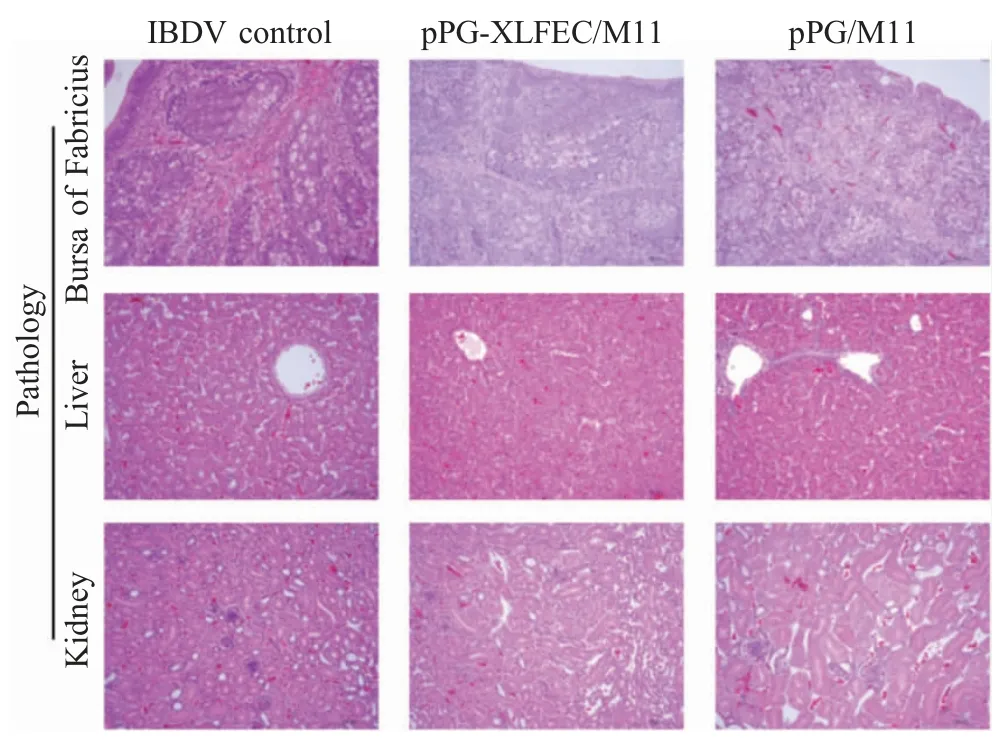
图5 各组雏鸡的组织病理学变化(100×)Fig.5 The histopathological changes of related organ tissues from each group of chicken (100×)
2.4.2 重组菌对雏鸡免疫球蛋白及炎性细胞因子的影响 将试剂盒中提供的标准品按照说明书的剂量加入,酶标仪检测OD450nm的数值,绘制免疫球蛋白浓度与OD450nm数值的阳性标准曲线,计算血清总IgG 和肠黏液SIgA 的含量。结果显示,表达牛乳铁蛋白肽的重组鸡源乳酸杆菌可以有效的提高血清中总IgG 以及肠黏液中SIgA 水平,且血清中的总IgG抗体水平与空载体乳酸杆菌pPG/M11 组相比差异显著(p<0.05) (图 6)。该组 TLR2 与细胞因子 IFN-γ、IL-6、IL-8 和 TNF-α 的 mRNA 相对转录水平均增加,与空载体乳酸杆菌pPG/M11 组相比差异显著(p<0.05) (图7)。表明雏鸡饲喂表达牛乳铁蛋白肽的重组乳酸杆菌,可以增强鸡体非特异性的体液免疫和细胞免疫以及炎症反应信号通路的相关分子水平。
2.4.3 重组菌对IBDV 感染雏鸡存活率的影响 雏鸡感染试验结果显示,在IBDV 感染后的第5 d,对照组雏鸡全部死亡,存活率为0。空载体乳酸杆菌pPG/M11 组雏鸡的存活率为40 %,重组菌组雏鸡的存活率为60 % (图8),表明重组鸡源乳酸杆菌表达的牛乳铁蛋白肽对雏鸡具有一定的抵抗IBDV 感染作用。
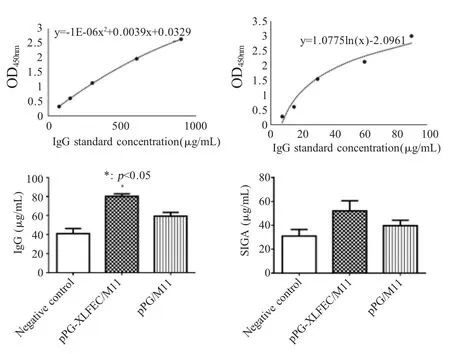
图6 重组菌对雏鸡免疫球蛋白的影响Fig.6 Effect of recombinant Lactobacillus on immunoglobulin
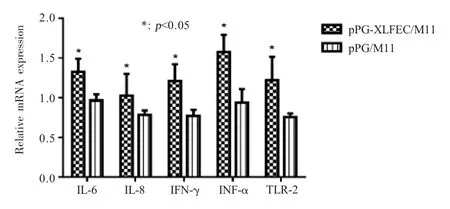
图7 盲肠扁桃体TLR2 和细胞因子的mRNA 相对水平Fig.7 Cytokines and TLR2 mRNA relative level in cecal tonsil
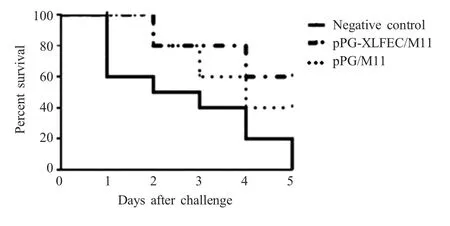
图8 重组菌对IBDV 感染雏鸡存活率的影响Fig.8 Effect of recombinant Lactobacillus on the survival rate of chicken against IBDV infection
3 讨 论
许多学者认为,理想的益生菌种最好是从本动物的肠道中分离出来的[11],本研究采用表达牛乳铁蛋白肽的重组鸡源乳酸杆菌Lactobacillus saerimneriM11 为基因工程菌株,M11[9]是从雏鸡体内分离筛选得到的,具有较强耐酸、耐胆盐以及较好定植能力。由于牛乳铁蛋白肽的表达载体是组成型表达载体,因此牛乳铁蛋白肽的表达无需额外添加诱导剂[14]。经TCA 浓缩,浓度达到2.728 mg/mL 的重组鸡源乳酸杆菌pPG-XLFEC/M11 破菌后上清对DF-1 细胞几乎无毒性,说明重组菌表达乳铁蛋白肽的浓度在2.728 mg/mL 时,DF-1 细胞的生长以及生理活性几乎未受到影响。因此,以2.728 mg/mL 为工作浓度,检测重组鸡源乳酸杆菌pPG-XLFEC/M11 对IBDV 在DF-1 细胞内增殖的影响。乳铁蛋白肽抑制细胞病变的结果表明:浓缩后的重组菌上清与IBDV 预作用1 h 后,重组菌表达的乳铁蛋白肽可以有效地抑制IBDV 引起的DF-1 细胞病变,但该效果不如同浓度下化学合成肽(LFcin)抑制IBDV 引起的DF-1 细胞病变明显;qRT-PCR 检测DF-1 细胞中病毒粒子拷贝数结果表明:浓缩后的重组菌上清与IBDV 预作用1 h 后,DF-1 细胞中IBDV 病毒粒子的拷贝数相对于病毒对照组显著降低,同样地,在相同浓度下化学合成肽(LFcin)组DF-1 细胞中IBDV 病毒粒子的拷贝数更低,这可能是由于用TCA 方法浓缩得到的乳铁蛋白肽不如化学合成的乳铁蛋白肽纯度高所致。乳铁蛋白肽的抗病毒活性可能是其与病毒粒子的直接作用从而抑制了病毒对细胞的侵染[15];也有研究认为抗菌肽首先与病毒粒子表面黏膜分子结合,使病毒失去与宿主细胞结合的位点,从而阻止病毒侵入细胞[16];或者是抗菌肽与细胞表面的一些病毒受体如氨基葡聚糖结合,从而阻止病毒进入细胞内部。
IBDV 自然宿主为鸡和火鸡,3 周龄~6 周龄的仔鸡易感,表现为突然发病,死亡集中发生于几天时间之内,死亡率可达50 %~100 %。本研究将饲喂重组菌后的雏鸡感染IBDV 强毒UK661 株,当对照组雏鸡出现临床症状时采血处死取样,将法氏囊、肝脏和肾脏制成组织切片,然后在100 倍光镜下进行形态观察发现,病毒组的肝脏和肾脏组织几乎没有病理变化,这可能是与IBDV 主要侵染鸡法氏囊有关[17]。重组菌组雏鸡的法氏囊组织没有发生病变或病变较轻,而空载体乳酸菌组和病毒对照组出现淋巴细胞大量坏死和结缔组织增生,可见重组菌能够抑制IBDV 对雏鸡法氏囊组织的损伤。重组菌组雏鸡的TLR2 和相关细胞因子的mRNA 相对水平较空载体乳酸菌组明显升高,TLR 与触发诱导炎性细胞因子和抗病毒分子IFN 的细胞内信号传导途径有关[18]。通过 TLR2 上调激活 IFN-γ 以及 MyD88依赖性信号通路,从而更快的激活NF-κB 通路,激发 IL-6、IL-8 和 TNF-α 有助于诱导 T、B 细胞的分化增殖,参与炎症反应,从而达到抗病毒的效果。血清中IgG 和肠黏膜SIgA 是发挥抗病毒作用的主要抗体,检测结果发现重组菌组的血清总IgG 含量明显高于其它两组,与pPG/M11 组相比差异显著(p<0.05);SIgA 的分泌量也高于pPG/M11 组,表明重组菌能够增强鸡体的体液和黏膜免疫应答水平。
重组菌对IBDV 感染雏鸡存活率的影响结果表明,空载体乳酸菌组相比较对照组雏鸡的存活率明显提高,这可能与乳酸菌的益生作用有关。重组菌组相比较空载体乳酸菌组雏鸡的存活率进一步提高,说明表达牛乳铁蛋白肽的重组鸡源乳酸杆菌对雏鸡感染IBDV 具有较好的保护作用。本研究为表达牛乳铁蛋白肽的重组鸡源乳酸杆菌在生产中的应用以及禽类疾病的预防奠定基础。
