表达EDA-EmIMP1的重组枯草芽孢杆菌的制备及其免疫效果评价
2019-07-08丁可欣林霞琳黄潇航黄志坚殷光文
陈 志,丁可欣,林霞琳,黄潇航,黄志坚,殷光文
(福建农林大学动物科学学院/ 福建省动物药物工程实验室,福建福州350002)
鸡球虫病是对全球禽养殖业危害很大的一种寄生虫病,其中巨型艾美耳球虫(Eimeria maxima)是较常见的鸡球虫。E.maxima具有很好的免疫原性,能够对其它鸡球虫产生交叉免疫力[1]。该球虫感染鸡所产生的抗体,能够作为母源抗体传递给后代,对子代产生持续约3 个月的保护力[2-3]。
疫苗免疫是防治鸡球虫病的有效手段[4-5]。免疫相关蛋白1(IMP1)作为E.maxima中的蛋白,具有良好的免疫原性和免疫保护性[6]。纤维连接蛋白外域A (EDA)作为分子佐剂,能够通过受体4 (TLR4)把抗原传递给树突细胞(DCs)以增强其免疫原性[7-10]。枯草芽孢杆菌(Bacillus subtilis)作为异源蛋白表达系统具非致病性、对人畜无害、完善的分泌系统、利于外源基因产物的纯化和回收等特性[11]。本实验结合枯草芽孢杆菌作为外源基因呈递载体的优势,再将 EDA 作为 EmIMP1 的佐剂,制备 pHT01-EDAEmIMP1 和pHT01-EmIMP1 胞内重组表达质粒,对该重组枯草芽孢杆菌的免疫效果进行评价,为鸡球虫疫苗研究奠定基础。
1 材料与方法
1.1 主要实验材料 1 日龄的海兰褐雄蛋鸡,一级(CV)实验动物,饲养于经过严格杀菌消毒的环境,严格分组并给予足水足料喂养,1 周龄时抽样检查粪便中是否感染任何球虫,确保其未感染。
pET28a-EDA-EmIMP1 和 pET28a-EmIMP1 重 组质粒由本实验室构建保存;1012 枯草芽孢杆菌菌株和pHT01 质粒均购自普健生物(武汉)科技有限公司;pEASY-Blunt Simple 载体、Trans1-T1 抗噬菌体化学感受态细胞、质粒提取试剂盒、PVDF 膜、His 小鼠源单克隆抗体(MAb)、辣根过氧化物酶标记的羊抗鼠IgG (IgG-HRP)均购自北京全式金生物技术有限公司;DNA 连接试剂盒购自生工生物工程(上海)股份有限公司;IL-10 和IL-4 细胞因子检测试剂盒购自武汉华美生物工程有限公司。
E.maxima卵囊(新疆株)由中国农业大学索勋教授惠赠,通过复壮之后保存于本实验室,接种前通过活鸡活化复壮,并观察其数量和活性。
1.2 引物的设计与合成 根据NCBI 数据库中EmIMP1 基因序列(FN813227),参考pHT01 质粒中的酶切位点,设计扩增EmIMP1 和EDA-EmIMP1 基因的引物,引入下列酶切位点(划线部分):XbaⅠ和AatⅡ:EmIMPI-XbaⅠ-5:TCTAGAATGGGGGCCGC TTGCGGGAAATC;EmIMPI-AatⅡ-3:GACGTCTCA GTGGTGGTGGTGGTGTGGTGATC; EDA-EmIMPIXbaⅠ -5: TCTAGAATGAACATTGATCGCCCTAAA GGACT; EDA-EmIMPI-AatII-3: GACGTCTCAGTG GTGGTGGTGGTGGTGATC。由上海生工生物工程技术服务有限公司合成。
1.3 重组枯草芽孢杆菌的制备 根据本实验室保存的 pET28a-EDA-EmIMP1 和 pET28a-EmIMP1 重组质粒为模板进行PCR 扩增,PCR 产物电泳后回收目的片段EDA-EmIMP1 和EmIMP1,连接至克隆载体进行测序。测序正确后将EDA-EmIMP1 和EmIMP1 酶切,分别连接至枯草芽孢杆菌质粒pHT01,构建重组质粒 pHT01-EDA-EmIMP1 和 pHT01-EmIMP1。将其分别转化至Trans1-T1 感受态细胞后接种含Amp抗性的LB 液体培养基摇菌培养,利用质粒小量提取试剂盒提取重组质粒,经酶切和测序鉴定正确后,参照文献[12]方法分别转化1012 枯草芽孢杆菌。经PCR 鉴定为阳性的菌株利用Chl 抗性的2×YT 液体培养基增殖培养。
1.4 重组枯草芽孢杆菌蛋白表达的western blot 鉴定 分别将转化 pHT01-EDA-EmIMP1 和 pHT01-EmIMP1 的重组枯草芽孢杆菌的菌液培养至OD595nm约为0.6 时,加入终浓度为1 mmol/L IPTG 诱导过夜。离心后收集菌体超声裂解,4 ℃10 000 r/min 离心10 min,分别取上清和沉淀进行SDS-PAGE,以His 小鼠源MAb (1∶10 000)为一抗,羊抗鼠IgG-HRP(1∶10 000)为二抗,进行 western blot 分析。
1.5 动物免疫实验 将实验鸡分为5 组,每组10只:EDA 组(免疫pHT01-EDA-EmIMP1 重组枯草芽孢杆菌)、EmIMP1 组(免疫 pHT01-EmIMP1 重组枯草芽孢杆菌)、枯草芽孢杆菌组、空白组(PBS)和攻虫对照组(PBS)。
免疫前一天禁食,每组鸡口服相应菌液(0.3 mL 1010cfu/mL 菌液/ 只),每隔2 周免疫 1 次,共免疫3 次,每次免疫2 周后采血。
1.6 各组鸡EmIMP1 抗体效价的ELISA 检测 采用 100 μL/ 孔的 EmIMP1 抗原蛋白(4 μg/mL)包被 96孔板,将各组三免后分离的血清分别按 1 ∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1 ∶12 800 梯度浓度稀释后作为一抗,以羊抗鼠IgG-HRP (1∶10 000)为二抗,进行 ELISA 检测[1]鸡血清中抗EmIMP1 特异性抗体效价。
1.7 各组鸡血清中IL-10 和IL-4 含量的检测 按照IL-10 和IL-4 的试剂盒说明书检测免疫后不同时间的血清,利用“Curve Expert”软件分析实验结果。
1.8 攻虫试验 将空白组隔离饲养,其余组每只鸡灌喂约2×104个高活性E.maxima卵囊。收集攻虫后5 d~9 d 的鸡粪进行卵囊计数,第5 d 迫杀所有实验鸡观察肠道病变并计分,并称量灌喂球虫时鸡的体重和10 d 后的体重,并计算抗球虫指数ACI[13]。
2 结 果
2.1 EDA-EmIMP1 和EmIMP1 基因的扩增及重组质粒的鉴定结果 将PCR 扩增得到的目的片段EDA-EmIMP1 和EmIMP1 分别克隆于pHT01,构建重组质粒。重组质粒经PCR 鉴定,结果显示分别有与 EmIMP1 (1 160 bp)和 EDA-EmIMP1 (1 446 bp)基因大小相符的特异性条带(图1),表明正确构建重组质粒pHT01-EDA-EmIMP1 和pHT01-EmIMP1。
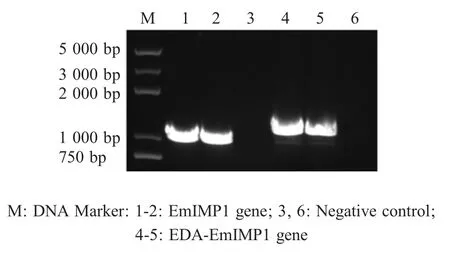
图1 重组质粒的PCR 鉴定结果Fig.1 Amplifications of EmIMP1 and EDA-EmIMP1 genes by PCR
2.2 重组枯草芽孢杆菌的制备与鉴定 将转化重组质粒 pHT01-EDA-EmIMP1 和 pHT01-EmIMP1 的枯草芽孢杆菌菌液经PCR 鉴定,结果显示存在与预期相符的条带(图2),表明正确构建了含有pHT01-EDAEmIMP1 和pHT01-EmIMP1 的重组枯草芽孢杆菌。
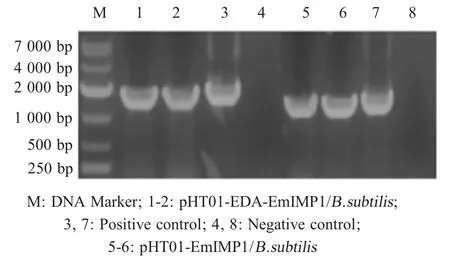
图2 pHT01-EDA-EmIMP1/B.subtilis 和pHT01-EmIMP1/B.subtilis 的 PCR 鉴定Fig.2 Identification of the pHT01-EDA-EmIMP1/B.subtilis and pHT01-EmIMP1/B.subtilis by PCR
2.3 重组枯草芽孢杆菌重组表达蛋白的western blot 鉴定 将转化有重组质粒pHT01-EDA-EmIMP1和pHT01-EmIMP1 的枯草芽孢杆菌分别诱导表达后进行western blot 鉴定,结果显示在约70 ku 处有特异性条带,由于EDA 的片段较小,所以两种蛋白的条带均在70 ku 左右,与目的条带片段相符(图3)。表明了这两种重组蛋白均可以在枯草芽孢杆菌中正确表达。
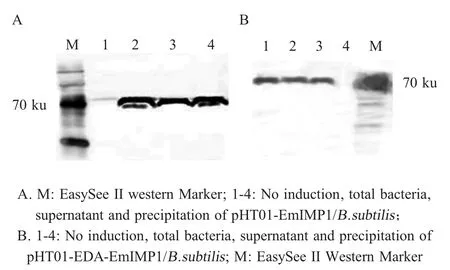
图3 Western blot 鉴定重组枯草芽孢杆菌重组蛋白的表达Fig.3 Identification of recombinant protein expressions from the B.subtilis by western blot
2.4 各组鸡血清中EmIMP1 抗体效价的ELISA 检测结果 利用ELISA 方法检测三免后鸡血清中EmIMP1 抗体的效价,结果显示 1∶3 200 稀释度时EDA 组和EmIMP1 组的OD450nm值依旧大于PBS 组,其中EDA 组的 OD450nm值稍高于 EmIMP1 组,而枯草芽孢杆菌组仅高于PBS 组(图4)。表明重组枯草芽孢杆菌可以诱导机体产生体液免疫,并且佐剂EDA 对鸡体液免疫的提高更显著。
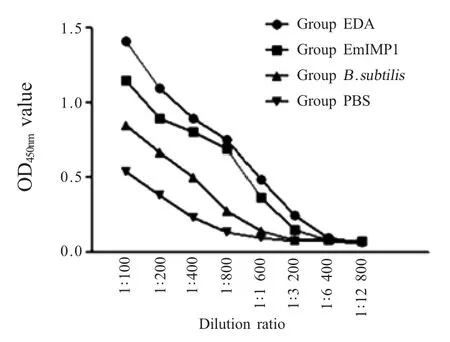
图4 各组鸡三免后抗EmIMP1 抗体效价的检测结果Fig.4 The titration of the antibody against EmIMP1 after the 3rd immunization
2.5 各组鸡血清中IL-10 和IL-4 细胞因子含量的检测结果 利用相应试剂盒检测各组鸡免疫后不同时间的血清中IL-10 和IL-4 细胞因子含量。结果显示,一免后各组鸡IL-10 和IL-4 细胞因子含量差异不显著,EDA 组鸡IL-10 含量稍高。二免后EDA 组鸡IL-10 含量显著高于其它组,EmIMP1 组其次。三免后EDA 组鸡IL-10 细胞因子含量依旧最高。二免后EDA 组IL-4 细胞因子含量稍高于其它组;三免后EDA 组的细胞因子浓度显著提升,并显著高于其它组,而枯草芽孢杆菌组其次,EmIMP1 组浓度稍高于 PBS 组(图5)。表明 EmIMP1 基因单独在pHT01 载体中呈递的效果较差,需要EDA 佐剂才能更好的递呈。
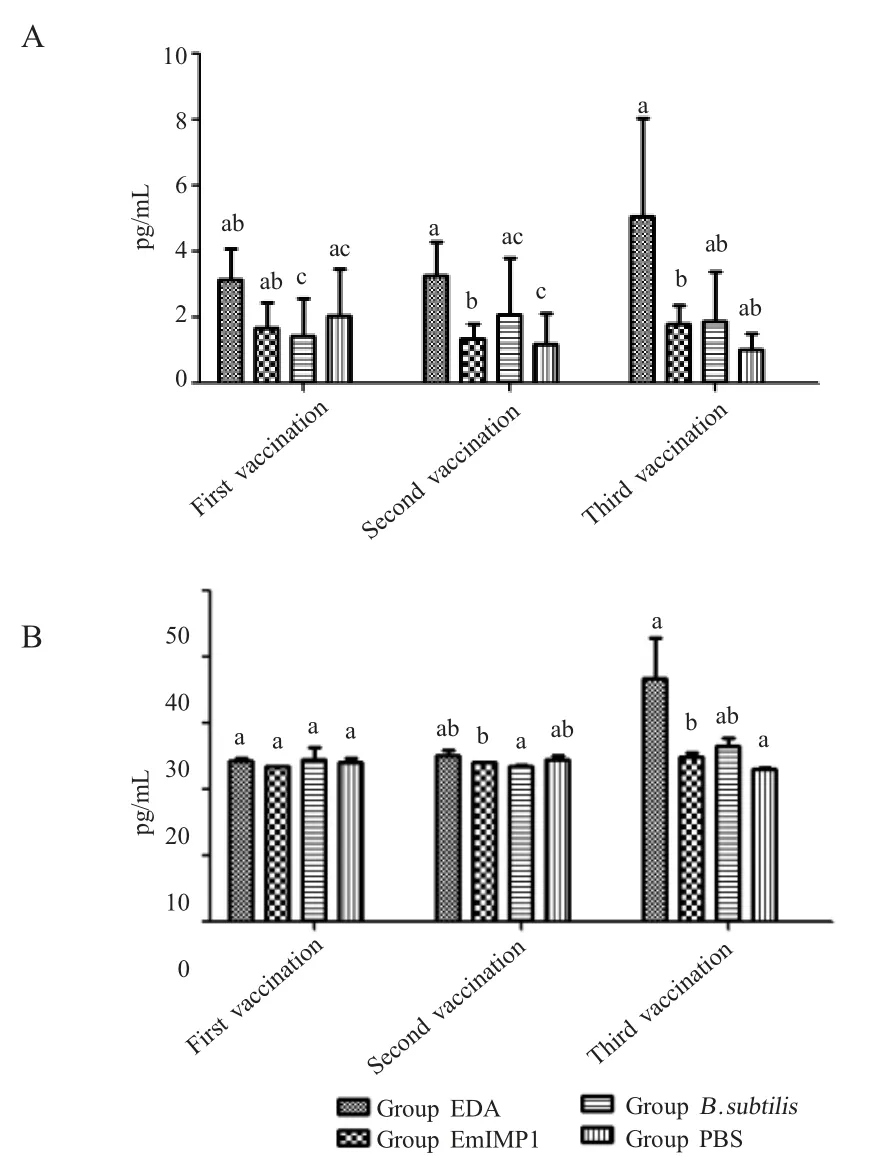
图5 各组鸡IL-10(A)和IL-4(B)含量检测结果Fig.5 The concentration of IL-10 (A) and IL-4 (B)
2.6 攻虫后各组鸡卵囊计数、肠道病变计分、平均增重结果 对各组实验鸡攻虫后收集鸡粪进行卵囊计数,结果显示,EDA 组减少率最高,其次是EmIMP1 组,而枯草芽孢杆菌组最低,各组的数据有显著差异,表明EDA 分子佐剂的加入对减少卵囊排出中有显著的效果。攻虫后第5 d 迫杀鸡观察肠道病变并计分,结果显示EDA 组病变最轻,攻虫组病变最严重,EmIMP1 组和枯草芽孢杆菌组差异不显著,但对肠道均起到一定保护作用,其中EDA 组对肠道保护效果最好。增重实验结果显示,各组鸡攻虫后,EDA 组在10 d 内增重最多,平均增重显著高于其它组,EmIMP1 组其次,攻虫组和枯草芽孢杆菌组增重最少,但EmIMP1 组和枯草芽孢杆菌组差异不显著。EDA 组的抗球虫指数ACI 计算结果为187,空白对照组为200,其它各组均比较低(表1)。表明EDA 佐剂可以提高球虫EmIMP1 抗原的免疫保护效果。
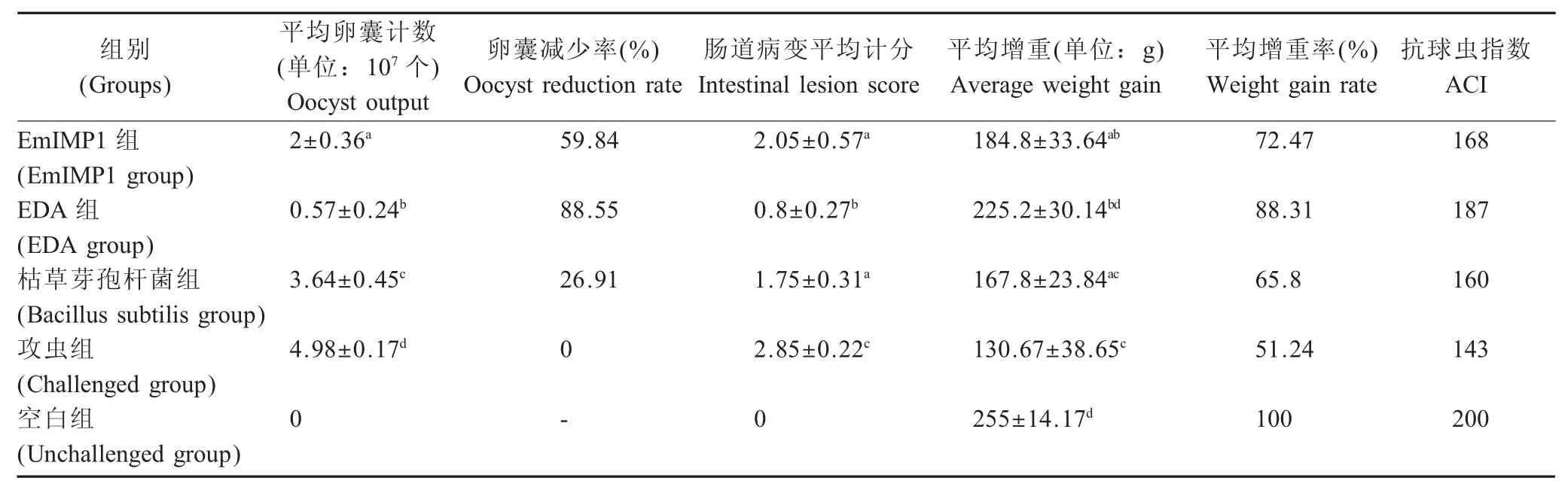
表1 各组鸡攻虫后球虫卵囊计数、肠道病变计分、平均增重结果Table 1 The result of oocyst output, intestinal lesion score and the average weight gain
3 讨 论
本研究利用枯草芽孢杆菌表达E.maxima的免疫保护抗原EmIMP1 以及佐剂分子EDA,研究该重组疫苗激发的免疫反应及其对E.maxima感染的免疫保护作用。结果显示,含有EDA 分子佐剂的重组疫苗激发的抗体反应以及细胞因子反应更强,对E.maxima的感染可以起到更好的抵抗作用。由此表明,枯草芽孢杆菌具有作为球虫活疫苗载体的潜力。而分子佐剂的加入可以更好的促进疫苗的免疫保护效果。
E.maxima是一种肠道原虫,机体体液免疫和细胞免疫在控制该虫感染的过程中均起重要作用[1]。本研究中,EDA 组免疫鸡的抗体效价显著高于其它组,说明EDA 分子佐剂可以激发机体的体液免疫应答,这与前人的研究结果一致。Femel 等将EDA与细菌硫氧还蛋白(Thioredoxin,Trx)的融合蛋白接种至乳腺癌小鼠体内后,小鼠体内能够产生高效价的抗EDA 抗体[14]。这些结果表明,EDA 分子佐剂在促进机体抗体应答方面具有一定的作用。
细胞因子是免疫细胞活化后分泌的,不同的细胞因子在抵抗病原过程中起着不同的作用。本研究中,三免后,EDA 组的IL-10 和IL-4 的水平高于其它各组,由于IL-4 和IL-10 是Th2 型细胞因子,其水平的高低和抗体反应呈正相关。IL-4 可以促进B细胞的活化,进而促进抗体应答的产生。IL-10 在球虫感染致病中起着一定的作用,由于IL-10 可以抑制INF-γ 的分泌以及NO 的产生,进而抑制机体的炎症反应。而适当的炎症反应对于机体抵抗球虫的感染是有利的。但炎症反应过强可以造成机体的损伤,反而不利于机体抗球虫。因此,本研究中IL-10在抗球虫感染过程中的作用还值得深入研究。
枯草芽孢杆菌能调节动物肠道微生态,增强免疫力,分泌多种消化酶,促进动物生长性能及抗氧化能力,还可以作为疫苗活载体,表达和运送外源抗原,激发机体的免疫应答[15-16]。目前,枯草芽孢杆菌作为抗原呈递系统研究出现良好的应用前景,由于该菌生活在动物的肠道,可以直接把外源抗原携带到动物的肠道黏膜部位,激发机体产生较好的黏膜免疫。而良好的黏膜免疫应答对于球虫病的控制是至关重要的。因此,枯草芽孢杆菌具有作为球虫病疫苗活载体的潜力。至于活载体微生物转入的基因是否存在安全隐患,有待长期观察与实验评估。
